Cập nhật các phát hiện về chuyển hóa ở bệnh nhân COPD
Bệnh phổi tắc nghẽn mạn tính là tình trạng bệnh lý đường hô hấp rất thường gặp với tổn thương ở giai đoạn đầu chủ yếu tập trung ở nhánh các phế quản nhỏ và nhu mô phổi. Bệnh có thể dự phòng và điều trị được. Bài viết dưới đây sẽ cung cấp các kiến thức cập nhật các phát hiện về chuyển hóa ở bệnh nhân COPD.
Người dịch: Bác sĩ nội trú Trương Thị Như Hảo, Tiến sĩ, Bác sĩ Cao Thị Mỹ Thúy - Khoa Hô hấp - Bệnh viện Đa khoa Trung Ương Cần Thơ
Tải PDF bản dịch TẠI ĐÂY
1 Tóm tắt
COPD là một rối loạn không đồng nhất với đa dạng về biểu hiện lâm sàng (kiểu hình - phenotypes và “các đặc điểm có thể điều trị" -"treatable traits") và cơ chế bệnh sinh (endotypes). Sự không đồng nhất này gợi ý đề thực hiện cá thể hóa quản lý bệnh cần hướng đến phân loại chính xác từng người bệnh. Với mục tiêu này, bên cạnh các đặc điểm làm sàng sẽ rất hữu ích nếu tìm ra các dấu ấn sinh học. Việc tìm kiếm các dấu ấn này có thể thực hiện thông qua phòng thí nghiệm truyền thống và dựa trên các giả thuyết kỹ thuật hoặc thông qua các phương pháp sàng lọc hiệu năng cao mà không cần có giả thuyết cụ thể, tiếp cận omics phù hợp với phương pháp này. Metabolomics là ngành khoa học nghiên cứu về các quá trình sinh học thông qua các chất chuyển hóa của chúng, sử dụng các kỹ thuật đa dạng như sắc ký khí-lỏng, khối phổ và cộng hưởng từ hạt nhân (nuclear magnetic resonance). Các nghiên cứu metabolomics về COPD nhấn mạnh tầm quan trọng của các chất chuyển hóa trong các con đường chuyển hóa liên quan trực tiếp đến protein (peptid và acid amin), acid nucleic (base nitơ và nucleosid), và lipid và các dẫn xuất (đặc biệt là acid béo, phospholipid, ceramides và eicosanoids). Các phát hiện này cho thấy mối liên hệ giữa các quá trình viêm - miễn dịch, stress oxy hóa, tăng dị hóa và thay đổi trong sản xuất năng lượng. Tuy nhiên, cũng có một số phát hiện cụ thể được báo cáo đặc trưng cho các kiểu hình COPD, đặc điểm dân số, đặc điểm tiến triển bệnh, đợt cấp, biểu hiện toàn thân và các phương pháp điều trị. Tuy nhiên, cho đến nay các nghiên cứu vẫn có một số hạn chế và thiếu sót, và cần xác định lợi ích lâm sàng rõ ràng của các chất chuyển hóa trong quản lý COPD và tính không đồng nhất tiềm ẩn của bệnh.
2 GIỚI THIỆU
COPD là rối loạn phổ biến với những hậu quả nghiêm trọng đối với hệ thống chăm sóc y tế và xã hội [1, 2]. Mặc dù đặc điểm lâm sàng của bệnh có một số điểm phổ biến ở các bệnh nhân, nhưng rất không đồng nhất. Về cơ bản, có thể khác nhau về đặc điểm tiến triển bệnh, tần suất và mức độ nghiêm trọng của các đợt cấp, đặc trưng bởi sự gia tăng các triệu chứng. Với lí do này, nhiều nỗ lực được thực hiện để xác định những khác biệt về mặt biểu hiện lâm sàng COPD, gọi là kiểu hình (phenotypes) hoặc gần đây và cụ thể hơn là "các đặc điểm có thể điều trị được" ("treatable traits") [3].
Cổ điển nhất là khí phế thũng và viêm phế quản mạn, mặc dù trong thập kỷ qua những nhóm bệnh nhân có đợt cấp thường xuyên hoặc tăng bạch cầu ái toan và/ hoặc hội chứng chồng lấp hen - COPD (ACO) cũng được đưa vào. Mặt khác, bệnh biểu hiện khác nhau tùy thuộc vào tuổi và giới, trong đó một số bệnh nhân biểu hiện suy giảm chức năng phổi nhanh chóng hay giảm trọng lượng cơ thể và khối lượng cơ, rối loạn chức năng cơ, liên quan đến tim mạch hay thậm chí là ung thư phổi. Không thể phủ nhận, đa phần bệnh nhân COPD đều mang các cơ chế sinh lý bệnh chung, nhưng sự không đồng nhất về mặt lâm sàng gợi ý rằng vẫn có những khía cạnh khác biệt về các kiểu bệnh sinh (endotypes) đặc trưng trong từng cá thể [1, 2]. Cả thời điểm bắt đầu có những biến đổi dẫn đến khởi phát của bệnh, cũng như sự tương tác tác động của nhiều yếu tố gây hại đối với hệ thống miễn dịch cơ thể và các hoàn cảnh song hành khác đều ủng hộ tính đặc hiệu tương đối trong một số cơ chế. Điều này mang đến hai kết cục lâm sàng quan trọng. Một là, tồn tại các dấu ấn tiềm năng có khả năng phân biệt các bệnh nhân với đặc điểm lâm sàng đa dạng. Hai là, khả năng xác định mục tiêu điều trị cụ thể cho từng trường hợp. Tuy nhiên chúng ta vẫn chưa có một phân loại chuẩn xác cho từng bệnh nhân COPD hưởng đến chăm sóc cá thể hóa và chính xác hơn. [4]. Điều này đáng lo ngại khi mà các liệu pháp mới cho phép sửa chữa chính xác các cơ chế bệnh sinh nêu trên liên tục được nghiên cứu và áp dụng lâm sàng [5]. Đây là phương pháp tiếp cận phổ biến trong một số bệnh lý hô hấp, như hen và xơ hóa phổi [6, 7]. Do đó, điều quan trọng hiện nay là xác định rõ các cơ chế hiện diện ở mỗi nhóm bệnh nhân và tìm kiếm các đặc điểm nào giúp phân loại từng trường hợp cụ thể. Theo đó, đã có một số dấu ấn sinh học trong máu tương quan với kết cục lâm sàng từ đó thúc đẩy các khuyến cáo điều trị chính xác như số lượng bạch cầu ái toan trong máu ngoại vi [1, 2]. Tuy nhiên, vẫn cần tìm kiếm chuyên sâu hơn về các dấu ấn và từ đó tìm ra các “kiểu nội hình" chuyên biệt cho phép phân loại chính xác bệnh nhân thành các phân nhóm đồng nhất. Việc tìm kiếm các dấu ấn sinh học này có thể được thực hiện theo hai cách tổng quát khác nhau. Cách truyền thống nhất là hướng phương pháp nghiên cứu tiếp cận theo giả thuyết cụ thể, bắt nguồn từ kiến thức đã có và thường sử dụng các kỹ thuật phòng thí nghiệm truyền thống. Cách khác là "tìm kiếm quét” (scanning search) (làm mù ít hay nhiều) sử dụng các kỹ thuật tìm kiếm khảo sát quy mô lớn mà không có hoặc giả thuyết chưa được mô tả đầy đủ. Đối với phương pháp này, các kỹ thuật hiệu suất cao, như liên quan đến khoa học omic trở nên nổi bật vì tính hữu dụng. Đây không hoàn toàn mù vì việc tìm kiếm luôn dựa trên kinh nghiệm từ trước và tài liệu sẵn có về một chủ đề cụ thể. Tuy nhiên, để có thể tìm kiếm các chất có khả năng trở thành dấu ấn sinh học tốt, phải được xác nhận thêm bằng các phương pháp tương tự hoặc phương pháp khác trong các nhóm bệnh nhân khác. Hơn nữa, việc phân tích các chất tiềm năng sẽ gợi ý các cơ chế sinh bệnh học liên quan từng trường hợp góp phần mang lại hiệu quả trong chẩn đoán, quản lý và điều trị [8].
Khoa học Omic bao gồm các cơ sở khái niệm hoặc phân tử khác nhau. Bao gồm: môi trường tiếp xúc (exposome) hay vi sinh vật (microbiome), và hệ phiên mã (transcriptomics), hệ protein (proteomics) hoặc chất chuyển hóa (metabolomics). Metabolomics là khoa học nghiên cứu về các chất chuyển hóa trong mẫu bệnh phẩm (thường từ sinh vật sống), từ đó suy ra các quá trình trao đổi chất cơ bản. Các chất chuyển hóa này gồm carbohydrate, lipid, acid amin, peptid, các thành phần của acid nucleic và một số chất khác.
Bệnh lý hô hấp gồm COPD, liên quan đến những thay đổi chuyển hóa trong cơ chế sinh bệnh học (viêm hệ thống và đường thở, stress oxy hóa, v.v.) có thể được phân tích thông qua các công cụ chuyển hóa. Các công cụ này được thiết kế nhằm mục đích phát hiện và cuối cùng là định lượng các tín hiệu (được gọi là “chất phân tích"), từ đó cho phép xác định nguồn gốc phân tử của chúng. Từ đó, các kỹ thuật bổ sung (hồ sơ dựa trên các công cụ tin-sinh học) sẽ gợi ý các con đường trao đổi chất có khả năng cao nhất tham gia vào tình huống cụ thể. Các kỹ thuật phân tách chất phân tích bao gồm điện di mao dẫn, sắc ký khí và lỏng (gas chromatographiess - GC, lipid chromatographies - LC), và đặc biệt là sắc ký lỏng hiệu suất cao (High-presure LC - HPLC) và sắc ký lỏng “hiệu suất cực cao" (ultra-high performace LC - UHPLC) [9, 10]. Các chất phân tích cũng có thể được phân tách trực tiếp bằng phương pháp khối phổ (mass spectrometry MS). Tuy nhiên, kỹ thuật gần đây chủ yếu sử dụng để xác định (và cuối cùng là định lượng) các chất phân tích khi chúng đã được phân tách bằng một trong các phương pháp nói trên [11]. lon hóa phun điện tử (Electrospray ionisation - ESI), là phương pháp chuyển các ion từ các đại phân tử sang pha khí, có thể được sử dụng cho khối phổ tiếp theo. Sự kết hợp này được gọi là ES-MS và có thể được tối ưu hóa bằng cách kết hợp với phép đo khối phổ liên tục (MS/MS, được xác định bằng việc sử dụng lần lượt hai hoặc nhiều máy đo khối phổ). MS/MS đặc biệt hữu ích để phát hiện các peptid, protein, và cũng có thể được kết hợp với các hệ thống GC hoặc LC, như HPLC. Tứ cực thời gian bay (Quadrupole time of flight - Q-TOF hay QTOF) là một dạng của MS kết hợp sử dụng bốn thanh cực (quadrupole) song song và một ô va chạm, với việc tính toán thời gian bay (Time of flight-TOF) cho mỗi ion, tăng cường độ nhạy và tốc độ. Cuối cùng, quang phổ cộng hưởng từ hạt nhân (nuclear magnetic resonance spectriscopy - NMRS) cho phép xác định các chất chuyển hóa mà không cần phân tách chúng trước [12]. Mặc dù kết quả các nghiên cứu chuyển hóa thường được thể hiện dưới dạng tương đối, một số phương pháp chuẩn hóa được đề xuất để tiếp cận so sánh các kết quả của các tác giả khác nhau [13].
Yếu tố quan trọng khác của nghiên cứu chuyển hóa áp dụng cho tình trạng bệnh là loại bệnh phẩm được phân tích. Các loại bệnh phẩm đặc trưng cho một cơ quan nhất định thường khó thu thập nhưng rất có giá trị vì chúng phản ánh các sự kiện chính diễn ra trong rối loạn [14]. Ngược lại, máu, nước tiểu, nước bọt hay mồ hôi dễ thu thập, nhưng chỉ phản ánh gián tiếp những gì đang diễn ra trong một cơ quan hay hệ thống cụ thể. Trong bệnh lý hô hấp, bệnh phẩm từ hệ hô hấp gồm nhu mô phổi, biểu mô phế quản, khi thở ra ngưng tụ và dịch tiết đường thở (dịch hút phế quản, dịch rửa phế quản phế nang (BAL) và đờm,...). Tuy nhiên, trong trường hợp COPD, điều quan trọng cần lưu ý là đây là rối loạn với các biểu hiện toàn thân và các bệnh đồng mắc. Điều này làm gia tăng giá trị của các phát hiện thu được trong các mẫu máu.
Cuối cùng, do các nhóm nghiên cứu tham gia vào các nghiên cứu chuyển hóa thuộc các lĩnh vực và chuyên môn kỹ thuật riêng, vì vậy kết quả có thể có những hạn chế hoặc thiếu sót và một số lược bỏ không cố ý khi diễn giải bức tranh chuyển hóa tổng thể. Chỉ có cách tiếp cận tích hợp bao gồm các phát hiện có liên quan nhất được cung cấp bởi các nhóm và kỹ thuật khác nhau mới có thể cho chúng ta một bức tranh rõ ràng về kiến thức hiện tại về chuyển hóa chất trong COPD.
Trong các phần sau đây, phần yếu tố tiếp xúc liên quan nhiều nhất đến tiềm năng phát triển thành COPD trong tương lai và tác động của chúng đối với chuyển hóa sẽ được xem xét trước tiên. Tiếp theo là phần với các kết quả được báo cáo cho COPD như là một bệnh đồng nhất, không phân biệt kiểu hình hoặc các đặc điểm khác có thể ảnh hưởng đến kết quả. Cuối cùng, bài tổng quan này sẽ tập trung vào những nghiên cứu đã xác định các kết quả chuyển hóa bằng cách xem xét sự hiện diện của đợt cấp, kiểu hình COPD hoặc các yếu tố khác cũng có thể ảnh hưởng đến hồ sơ chuyển hóa.
3 YẾU TỐ MÔI TRƯỜNG TIẾP XÚC
Môi trường là tập hợp các yếu tố bên ngoài và bên trong tác động lên một cá nhân từ khi thụ thai (và thậm chí trước đó) đến khi mất đi. Trong COPD, hút thuốc lá là yếu tố truyền thống bên ngoài quan trọng nhất, cùng song hành với sự hình thành và phát triển của hệ thống miễn dịch đối trọng bên trong. Cả hai yếu tố này tương tác linh hoạt trong suốt cuộc đời của bệnh nhân. Ngoài ra cũng có nhiều yếu tố khác: ô nhiễm môi trường, tiếp xúc với khói gỗ hoặc than củi, lối sống, giai đoạn sớm của quá trình phát triển phổi và microbiome,... Tác động tổng hợp và tương tác lẫn nhau của các yếu tố này dẫn đến những thay đổi sinh lý và sinh lý bệnh ở mỗi bệnh nhân hoặc nhóm bệnh nhân. Điều này được phản ánh qua các chất chuyển hóa trong từng giai đoạn bệnh [15, 16].
3.1 Thuốc lá
Tác động của hút thuốc lá lên trao đổi chất rất đa dạng nhưng chỉ một số phát hiện quan trọng nhất được đề cập. Một trong những nghiên cứu có liên quan nhất, thực hiện với mẫu máu của người hút thuốc tìm thấy mối liên quan đáng kể giữa chức năng phổi và các loại Phospholipid khác nhau (cả glycerophospholipids và sphingo phospholipids) [17]. Một số tác giả khác cũng báo cáo mối liên hệ tương tự, mở rộng đến các acid amin phân nhánh (leucine, isoleucine và valine), eicosanoids [18-20], fibrinogen [21] hay chuyển hóa một số ion [22]. Phụ nữ mang thai hút thuốc lá cho thấy sự thay đổi ở nhiều acid amin và chu trình urê [23]. Mặt khác, một số bất thường khác như quá trình methyl hóa các phân tử khác nhau (bao gồm cả DNA) được báo cáo ở người sử dụng các biện pháp thay thế thuốc lá mới như thuốc lá điện từ [24]. Ngay cả việc tiếp xúc thụ động với khói thuốc lá cũng làm thay đổi quá trình chuyển hóa phospholipid, acid amin, peptid và các thành phần purine, ảnh hưởng đến tình trạng viêm, stress oxy hóa và các con đường truyền tín hiệu tế bào [25, 26]. Tuy nhiên, các nghiên cứu gần đây chỉ ra việc bỏ hút thuốc có thể khôi phục một phần đặc điểm trao đổi chất ở những người đã từng hút thuốc [27].
3.2 Sản phẩm sinh khói và ô nhiễm không khí
Khói đốt từ các vật liệu như củi và than là yếu tố quan trọng trong sự phát triển của COPD ở nhiều quốc gia không chỉ ở các nước đang phát triển [28-30], vì thế có thể làm gia tăng tác động của việc hút thuốc lá [30]. Mặc dù chưa có nhiều nghiên cứu chuyên sâu về các quá trình chuyển hóa cụ thể, nhưng đã có một số nghiên cứu về việc tiếp xúc với các hạt bụi phát sinh từ quá trình đốt cháy sinh khói, theo đó, việc tiếp xúc với các hạt nhỏ và thậm chí các hạt siêu mịn có thể gây ra những thay đổi trong phospholipid và glutathione, ảnh hưởng đến các cấp độ của quá trình viêm và stress oxy hóa, đồng thời gây tổn thương các mô và phân tử quan trọng [31]. Các nghiên cứu chuyển hóa về ô nhiễm môi trường báo cáo những thay đổi trong nhiều loại lipid, carbohydrate và acid amin, nucleotid, vitamin và hormone [31-35] ngay cả khi tiếp xúc tương đối ngắn. Một lần nữa, những con đường bị ảnh hưởng mạnh mẽ nhất là liên quan đến tình trạng viêm, stress oxy hóa và trong trường hợp này là cả quá trình chuyển hóa steroid [15, 32]. Hầu hết những biến đổi này dự báo sự khởi đầu của các bệnh lý hô hấp.
3.3 Tổng kết
Môi trường là nhân tố thiết yếu trong sinh bệnh học của COPD. Tác động của việc hút thuốc lá chủ yếu liên quan đến quá trình chuyển hóa phospholipid và acid amin phân nhánh với sự methyl hóa bổ sung của các phân tử khác, cùng nhau tạo điều kiện để kích hoạt các con đường viêm và stress oxy hóa. Tuy nhiên, những tác dụng này có thể hồi phục tương đối sau khi ngưng hút thuốc lá. Ô nhiễm môi trường và hít phải khói bụt mặc dù ít được nghiên cứu hơn nhưng cũng chứng minh được có tác động tương tự, ngoài ra còn gây những biến đổi trong quá trình tổng hợp một số hormone.
4 COPD “LÀ RỐI LOẠN ĐƠN ĐỘC"
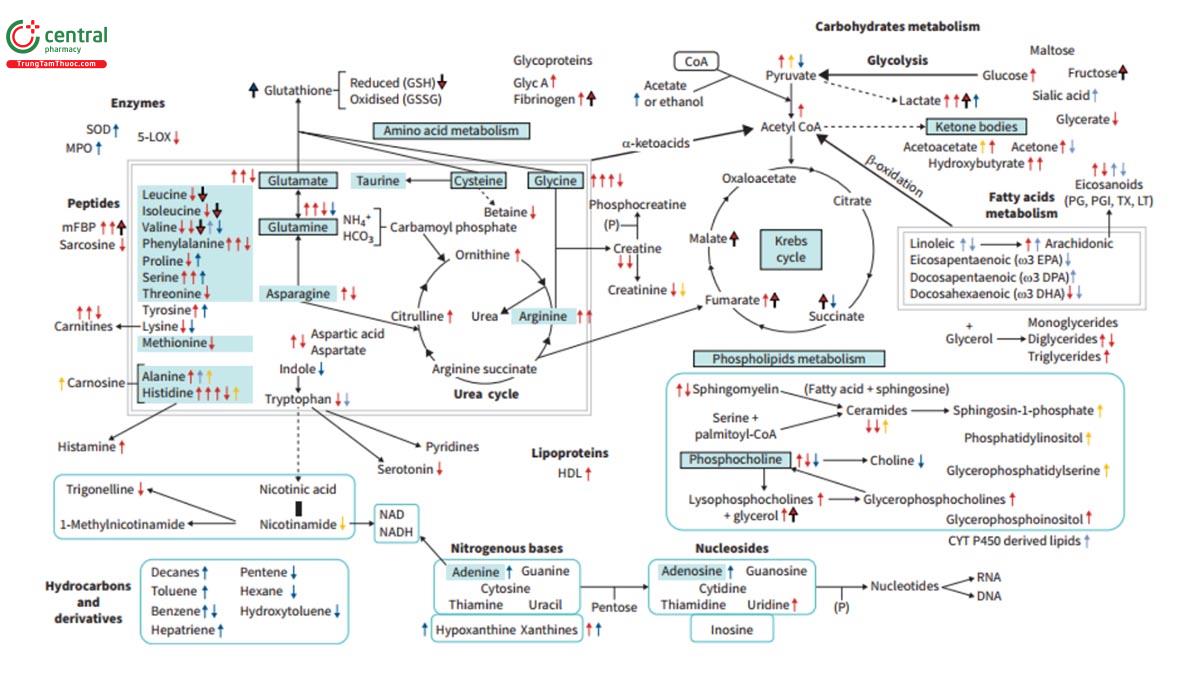
Những thay đổi đáng kể về chuyển hóa tìm thấy ở những bệnh nhân COPD (hình 1), mặc dù ý nghĩa của chúng cần được làm rõ để ứng dụng vào thực hành lâm sàng. Một số nghiên cứu được thực hiện với các bệnh phẩm đường hô hấp, nhờ việc lấy bệnh phẩm dễ dàng hơn nên hầu hết các nghiên cứu đều thu thập từ máu (huyết tương hoặc huyết thanh). Một số ít nghiên cứu tiến hành trên mẫu nước tiểu hoặc thậm chí phân. Hầu hết các tác giả so sánh kết quả giữa bệnh nhân COPD so với nhóm đối chứng là đối tượng khỏe mạnh, mặc dù một khía cạnh luôn cần được xem xét là liệu những người này có hút thuốc lá hay không, vì như đã đề cập ở trên, thuốc lá có thể gây ra các biến đổi trong quá trình chuyển hóa.
4.1 Phát hiện từ các bệnh phẩm đường hô hấp
4.1.1 Mô phổi và đường thờ
Rất ít nghiên cứu về chuyển hóa được thực hiện trên mô phổi bệnh nhân, một số tác giả đã tìm thấy những thay đổi trong nhiều loại phospholipid (cụ thể là phosphatidylinositol và phosphatidylserine), chủ yếu liên quan đến sự hiện diện và mức độ khí phế thũng [36]. Các nghiên cứu khác đã cố gắng xác định cấu hình lipid cụ thể, đặc trưng với mức độ nghiêm trọng của bệnh và bệnh nhân COPD nhẹ hoặc trung bình có nồng độ ceramide trong mô phổi cao hơn so với người khỏe mạnh, điều này có thể phản ánh sự gia tăng mức độ phá hủy nhu mô [37]. Ngược lại, bệnh nhân COPD nặng có nồng độ phospholipid sphingosine-1-phosphate cao hơn nhưng nồng độ ceramide nói trên lại thấp hơn [37], điều này cho thấy sự phá hủy mô không còn hoạt động mạnh mẽ như trước.
4.1.2 Dịch rửa phế quản - phế nang (Bronchoalveolar lavage - BAL)
Tương tự với các bệnh phẩm khác từ hệ hô hấp, vấn đề là không biết chính xác mức độ pha loãng của bệnh phẩm khi phân tích kết quả BAL. Điều này có thể cản trở sự so sánh, không chỉ giữa các cá nhân hoặc nhóm thuộc cùng một nghiên cứu mà còn với kết quả từ các nghiên cứu khác nhau. Trong mọi trường hợp, mối liên quan được nhắc đến của COPD là những biến đổi không chỉ ở một số lipid (chủ yếu là acid béo và phospholipid, các chất trung gian có nguồn gốc từ cytochrom P450), mà còn ở các acid amin (threonine, glycine, cysteine và homocysteine) và peptide (ví dụ những chất có chứa valine và alanine), đã được báo cáo (hình 1), cũng tỷ lệ thuận với mức độ suy giảm chức năng [14, 38, 39].
4.1.3 Đờm hút
Đây là bệnh phẩm dễ dàng lấy trực tiếp từ đường hô hấp và do đó, thường được sử dụng trong nhiều nghiên cứu. Trong nghiên cứu của ESTHER và cộng sự, [40] các tác giả quan sát thấy bệnh nhân COPD có sự gia tăng acid sialic và các chất chuyển hóa khác liên quan đến quá trình tổng hợp hay biến đổi acid nucleic, như các base nitơ và các dẫn xuất purine (adenine và methylthioadenosine, hypoxanthine và xanthines), cũng như ở mức độ glutathione, là hợp chất có vai trò quan trọng trong việc kiểm soát stress oxy hóa. Trong một nghiên cứu khác được công bố bởi Van Derdoes và cộng sự [41], bệnh nhân COPD giai đoạn ổn định biểu hiện sự gia tăng w-3 DPA (acid docosapentaenoic) và acid arachidonic và có sự giảm các acid béo và các dẫn xuất của chúng (linoleic, linolenic, w-3 EPA (eicosapentaenoic) và w-3 DHA (acid docosapentaenoic)). Hơn nữa, sự gia tăng acid arachidonic quan sát thấy ở những bệnh nhân này là thứ yếu do những thay đổi trong quá trình chuyển hóa spingilipids [42]. Các phân tử khác có nguồn gốc lipid, như eicosanoids, cũng có những biến đổi cụ thể được tìm thấy trong đờm bệnh nhân COPD, cho thấy sự gia tăng một số leukotrienes (LTD4 và LTE4), prostaglandin (PGD2, PGE2, PGF2a và các dạng đồng phân của chúng) và Thromboxanes (TBX2), một số acid eicosatetranoic, đồng thời giảm một số chất chuyển hóa của cùng loại prostaglandin (PGEM từ PGE1 và PGE2, và PGDM từ PGD2) (hình 1) [43]. Liên quan đến những thay đổi aicd amin, một nghiên cứu khác đã báo cáo sự suy giảm chuyển hóa tryptophan, về cơ bản là do giảm acid hydroxyl indoleacetic, thứ phát do hoạt động của interleukin-22 (IL-22). Chuỗi sự kiện này có thể liên quan đến con đường chết theo chương trình của tế bào và hệ vi sinh vật thường trú của những bệnh nhân này [44].
Các nghiên cứu khác báo cáo một số điểm khác biệt quan trọng trong đờm của bệnh nhân COPD từ nhẹ - trung bình so với mức độ nặng. Một trong số đó, sự khác biệt đạt đến 500 chất chuyển hóa khác nhau [45], nhấn mạnh các quan sát ở bệnh nhân mức độ nặng có liên quan đến glycerophospholipids, với sự gia tăng đồng thời của enzyme chống oxy hóa mạnh: enzym superoxide dismutase (SOD), myeloperoxidase (MPO) và dạng đồng phân của prostaglandin PGF2a. Tất cả những thay đổi này được cho là có liên quan đến mức độ stress oxy hóa tại phổi [45].
4.1.4 Khí thở ra ngưng tụ
Mặc dù khí thở ra là bệnh phẩm có giá trị tiềm năng lớn nhưng việc thu thập và phân tích cũng đặt ra nhiều vấn đề về phương pháp học như đã đề cập trước đó (mức độ pha loãng bệnh phẩm), khả năng bị tạp nhiễm bởi các chất ngoại lai đến người thực hiện [46]. Tuy nhiên, chúng cũng có một số ưu điểm vì cho phép thu thập một số chất chuyển hóa khó xác định trong các mẫu bệnh phẩm khác (ví dụ hợp chất hữu cơ dễ bay hơi và một số phân tử vô cơ) (hình 1) [46-48]. Một trong những công bố đầu tiên về khí thở ra ở bệnh nhân COPD, tác giả De Lurentis và cộng sự [49] thấy rằng lượng pyruvate trong khí thở ra giảm hơn so với nhóm đối chứng, với sự thiếu hụt succinate, một phát hiện chỉ ra sự biến đổi nghiêm trọng quá trình sản xuất năng lượng trong chu trình Krebs. Không có dấu vết của acid amin glutamine, cũng như Choline (hợp chất cần thiết cho quá trình tổng hợp các loại phospholipid khác nhau, sản phẩm thoái hóa) hoặc bất kỳ chất chuyển hóa trung gian của chúng (như phosphorylcholine, trimethylamine oxit), những chất này ngược lại được tìm thấy trong nhóm đối chứng [49]. Trong nghiên cứu sau đó, cũng thực hiện với khí thở ra, cùng các tác giả đã quan sát thấy sự khác biệt giữa cả hai nhóm về Ethanol, lactate, acid amin threonine, acetoin (tham gia vào quá trình tổng hợp acid amin phân nhánh), một số acid béo và propionate [50]. Những kết quả này đã được công nhận một phần 2 năm sau đó nhưng được mở rộng bằng việc bổ sung của sự gia tăng lượng acetat và nhiều acid amin hơn (như proline, serine và tyrosine) trong COPD, cùng với lượng axeton và các acid amin khác (lysine và valine) giảm [51]. Trong một nghiên cứu khác, tác giả Bregy và cộng sự [52] quan sát thấy sự khác biệt đáng kể giữa bệnh nhân và nhóm đối chứng, đặc biệt là liên quan đến acid béo, acid amin và aldehyd. Một số nghiên cứu tập trung vào các hợp chất dễ bay hơi báo cáo rằng bệnh nhân COPD có nồng độ cao hơn ở một số decanes, với sự sụt giảm của benzen, pentene, hexane, propanol, ketone cyclohexanone, limonin, fluorophosphate (chất ức chế cholinesterase) và chất chống oxy hóa butylat hydroxytoluene so nhóm chứng [53, 54]. Tuy nhiên, không phải tất cả tác giả đều đồng thuận với kết luận này, vì một số tác giả khác như Gaida và cộng sự [55] đã báo cáo nồng độ benzen, toluene, vinylacetate và 1,6-dimethyl-1,3,5-heptatriene ở bệnh nhân COPD cao hơn so với nhóm chứng, và nồng độ thấp hơn đối với indole.
Cuối cùng, cũng đáng chú ý đó là có thể phát hiện các chất chuyển hóa trong khí thở ra bằng thiết bị gọi là eNOSE. Bài báo được công bố bởi Rodríguez-Aguilar và cộng sự [56] điểm nổi bật so với các nghiên cứu khác vì họ báo cáo hàm lượng acetaldehyde, cyclopentanone, octan, methylisobutarate, 2-propanol và 3-hexanone cao hơn ở bệnh nhân COPD khi so sánh với nhóm chứng, và nồng độ của tetradecane, ō-dodecalactone, 2-methylbutanoic acid, vinylpyrazine (diazine như pyrimidine) và 2-acetylpyridine thấp hơn.
4.2 Phát hiện từ các bệnh phẩm hệ thống
4.2.1 Máu
Có một số yếu tố luôn phải xem xét khi phân tích mẫu máu. Đầu tiên là việc lấy máu có được thực hiện lúc đói hay không, vì lượng thức ăn đưa vào có thể làm thay đổi các chất chuyển hóa, dẫn đến sai lệch kết quả. Yếu tố thứ hai cần làm rõ đó là huyết thanh hay huyết tương, vì fibrinogen và các yếu tố đông máu khác sẽ không có trong huyết thanh. Vấn đề này sẽ được đề cập sau, đặc biệt liên quan đến COPD. Cuối cùng, đã có một số nghiên cứu được công bố thực hiện trên các nhóm bệnh nhân lớn nhưng tương đối ít (COPDGene, ECLIPSE, SPIROMICS,...) [57-60] hoặc với quần thể nhỏ hơn. Ở cuối bài tổng quan này, một số ưu và nhược điểm của từng phương pháp tiếp cận bổ sung này sẽ được thảo luận ngắn gọn.
Trong phần lớn các nghiên cứu được công bố, vai trò của lipid nỗi bật hơn so với các phát hiện khác. Liên quan đến điều này, sự rối loạn điều hòa một số diglyceride và phospholipid trong huyết thanh bệnh nhân COPD đã được chứng minh nhiều lần [61-69]. Cụ thể, nồng độ thấp của phosphatidylcholines và sphingomyelin đã được nhiều tác giả khác nhau đặc biệt nhấn mạnh [62, 64, 65, 67]. Cả hai đều là phospholipid nhưng trong khi phosphatidylcholines là thành phần lipid chính của lớp surfactant (khoảng 85% nếu xét dipalmitoyl phosphatidylcholine cộng với phosphatidylcholine) [70, 71], thì sphingomyelin (phosphocholine hoặc phosphoetanolamine cộng với ceramide, kết hợp giữa sphingosine và acid béo) đặc biệt có nhiều ở màng tế bào và hệ thần kinh. Cần lưu ý rằng phosphatidylcholines của lớp surfactant giảm đi đáng kể ở bệnh nhân COPD, điều này có liên quan đến sự suy giảm chức năng ở những bệnh nhân này [72]. Tuy nhiên, các phospholipid khác, tiền chất hay các chất chuyển hóa của chúng (như glycerophosphocholine, phosphocholine, lysophosphocholine và lysophosphatidylcholine), cũng như triglyceride, giảm ở nhóm bệnh nhân COPD so với nhóm chứng (hình 1) [60, 62, 65-69]. Thực tế, khi phân tích tương tác tổng thể, tất cả các lipid này đều cho thấy mối liên hệ chặt chẽ với bệnh lý hô hấp [64]. Một số tác giả cũng báo cáo nồng độ thấp của acid béo không bão hòa ở bệnh nhân COPD, mặc dù acid béo không bão hòa mạch đơn lần lượt tăng cao, cụ thể giá trị tăng cao được quan thấy với nhiều eicosanoid khác nhau (ví dụ các chất có nguồn gốc từ CYP oxidase, acid 12-HETE (12-hydroxyeicosatetranoic) and 12-HHTRE (12-hydroxyheptadecatrienoic) của tiểu cầu) kèm với nồng độ thấp của 5-lipooxygenase (5-LOX, tham gia quá trình biến đổi acid béo thành leukotrienes) [39, 61, 62, 68]. Một phát hiện thú vị khác là các thể ketone quan sát thấy ở bệnh nhân COPD cao hơn [69, 73], biểu hiện lượng acetyl-CoA cao hơn do quá trình oxy hóa cả pyruvate và acid béo. Hơn nữa, nghiên cứu khác cũng báo cáo sự gia tăng các sản phẩm thoái hóa acetyl-CoA (cụ thể là acetoacetate và 3-hydroxybutyrate) ở bệnh nhân COPD so với nhóm chứng [74]. Sự gia tăng cũng đã được báo cáo ở lipoprotein, đặc biệt là lipoprotein tỷ trọng cao (HDL) [74], mặc dù mâu thuẩn là một số nghiên cứu khác báo cáo sự giảm lipoprotein có ý nghĩa [69, 75]. Cũng liên quan đến chuyển hóa lipid, những thay đổi bổ sung đã được tìm thấy thông qua mức độ acylcarnitine, chịu trách nhiệm vận chuyển lipid đến ty thể để bị phân hủy [64, 66, 68].
Nhiều tác giả cũng đã nhấn mạnh vai trò quan trọng của các thay đổi trong chuyển hóa protein ở bệnh nhân COPD, chủ yếu biểu hiện thông qua sự biến đổi thành phần acid amin và peptid, đặc biệt là các acid amin phân nhánh, bệnh nhân COPD thể hiện mức độ cao với histidine và 3- methylhistidine (và thứ yếu là histamine), arginine, glutamine và phenylalanine [66, 68, 69, 75-80]. Các acid amin khác hoặc dẫn xuất của chúng, như creatine (từ glycine và arginine) và dẫn xuất creatinine, threonine, leucine, valine, glycine và dimethylglycine, glutamine-glutamate, cho thấy giá trị thấp hơn ở bệnh nhân so với giá trị quan sát ở người khỏe mạnh [66, 68, 69, 75, 76, 79- 81]. Ngoài ra một số báo cáo quan sát thấy những thay đổi với các acid amin khác như cysteine, lysine, methionine, proline, Taurine và dimethylarginine [40, 65, 82]. Tất cả những phát hiện nêu trên đều liên quan đến tình trạng viêm hệ thống [75, 76, 82], và đặc biệt trong trường hợp acid amin phân nhánh càng rõ ràng hơn với COPD nặng. Ngoài ra, sự gia tăng glycoprotein GlycA (có nguồn gốc từ protein pha cấp tỉnh, đó là dấu ấn của tình trạng viêm mức độ thấp) và mFBP fibrinogen peptide đã được báo cáo ở bệnh nhân COPD [21, 74]. Các tác giả khác như Huang và cộng sự [79] và Carenter và cộng sự [80], đã tìm thấy mối liên hệ chặt chẽ của COPD, không chỉ với quá trình chuyển hóa acid amin và lipid mà còn với acid nucleic. Nhìn chung, sự thay đổi trong con đường chuyển hóa protein đã được đề cập rất nhiều, đồng thời với các bằng chứng về hiện tượng oxy hóa, chỉ ra sự gia tăng quá trình dị hóa [40, 65].
Mặt khác, trong nghiên cứu rất lớn được công bố bởi Yu và cộng sự [83] nhiều chất chuyển hóa từ lipid và acid amin được phát hiện có liên quan đến COPD. Các tác giả báo cáo bệnh nhân có nồng độ cao các chất chuyển hóa liên quan đến tyrosine (3-methoxytyrosine), Citrulline (homocitrulline) và ornithine, Carnitine (succinylcarnitine và oleoylcarnitine), 5-dodecenoate (acid lauric), 3-4-hydroxyphenyl-lactate, 7-a-hydroxy-3-oxo-4-cholesthenoate (có nguồn gốc từ cholesterol), glycerol, đồng phân của nucleoside uridine (pseudouridine), và một số xanthines và chất chuyển hóa của chúng (như I- methylurate) so với nhóm chứng, và nồng độ thấp hơn đối với glycerate, serotonin, w-3 DHA và androsterone sulfate. Trong nghiên cứu lớn khác đã xây dựng mô hình gồm hơn 20 chất chuyển hóa có khả năng dự đoán bệnh [21]. Mô hình này bao gồm các loại đường (như myo-inositol), các dẫn xuất lipid (glycerophospho-inositol), các peptid khác nhau (mFBP), các dẫn xuất của quá trình oxy hóa protein (acid cysteine sulfonic) và các yếu tố của chu trình Krebs (như fumarate). Liên quan đến chu trình Krebs, các tác giả đã báo cáo nồng độ maleate, pyruvate và lactate trong huyết thanh tăng cao ở bệnh nhân COPD [84]. Tất cả các kết quả này gợi ý những vấn đề trong quá trình chuyển hóa oxy hóa, đặc biệt là quá trình glycolysis kỵ khí và tác động tiêu cực đến việc sản xuất năng lượng [84, 85]. Gần đây, dựa trên những phát hiện từ các nghiên cứu lớn, GODBOLE và cộng sự [86] đã cố gắng tạo ra mô hình dự đoán về mức độ nặng của COPD. Với >100 chất chuyển hóa, không chỉ bao gồm acid amin và lipid mà còn cả nucleoside và acid vanillylmandelic (chuyển hóa catecholamine), các tác giả có thể dự đoán sự thay đổi của FEV1. Tuy nhiên, những kết quả đáng khích lệ này vẫn chưa được xác nhận thêm.
4.2.2 Nước tiểu
Mức độ thay đổi các chất chuyển hóa khác nhau cũng được mô tả trong nước tiểu. Sự gia tăng của pyruvate, acetat và thể ceton, cũng như a-ketoglutarate và phenylacetyl glycine (tất cả đều biểu hiện chuyển hóa kỵ khí) đã được báo cáo [74]. Sự gia tăng nồng độ Carnosine (dipeptide có đặc tính chống oxy hóa) và acid amin ẞ-alanine và histidine cũng đượcc quan sát thấy ở bệnh nhân COPD, trong khi các dẫn xuất khác của chuyển hóa protein, như creatinine hay nicotinamide cho thấy giảm. Trong nghiên cứu khác được thực hiện với nước tiểu, tác giả quan sát thấy hippurate, formate (tham gia vào quá trình chuyển hóa các acid amin) và trigonelline (alkaloid), tất cả đều liên quan đến chế độ ăn, nhưng cũng có thể được sản xuất bởi hệ vi sinh vật. liên quan đến mức độ suy giảm chức năng ở bệnh nhân COPD [87].
4.2.3 Tóm tắt
Nếu chúng ta coi COPD là một bệnh lý đồng nhất, điều đó tạo điều kiện cho những thay đổi chuyển hóa, có thể được phát hiện từ các bệnh phẩm từ phổi hoặc dịch tiết đường hô hấp, nhưng cũng có thể thông qua các tác động hệ thống của chúng. Các bệnh phẩm có nguồn gốc từ đường hô hấp về cơ bản cho thấy những thay đổi trong quá trình chuyển hóa phospholipid, acid béo và ceramide, đặc biệt là trong các giai đoạn sớm của bệnh, cho thấy sự phá hủy nhu mô phổi trong các giai đoạn này, cùng với các hiện tượng khác. Chúng tôi bổ sung thêm vào những phát hiện này bằng một số thay đổi ở các eicosanoids và các dấu hiệu của sự gia tăng quá trình dị hóa protein, thay đổi ở mức độ của các peptide và acid amin, stress oxy hóa và khó khăn trong sản xuất năng lượng. Tất cả những hiện tượng này được phản ánh ở cấp độ hệ thống (máu) nhưng cũng đồng thời đi kèm với những thay đổi bổ sung trong chuyển hóa một số lipid và yếu tố đông máu, có ý nghĩa quan trọng về mặt tim mạch đối với bệnh nhân COPD.
5 MỘT SỐ YẾU TỐ ĐIỀU HÒA CHUYỂN HÓA TRONG COPD
Một số yếu tố có khả năng liên quan đến biểu hiện lâm sàng COPD, và do đó tạo ra sự khác biệt trong sinh lý bệnh và đặc điểm chuyển hóa. Tuổi, giới, đợt cấp, mức độ nặng của suy giảm chức năng, hệ vi sinh vật và các bệnh đồng mắc, cùng nhiều yếu tố khác có tầm quan trọng đáng kể (bảng 1).
5.1 Ảnh hưởng của tuổi và giới
Ảnh hưởng của lão hóa lên biểu hiện chuyển hóa COPD là chủ đề rất được quan tâm, vì so sánh giai đoạn sớm nhất của bệnh với giai đoạn tiến triển; hai khái niệm không phải lúc nào cũng trùng lặp. Trên thực tế, các yếu tố như sự phát triển của phổi, hoạt động thể chất, chế độ ăn uống hay béo phì ảnh hưởng đến khởi phát sớm hay muộn của bệnh [88, 89].
Người ta thấy rõ những thay đổi liên quan đến cấu trúc và chức năng phổi do lão hóa tương đồng với những thay đổi được quan sát trong COPD. Nhiều tác giả chỉ ra COPD có thể liên quan đến quá trình lão hóa nhanh chóng của phổi [90]. Ở cấp độ chuyển hóa, lão hóa gây các rối loạn trong quá trình cân bằng động của protein và trong chất nền ngoại bào, với sự gia tăng tình trạng viêm mức độ thấp và stress trong hoạt động của ty thể [91]. Như đã đề cập, nhiều thay đổi này xuất hiện ở COPD, nhưng ít nghiên cứu phân tích cụ thể tương tác giữa COPD và quá trình lão hóa bằng cách sử dụng phương pháp metabolomics, và nghiên cứu của Xue và cộng sự [84] xứng đáng được nhắc đến. Các tác giả đã báo cáo sự thay đổi lớn các thành phần của chu trình acid citric ở bệnh nhân lớn tuổi so với những người trẻ hơn. Tác giả Mangoti và cộng sự [92] cũng cho thấy bệnh nhân COPD có những thay đổi từ quá trình methyl hóa trong chuyển hóa một số acid amin như Arginine ở người cao tuổi. Một dấu ấn sinh học tiềm năng khác cho cả quá trình lão hóa sinh lý và lão hóa nhanh là hydrogen sulfide, phân tử khí có đặc tính kháng viêm và chống oxy hóa, cũng liên quan đến sự phát triển của phổi [93]. Một số tác giả báo cáo bệnh nhân có kiểu hình tăng bạch cầu ái toan hay đợt cấp thường xuyên, hay bệnh ở giai đoạn nặng, cho thấy mức độ chất này trong khí thở ra thấp hơn so với những bệnh nhân không có các đặc điểm này [94]. Mặt khác, nồng độ chất này trong huyết thanh cũng thấp hơn ở bệnh nhân đang trong đợt cấp so với giai đoạn ổn định [95]. Dyhydroandrosterone (DHEA) cũng cho thấy nồng độ huyết thanh giảm rõ rệt theo tuổi tác, sự thay đổi rõ rệt hơn ở bệnh nhân COPD [96]. Phát hiện này (cũng như các thay đổi ở các hormone androgen khác) có thể liên quan đến việc mất khối lượng cơ ở nhiều bệnh nhân [97]. Điều tương tự cũng xảy ra với ẞ-hydroxy-ẞ-methylbutyrate (HMB), một loại acid α-keto có nguồn gốc từ leucine, nồng độ thấp ở bệnh nhân cao tuổi bị mất khối lượng cơ và đặc biệt hơn ở những người mắc các bệnh mạn tính như COPD [98].
Đối với giai đoạn sớm và không phụ thuộc độ tuổi của bệnh nhân, hiện có nghiên cứu đang được tiến hành (BIOEARLY-COPD), một trong những mục tiêu của nghiên cứu này là xác định đặc điểm chuyển hóa của những bệnh nhân này, nhưng kết quả chính vẫn chưa được công bố [99].
Nồng độ Carnitine huyết thanh ở bệnh nhân COPD nữ thấp hơn so với phụ nữ khỏe mạnh và cũng thấp hơn so với bệnh nhân nam COPD [64, 85]. Ngoài ra, trong khi con đường của Nitric oxid và chuyển hóa một số acid amin (như arginine) thay đổi nhiều hơn ở bệnh nhân COPD nữ so với bệnh nhân nam (liên quan đến sự hiện diện nhiều hơn của stress nitro hóa) [85], cho thấy sự tham gia nhiều hơn vào quá trình chuyển hóa lipid của chúng (sphingolipids, ceramide và acit béo) [64]. Mặt khác, các chất chuyển hóa lipid được tìm thấy trong BAL, chẳng hạn như acit octadecenoic, heptadecatrienoic, octadecadienoic, eicosatetraenoic hay Thromboxane TXB2, dường như có khả năng phân biệt giữa phụ nữ hút thuốc lá có và không có COPD [39]; tuy nhiên, hồ sơ chuyển hóa tiềm năng này lại không có ý nghĩa ở nam giới. Xem xét tất cả những điều này và những phát hiện bổ sung khác, một số module tương tác đặc trưng cho giới đã được mô tả. Về vấn đề này, những hợp chất được hình thành bởi Amino acid - lysophospholipid- aicd mật - acetycholin và amino acid chu trình Krebs-xenobiotics đặc trưng COPD ở nam, trong khi một module hình thành bởi steroid sẽ đặc trưng hơn ở phụ nữ mắc bệnh [64]. Lý giải phổ biến nhất cho những khác biệt về mặt lâm sàng và sinh học được quan sát thấy giữa COPD ở nam và nữ có thể liên quan đến yếu tố tiếp xúcvà/hoặc những khác biệt liên quan đến hormone [100, 101].
Bảng 1. Những thay đổi chuyển hóa chính liên quan đến một số đặc điểm bệnh nhân và một số kiểu hình COPD nổi bật
Sự lão hóa Hơi thở ngưng tụ: hydrogen sulfide; axít béo, các chất chuyển hóa có nguồn gốc và liên quan (EpOMES (epoxit của axit linoleic), DiHOMEs (dihydroxyl hóa axit octadecadienoic)↓) Máu: acid amin methyl hóa ↑; hormone (dihydro androsterone↓) |
Giới tính Dịch rửa phế quản: Nữ: các dẫn xuất và chất chuyển hóa acid béo (octadecenoic (oleic)↑, heptadecatrienoic (norlinolenic)↑,octadecadienoic (linoleic)↑ và eicosatetraenoic (arachidonic)(axit); Prostaglandin và Thromboxan (TXB21) Máu: Nữ: các dẫn xuất và chất chuyển hóa acid amin (arginine, homocitrulline↓, α ketoglutaramate, carnitine, acylcarnitine↑, dityrosine↑); các chất chuyển hóa có nguồn gốc và liên quan acid béo (hydroxydocosahexaenoic (HdoHE)↑, hydroxy-eicosatetraenoic (HETE)↑); photpholipit (phosphatidylethanolamine↑, phosphatidylcholine↑); sphingoid base (behenoyl-sphingadienine); các acid carboxylic khác (dihydroxy-methylbutirate↓); acid erythronic↑ Nam: các dẫn xuất và chất chuyển hóa acid amin (5-hydroxylysine, y- glutamylmethionine, thần kinhcarnitine↑); các dẫn xuất và chất chuyển hóa acid béo (octadecenedioic↑); ceramidet; phospholipid (N-stearoyl-sphingosine↑) |
Đợt cấp Đờm: carbohydrate (acid sialic); các dẫn xuất và chất chuyển hóa acid béo (arachidonic,docosapentaneoic↑); hypoxanthine↑ Máu: chất chuyển hóa của quá trình phân giải carbohydrate; các dẫn xuất và chất chuyển hóa acid amin (glycine/↑, leucine, isoleuxin, lysine, tryptophan, taurin, valin, glutamyl phenylalanin, photphocreatine (nếu liên quan đến viêm phổi), carnitine, acetylcarnitin↑); ceramide (trihexosylceramid↑); phospholipid (sphingosine-1-phosphate); chất chuyển hóa của quá trình thoái hóa nucleoside; các acid cacboxylic khác (formate); thể cetone ((hydroxybutyrate↓), hydrogen sulfide↓ |
Mức độ suy giảm chức năng (FEV1) Mô phổi, COPD nặng: ceramides, (mặc dù ở bệnh nhân COPD nhẹ đến trung bình) phospholipid (sphingosine-1-phosphate↑) Dịch rửa phế quản phế nang, COPD nặng: các dẫn xuất và chất chuyển hóa c acid amin cysteine, homocystein, glyxin, threonin↑/↓); phospholipid (phosphatidyletanolamine↓, phosphatidylserine); ceramide↑; chất chuyển hóa nicotin (P-cresol↓) Đờm, COPD nặng: các dẫn xuất và chất chuyển hóa acid béo (acid 5 và 12- oxoeicosatetranoic↓); glycerophospholipid↓; enzym (SOD↑, MPO↑); prostaglandin- thromoboxanes (prostaglandin F2a (PGF2a)↑và D2 (PGD2)↑↓, Thromboxane B2 (TXB2)↑) Khí thở ra ngưng tụ: các dẫn xuất và chất chuyển hóa acdi amin (acid aspartic↑, hydroxy-L- homoarginine, acid oxoglutaric 1); các dẫn xuất và chất chuyển hóa acid béo (acetohydroxybutanoic↑, octadecadienoic octadecadienoic ↑, hydroxyeicosapentanoic ↑, 5- hydroxyeicosatetranoic ↑, 12-hydroxyeicosatetranoic, trihydroxyoctadecenoic acid ↑ (TriHOME), EPOMES ↑, DIHOME ↑, hydroxyheptadecatrienoic acid (HHTrE) ↑); acid carboxylic (hydroxyundecanoic↓, oxotetradecenoic↓, hexadecatrienoic↓, oxoheptadecanoic ↓); thể ceton (hydroxybutyrate ↑); prostaglandins-thromoboxanes (PGF2 ↓, TXB2 ↑), Máu, COPD nặng: các dẫn xuất và chất chuyển hóa của carbohydrate (glucosaminic acid ↑) các dẫn xuất và chất chuyển hóa tương ứng của acid amin (arginine ↑↓, asparagine ↑↓, glutamylcysteine ↑, glutamine ↑↓, glycine, glutamylglycine ↑, dimethylglycine, acetylglycine ↓, glutamylglutamate ↑, histidine, methylhistidine ↑, isoleucine ↑/1, leucine ↓, carboxymethylysine ↑, phenylalanine ↑. proline, serine, threonine, tryptophan ↓. glycosyltryptophan ↑, tyrosine ↑, 3-methoxytyrosine ↑, valine 1/1, creatine, octanoyl-1- carinitine ↑, decanoylcarnitine ↑, dedecenoylcarnitine ↑, laurylcarnitine ↑, myristoleoylcarnitine ↑ |
Tỷ lệ tử vong ngắn hạn Máu: carbohydrates (fructose ↑, ribose ↑, fucose ↑); acid amin phân nhánh (leucine↓, isoleucine, valine ↓); peptides (từ quá trình thoái hóa của bradykinin ↑, yếu tố XII ↑ and fibrinogen ↑); các acid carboxylic và muối của chúng và chu trình Krebs (caproate ↓, succinate ↑, fumarate ↑, a-ketoglutarate ↑, malate ↑, Glycerol and glycerate 1/1, lactate ↑); glycerophospholipids ↓; hormones (dehydroandrosterone ↓) |
BMI thấp - suy dinh dưỡng Máu: carbohydrates (glucose ↓); các dẫn xuất và chất chuyển hóa tương ứng của acid amin (arginine ↑, asparagine ↑, aspartate ↑, citrulline ↑, glutamine ↑/↓, glycine ↑, histidine ↑, methylhistidine, isoleucine, hydroxylysine, Methionine ↑, phenylalanine ↑, proline ↑, thiaproline, cystathionine, serine ↑, valine ↑/1, aminoadipate, sarcosine ↓); lipoproteins (HDL ↑); triglycerides; ketonic bodies and derived metabolites (acetate f/1. hydroxybutyrate ↑, ẞ-hydroxy-ẞ-methylbutyrate ↓); các base nito và chất chuyển hóa của chúng (β-aminoisobutyric↓); các acid carboxylic - muối của chúng và chu trình Krebs (pyruvate↓); chuyển hóa vitamin (vitamin C/ascorbic acid ↑/1, vitamin B3/nicotinic acid ↑) |
Microbiota (Hệ vi sinh vật) Đờm: muối và chất chuyển hóa của acid carboxylic (acetate ↑, butyrate, propionate↓) Phân: các dẫn xuất và chất chuyển hóa acid amin (acetyltaurine ↑/1, acetylglutamate ↓, y- glutamylglutamate, acetylproline; acetylcadaverine ↑); acid carboxylic khác và chất chuyễn hóa (suberate, acid undecanedioic↓) |
Thuốc Thuốc đồng vận thụ thể ẞ dạng hít: Nước tiểu: dẫn xuất và các chất chuyển hóa của các acid amin (glycine↑); amin-polyamines (trimethylamine↑) Đờm: thể ceton (acetate ↓); muối và các chất chuyển hóa của các acid carboxylic khác (propionate↓); acetoin ↑ Thuốc đồng vận thụ thể ẞ+steroid dạng hít: Máu: các dẫn xuất và chất chuyển hóa của amino acid (glutamine ↓); thể ceton và các chất chuyển hóa (acetoacetate ↑) Nước tiểu: chuyển hóa nicotinamide (methyl-dicotinamide ↑) Khí thở ra ngưng tụ: thể ceton và các chất chuyển hóa tương ứng (acetate↓) |
Mối liên hệ giữa COPD + ung thư phổi so với ung thư phổi Mô phổi không u: carbohydrates (turanose ↑); các dẫn xuất và chất chuyển hóa của acid amin (phosphoserine ↑); các dẫn xuất và chất chuyển hóa của acid béo (anandamide ↓); ceton (hydroxyacetone ↑); acid carboxylic khác (azelaic↓; 3-methylglutaric↓) Khí thờ ra ngưng tụ: acid carboxylic (propanoic ↑) |
Kiểu hình Khí phế thũng Mô phổi: phospholipids (phosphatidylinositol ↑, Phosphatidylserine ↑) Máu: các dẫn xuất và chất chuyển hóa tương ứng của các acid amin, peptide (alanine ↑, arginine ↑, asparagine ↑, acetylcarnitine ↑/1, citrulline ↑, phenylalanine ↑, glutamine ↑, glycine ↑, dimethylglycine, histidine ↑, 1 and 3-methylhistidine ↑, isoleucine-serine ↑. leucine ↑, Lysine ↑, hydroxylysine, proline ↑↓, serine ↑, tryptophan, tyrosine, valine ↓: aminoadipate, betaine 1/1, carnitine ↑↓, hydroxylhexanocarnitine ↑, creatine 1/1, sarcosine↓, pyroglutamate, aminoadipic acid ↓); các dẫn xuất và chất chuyển hóa tương ứng của các acid béo (myristoleic, isovaleric↓); ceramides; diglycerides (palmitoyl- linoleoyl-glycerol↓); phospholipids (glycerophospholipids ↑, sphingomyelins ↑/↓); base nito và chất chuyển hóa tương ứng (adenine 1. ẞ-amino isobutyric ↓); nucleosides (ribosyl- imidazolacetate 1/1); các acid carboxylic khác và chu trình Krebs (acid citric 1); thể ceton (3-hydroxybutyrate ↑); hormone(glucagon, adiponectin, androsterone↓) Viêm phế quản mạn Đờm: carbohydrates (sialic acid ↑), Máu: các dẫn xuất và chất chuyển hóa của các acid amin, peptide (phenylalanine ↓, tyrosine 1. acetylcarnitine ↑. hydroxylhexanocarniti, pyroglutamate ↑); acid béo (myristoleic ↑); phospholipids (sphingomyelins ↑); các dẫn xuất và chất chuyển hóa của base nito (adenine↓) Đợt cấp thường xuyên Khí thở ra ngưng tụ: hydrogen sulfide↓ Đờm: carbohydrates (acid sialic ↑); các dẫn xuất và chất chuyển hóa của acid amin (carnitines ↑, Glutathione ↑); hypoxanthines and xanthines ↑; các dẫn xuất và chất chuyển hóa các base nito (adenine ↑, methylthioadenosine ↑), Máu: các dẫn xuất và chất chuyển hóa của acid amin (alanine ↑, arginine ↑, glutamine↓, leucine, isoleucine, proline ↑, serine, threonine ↑/1, tryptophan, tyrosine, valine ↓; betaine ↑, carnitines ↑, trimethyl-l-alanine-l-proline-betaine ↑/1); phospholipids (glycosphingolipids ↑); amin (oleamide ↓) Tăng bạch cầu ái toan và/hoặc ACO so với "COPD đơn thuần" Khí thở ra ngưng tụ: hydrogen sulfide↓, các chất chuyển hóa có nguồn gốc và liên quan acid amin (valine↓); acid béo↑/↓; thể ceton (axeton↑); các acid cacboxylic và muối và chu trình Krebs (acid lactic-lactate; propionat↑); alcohol (isopropyl alcol ↑, metanol↑) Máu: carbohydrate (D-mannose, glucose); các chất chuyển hóa có nguồn gốc và liên quan acid amin (asparagine, glutamine, histidin, isoleuxin, leucine, lysine phenylalanin, serine, threonin, valin↓; N-acetyl-glycoprotein↓); acid béo (linoleic, octadecadienoic ↑, stearic↑), các chất chuyển hóa có nguồn gốc và liên quan phosphholipid (etanolamine↓); cholesterol, triglycerid (palmitoyl glycerol ↓); eicosanoids (5- và 13- hydroperoxyeicosatetraenoic acid (5- và 12-HpETE)↑, 9- và 13-hydroperoxyoctadeca-9 dienoic (HPODE)1,5-, 8-, 11-12- và 15- hydroperoxyeicosatetraenoic (HETE) ↑và 12-hydroxyeicosapentaenoic (HEPE) acid ↑ : Thromboxan D2 (TXD2)↑); acid cacboxylic khác và muối chu trình Krebs của chúng (citrate, succinate, lactate↑) Nước tiểu: L-histidine↑ |
FEV1: thể tích khí thở ra gắng sức trong 1 giây đầu tiên; BMI: chỉ số khối cơ thể; ACO: Hội chứng chồng lấp hen - COPD |
5.2 Đợt cấp COPD
Tương đối ít nghiên cứu phân tích các chất chuyển hóa trong đợt cấp. Trong số đó, đáng chú ý là nghiên cứu được công bố bởi Gulcev và cộng sự [102], báo cáo sự giảm nồng độ tryptophan tại thời điểm khởi phát đợt cấp, kết quả cho thấy liên quan đến sự gia tăng enzyme dị hóa indoleamine 2,3-dioxygenase. Zhou và cộng sự [65] lần lượt quan sát thấy mức peptid và acid amin thấp hơn như glutamyl phenylalanin và taurin, trong đợt cấp COPD so với các giai đoạn ổn định. Van Der Does và cộng sự [41] ghi nhận có sự gia tăng DPA và acid arachidonic, kèm theo mức độ cao của chất trung gian cyclooxygenase-2 (tổng hợp prostaglandin) trong đờm của bệnh nhân đợt cấp.
Các công trình nghiên cứu khác cũng nhằm mục đích tìm kiếm các dấu ấn chuyển hóa về mức độ nghiêm trọng của đợt cấp. Đây là nghiên cứu được công bố bởi Cruickshank - Quinn cùng cộng sự [17] và Paris cùng cộng sự [48], nhận thấy các con đường bị ảnh hưởng nhiều nhất trong các đợt cấp nặng có liên quan đến quá trình dị hóa peptid và acid amin, lipid (chủ yếu là acid béo và sphingolipid), carbohydrate và nucleoside, với tác động tiêu cực đến quá trình chuyển hóa năng lượng. Fortis và cộng sự [103] báo cáo nồng độ thấp của formate và glycine ở những bệnh nhân đợt cấp nặng nhập viện và thở máy không xâm lấn. Hơn nữa, nếu biến cố cấp tính là do viêm phổi, không phải lúc nào cũng được nhiều tác giả và hướng dẫn xem là đợt cấp, nồng độ trong máu thấp phosphocreatine (dự trữ năng lượng) và các acid amin khác nhau [103]. Hơn nữa, liên quan đến khả năng dự báo, trong công trình nghiên cứu của Esther và cộng sự, [40] một số dấu ấn, như hypoxanthines và acid sialic, tăng lên trong đờm gần như là biểu hiện một đợt cấp mới. Tuy nhiên, dù với những phát hiện này, vẫn còn thiếu tính chính xác và đồng thuận về các dấu ấn chuyển hóa trong đợt cấp, và kể cả mức độ nặng của các đợt kịch phát.
5.3 Mức độ nặng suy giảm chức năng phổi
Một số mối liên hệ được báo cáo giữa mức độ nặng của suy giảm chức năng hô hấp và một số chất chuyển hóa (các acid amin và protein, cũng như glycerophospholipid) đã được đề cập trong các phần trước [14, 17-19, 21, 104]. Các nhóm khác cũng mô tả mối liên hệ trực tiếp hoặc nghịch đảo giữa chức năng phổi và các chất chuyển hóa bổ sung, bao gồm các carbohydrat, glyxerol, diglycerid khác nhau, nhiều phospholipid (sphingomyelin), acid amin (bao gồm creatin, histidin, prolin, threonin, serin và asparagin) và acid amin y-glutamyl (các acid amin liên kết với glutathion tạo thuận lợi trong vận chuyển tế bào, như glycin, Cystein và glutamat), aminoacyl-tRNA (ARN vận chuyển liên kết với acid amin), một số amin có nguồn gốc từ acid amin (2-metylbutyrylcarnitin và propionylcarnitin), nucleotide (N2-N2-dimetylguanosin), trigonellin (có nguồn gốc từ Vitamin B3), một số acid carboxylic (3-phenylpropionat và 3- (4-hydroxyphenyl) lactobiotic), xenobiotic ergothioneine và protein vận chuyển màng phụ thuộc ATP (ATP dependent transmembrane transporters - ABC), [19, 83]. Gần đây, nhờ sử dụng kỹ thuật machine-learning, Carpenter và cộng sự [80] đã xác nhận mối liên hệ giữa các hệ thống đến quá trình chuyển hóa các acid amin (cụ thể là arginine và proline, cysteine và methionine, glycine, serine và threonine), cũng như các mạng lưới bao gồm phối tử hoạt hóa thụ thể thần kinh (ligand-neuroactive receptor) pyrimidin và các chất vận chuyển ABC (nói trên).
Tóm lại, các con đường có liên quan đến suy giảm chức năng phổi bao gồm chuyển hóa nitơ, lipid, protein và một số acid nucleic, cũng như sự vận chuyển chất qua màng tế bào và sự hấp thu một số khoáng chất. Các tác giả cũng cho rằng bệnh phẩm trực tiếp từ hệ hô hấp mang nhiều giá trị hơn là máu [14]. Từ những kết quả này, có thể suy luận rằng một số chất chuyển hóa và/hoặc con đường nêu trên có thể cho phép giám sát sinh học bệnh nhân COPD song song với các biến số cổ điển dựa trên chức năng phổi, có thể giúp tìm ra định nghĩa tốt hơn về đặc điểm tiến triển hay tiên lượng bệnh.
5.4 Từ vong ngắn hạn
Một số bệnh nhân cho thấy một quá trình lâm sàng không thuận lợi nhanh chóng dẫn đến tử vong sớm. Hồ sơ bệnh nhân này, với tuổi thọ giảm, thể hiện một số đặc điểm đặc biệt về chuyển hóa (hình 1), với sự giảm rõ rệt hơn các acid amin chuỗi nhánh nhưng gia tăng các chất đường như Fructose, các chất chuyển hóa của bradykinin (vasodilator), yếu tố đông máu XII và fibrinogen (được mô tả là có liên quan đến sự hình thành huyết khối tự phát), glycerate, các thành phần của chu trình Krebs (như succinate, fumarate và malate), cetone (a-ketoglutaravà lactate so với những người tuổi thọ cao hơn [105, 106]. Hơn nữa, bệnh nhân có tuổi thọ ngắn hơn cho thấy sự thay đổi rõ ràng trong con đường glycerophospholipid và pentose-phosphate, chuyển hóa glycoxylate (một biến thể của chu trình Krebs) và dicarboxylate (liên quan đến chuyển hóa acid béo) [105]. Tất cả điều này cho thấy các vấn đề quan trọng trong việc tạo ra năng lượng, phản ánh rõ ràng với các hệ thống được mô tả bởi các tác giả khác [62, 64].
5.5 COPD và microbiota
Mặc dù hệ vi sinh vật đường ruột là nhân tố chính tạo thành hệ vi sinh vật ở người, hệ vi sinh đường hô hấp và sự tương tác với hệ vi sinh đường ruột ("trục phổi - ruột”) có liên quan đến sự hình thành và phát triển của nhiều bệnh phổi, bao gồm COPD [107]. Ngày càng có nhiều bằng chứng làm rõ vai trò của hệ vi sinh vật, không chỉ trong sự phát triển và trưởng thành của hệ thống miễn dịch, mà còn ở các cơ quan khác như phổi [108]. Điều thú vị là vi sinh vật của mỗi cá thể thay đổi trong suốt cuộc đời và liên quan đến nhiều yếu tố (thuốc, nhiễm trùng, lối sống) [109], do đó, các phương pháp điều trị có tiềm năng điều chỉnh các thành phần này [110-112].
Mặc dù các nghiên cứu trên đối tượng bệnh nhân COPD tương đối hiếm, một số chất dị hóa cho thấy sự khác biệt khi so sánh với nhóm chứng. Ví dụ trường hợp với acetylcadaverine, acetylglutamate, suberate và acid undecandioic [113], là hệ quả do sự khác biệt về thành phần các loại vi khuẩn đường ruột. Các bệnh nhân COPD có xu hướng hiện diện gia tăng của Streptococcus, Rothia và các thành viên của chi Escherichia [111]. Đáng chú ý, các mẫu bệnh phẩm khác nhau biểu hiện các thay đổi chuyển hóa khác nhau có nguồn gốc từ hệ vi sinh đường ruột. Một số chất chuyển hóa có nguồn gốc từ đây (ví dụ: hippurate và formate) được phát hiện trong nước tiểu của bệnh nhân COPD với tỷ lệ khác biệt so với nhóm chứng [104]. Tương tự với các dấu ấn huyết thanh, như acid cacboxylic (acetic, butyric và propionic), cũng có thể có nguồn gốc từ hệ vi sinh đường ruột [114]. Có đề xuất các chất chuyển hóa này liên quan đến các kiểu hình hoặc giai đoạn bệnh khác nhau [114], có thể do sự khác biệt trong hệ vi sinh đường ruột của từng cá thể. Ví dụ, những bệnh nhân nặng cho thấy sự khác biệt rõ ràng so với nhóm nhẹ hơn (trong số những điểm khác, nhóm bệnh nhân nặng có sự hiện diện của fusobacterial và aerococci nhiều hơn so với nhóm nhẹ), cũng như trường hợp giữa kiểu hình có và không có tăng bạch cầu ái toan [115]. Liên quan đến hệ vi sinh đường hô hấp và các chất chuyển hóa có nguồn gốc của chúng, cũng cho thấy sự khác biệt về đa dạng các kiểu hình và mức độ nghiêm trọng. Ví dụ, bệnh nhân kiểu hình tăng bạch cầu ái toan cho thấy sự đa dạng các mầm bệnh hơn so với nhóm không tăng bạch cầu ái toan, với sự phong phú hơn của Streptococcus và nhiều loại nấm [116, 117]. Tương tự, bệnh nhân suy giảm chức năng nặng cho thấy sự khác biệt so với nhóm bệnh nhân nhẹ, với số lượng Pseudomonas spp. cao hơn và ít treponemes hơn [118, 119].
Như đã biết, đợt cấp thường xuyên không chỉ làm giảm sự đa dạng của vi khuẩn, mà còn làm tăng sự hiện diện của Pseudomonas spp. [116, 120]. Rõ ràng là tải lượng vi sinh vật cũng ảnh hưởng đến sự xuất hiện đợt cấp; không chỉ là tác động trực tiếp nhờ vào khả năng lây nhiễm của vi khuẩn, mà còn do khả năng có thể gây tổn thương nhu mô phổi, với việc giải phóng kích thích các tế bào bạch cầu và các chất tiền viêm và/hoặc oxy hóa, và những thay đổi số lượng và đặc tính của đờm [121, 122]. Hơn nữa, sự suy giảm của hệ vi sinh đường hô hấp có thể làm tăng nguy cơ tử vong ở bệnh nhân COPD, đặc biệt nếu đi kèm với ưu thế Haemophilus [123]. Tuy nhiên, về khả năng dự đoán, không có bất kỳ dấu ấn chuyển hóa nào sẵn có liên quan đến hệ vi sinh có thể dự báo nguy cơ đợt cấp mới.
5.6 Thuốc và phương pháp điều trị không dùng thuốc trong COPD
Một số loại thuốc được sử dụng trong COPD có thể gây ra những thay đổi trong chuyển hóa cơ thể. Do đó, có thể phát hiện được một số dấu ấn trong các bệnh phẩm sinh học. Điều này cần được xem xét khi phân tích kết quả của các nghiên cứu chuyển hóa. Ví dụ, thuốc giãn phế quản chủ vận ẞ có thể làm thay đổi quá trình chuyển hóa acid nicotinic (nicotinamide adenine dinucleotide (NAD) và dạng khử (NADH)), một số acid béo, như linoleic và arachidonic (cũng có tác động đến các dẫn xuất eicosanoid) [124, 125]. Steroid dạng hít cũng có khả năng gây ra những thay đổi trong các chất chuyển hóa khác nhau. Ví dụ, việc kết hợp Budesonide vào chất chủ vận ẞ đã được chứng minh có thể làm thay đổi nồng độ các dấu ấn huyết thanh liên quan đến protein, formate và các thành phần của chu trình acid citric [125, 126]. Cần xem xét kết hợp các kiểu hình với các phương pháp điều trị. Tan và cộng sự [127] báo cáo kiểu hình khí phế thũng cho thấy đáp ứng chuyển hóa khác biệt khi điều trị với Tiotropium so với kiểu hình viêm phế quản mạn. Đối với các phương pháp không dùng thuốc, Maniscalco và cộng sự [128] công bố những cải thiện lâm sàng sau chương trình phục hồi chức năng phổi kèm với những thay đổi trong các chất chuyển hóa trong khí thở ra ngưng tụ. Trong số đó, sự giảm methanol là nổi bật, phản ánh mức độ thấp tình trạng viêm tại phổi.
5.7 Bệnh đồng mắc thường gặp, COPD và ung thư phổi
Mối liên hệ giữa ung thư phổi và COPD, cụ thể hơn là khí phế thũng, được xác định rõ ràng và được coi là một phần độc lập với tác động trực tiếp của hút thuốc lá. Cho đến nay, đã có nhiều nỗ lực để xác định các hồ sơ chuyển hóa cụ thể giúp chẩn đoán sớm ung thư phổi ở những bệnh nhân có nguy cơ cao như COPD. Li và cộng sự [129] báo cáo rằng bệnh nhân ung thư cho thấy sự khác biệt đáng kể trong mô phổi không phải do khối u mà tùy thuộc vào việc họ có liên quan đến COPD hay không. Những thay đổi này liên quan đến chất vận chuyển ABC, và một số bước trong con đường tổng hợp pantothenate và CoA, cũng như trên quá trình chuyển hóa acid amin (đặc biệt là alanin) và purines. Trong nghiên cứu khác, Muñoz -Lucas và cộng sự, [130] chỉ ra sự khác biệt đối với acid propanoic (nguồn gốc từ acid béo, và có thể là sản phẩm của hệ vi sinh đường ruột) trong khí thở ra ngưng tụ giữa hai nhóm dân số này. Một vấn đề bổ sung là có thể xác định sự khác biệt giữa các hồ sơ chuyển hóa của COPD đơn thuần hoặc ung thư phổi đơn thuần. Liên quan đến điều này, nghiên cứu được công bố bởi nhóm Callejón-Leblic [66] đã báo cáo sự khác biệt trong khoảng 30 chất chuyển hóa trong huyết thanh; một số acid amin và dẫn xuất (ornithine, glutamine-glutamate, threonine và creatine) và phospholipid (phosphatidylcholine) nỗi bật trong số đó.
Mời bạn đọc tìm hiểu thêm về đặc điểm lâm sàng, cận lâm sàng và kết quả điều trị đợt cấp bệnh phổi tắc nghẽn mãn tính có đái tháo đường:
5.8 Tóm tắt
Các yếu tố khác nhau, như tuổi và giới, có thể ảnh hưởng đến đáp ứng chuyển hóa ở bệnh nhân COPD. Tuổi cao có thể gây ra các khó khăn trong quá trình sản xuất năng lượng, cùng với suy giảm quá trình chuyển hóa protein, phần lớn xuất phát từ quá trình methyl hóa và biến đổi trong việc sản xuất một số hormone đồng hóa và mất khả năng chống oxy hóa. Một số hiện tượng này có thể liên quan đến sự tồn tại của sự lão hóa chuyển hóa sớm. Đặc điểm của nam và nữ COPD khác nhau ở các khía cạnh chuyển hóa, vì trong khi nam giới thường thể hiện sự biến đổi chủ yếu trong các steroid và các acid amin, thì nữ thường có bất thường ở các lipid khác nhau và chu trình acid citric. Một yếu tố khác có thể ảnh hưởng đến quá trình chuyển hóa của bệnh nhân là các đợt cấp, biểu hiện dị hóa protein và lipid tăng cao hơn so với giai đoạn ổn định, và song song với sự suy giảm các con đường sản xuất năng lượng. Mức độ nặng của bệnh, xem xét qua mức độ suy giảm chức năng hoặc tuổi thọ bệnh nhân, cũng ảnh hưởng đến chuyển hóa. Do đó, bệnh nhân nặng thể hiện tác động lớn hơn đến các con đường liên quan đến chuyển hóa protein- amino acid và phospholipid, trong trường hợp này được bổ sung vào các bất thường của glycerol, diglycerid, ABC transporter và acid nucleic. Mặt khác, sự suy giảm các acid amin phân nhánh và sự gia tăng các yếu tố đông máu khác nhau và các thành phần của chu trình Krebs và các con đường tổng hợp năng lượng khác có liên quan đến tử vong sớm của bệnh nhân. Hệ vi sinh, cả đường ruột và đường hô hấp, có thể tác động đến sự biểu hiện chuyển hóa của bệnh. Về vấn đề này, nó có thể tạo điều kiện cho các thay đổi được phát hiện trong cả chất chuyển hóa của vật chủ và, cùng tồn tại với các phân tử liên quan trực tiếp hoặc gián tiếp đến vi sinh vật. Điều thú vị là, microbiota khác biệt về chất lượng và số lượng giữa bệnh nhân nặng so với nhẹ, và giữa các kiểu hình khác nhau. Hơn nữa, ngay cả các loại thuốc thường sử dụng điều trị COPD có thể ảnh hưởng đến chuyển hóa. Ví dụ, các chất chủ vận ẞ có thể làm biến đổi một số con đường liên quan đến acid nicotinic (với kết quả trong việc sản xuất NAD VÀ NADH) và các acid béo khác, trong khi sự phối hợp các loại thuốc này với steroid hít có thể cải thiện quá trình chuyển hóa protein và sản xuất năng lượng. Cuối cùng, các bệnh đồng mắc cũng có thể can thiệp vào đặc điểm chuyển hóa của bệnh nhân COPD. Ví dụ, ung thư phổi thường kết hợp với COPD với tần suất tương đối. Bệnh nhân có cả 2 bệnh này có đặc điểm chuyển hóa chuyên biệt, với sự khác biệt về chuyển hóa của các acid amin, chất vận chuyển ABC và tổng hợp CoA so với bệnh nhân chỉ mắc riêng lẻ một trong hai bệnh.
6 KIỂU HÌNH VÀ ĐẶC ĐIỂM CÓ THỂ ĐIỀU TRỊ (TREATABLE TRAITS)
Như đã thảo luận trong các phần trước, đã có nhiều nỗ lực để đạt được sự cá thể hóa lớn hơn trong việc quản lý lâm sàng bệnh nhân COPD, phân nhóm họ dựa trên một số tiêu chí nhất định về tính đồng nhất trong biểu hiện lâm sàng. Nhưng các phân nhóm này vẫn còn quá lớn, được gọi là kiểu hình (phenotype) hay tốt hơn là “đặc điểm có thể điều trị" ("treatable traits), vì một trong những mục tiêu chính của các phân loại này là khả năng cung cấp các đặc điểm trong quản lý lâm sàng, bao gồm cả điều trị [3]. Mỗi nhóm trong số đó cũng thể hiện các đặc điểm chuyển hóa cụ thể hơn (bảng 1).
6.1 Kiểu hình cổ điển: khí phế thũng và viêm phế quản mạn
Khí phế thũng là một trong những kiểu hình đầu tiên được mô tả trong COPD. Những bệnh nhân này thường được gọi là "pink puffers", với khó thở nghiêm trọng và giảm trọng lượng cơ thể. Tuy nhiên, các nghiên cứu chuyển hóa trong khí phế thũng thường bị cản trở bởi các tiêu chí khác nhau được sử dụng trong định nghĩa của chúng. Hợp lý nhất là sử dụng hình ảnh chụp cắt lớp vi tính (CT), cho phép định lượng nhu mô phổi mất. Xem xét tất cả điều này, các nghiên cứu chuyển hóa đã chỉ ra rằng bệnh nhân khí phế thũng cổ điển biểu hiện nồng độ cao hơn của các acid amin và dẫn xuất (glutamin, Arginin, serin, asparagin/aspartat, và acetylcarnitin) và các thể ceton (3- hydroxybutyrate); và nồng độ thấp hơn của các aicd amin và dẫn xuất (như tryptophan, histidine, 3-metylhistidine, proline và valine, betaine (trimetyl-glycin hoặc TMG, chất điều hòa sự phân chia tế bào và tham gia vào cân bằng nội môi), creatine, carnitine và aminoadipate (tiền chất lysine)), peptide (như sarcosine), lipid (như ceramide, diglyceride và các phospholipid), các phân tử từ các base nito (như ẞ-aminoisobutyric (BAIBA), ribonucleoside (1-ribosyl-imidazolacetate), và hormone (glucagon, adiponectin hoặc androsteron), [18,73,75,76,131,132]. Ngược lại, các kết quả mâu thuẫn được báo cáo với một số acid amin khác (như phenylalanin). Chu kỳ Krebs và phosphoryl hóa oxy hóa trong các con đường chuyển hóa có liên quan chặt chẽ với khí phế thũng [17, 19], có lẽ do sự hiện diện đồng thời của stress oxy hóa và/hoặc nitro hóa. Trong các hệ thống thu được bởi Gillenwater và cộng sự, [64] ba module được tìm thấy có liên hệ đến bất thường tại phổi: steroid, amino acid lysophospholipid- aicd mật acetycholin và amino acid chu trình Krebs- xenobiotics. Tuy nhiên, các kết quả đầy hứa hẹn này thu được bằng cách sử dụng bệnh phẩm của bệnh nhân từ nghiên cứu COPDGene, chưa được xác nhận đầy đủ khi thực hiện với cỡ mẫu lớn hơn (SPIROMICS). Gần đây, Godbole và cộng sự [86], mô tả một mô hình dự đoán khí phế thũng và mức độ bằng cách sử dụng khoảng 130 chất chuyển hóa từ bệnh nhân thuộc hai nhóm được đề cập ở trên, nhưng thất bại trong việc đưa ra những kết luận tiếp theo. Cuối cùng, cũng đáng được nhắc đến là nghiên cứu được tiến hành bởi Halper-S Tromberg và cộng sự, [14] với bệnh phẩm BAL, họ tìm thấy lượng lớn các chất chuyển hóa liên quan đến khí phế thũng, bao gồm các chất liên quan đến các loại acid amin, acid béo và phospholipid. Carpenter và cộng sự, [80] lần lượt, sử dụng phân tích mechine-learning, tìm được mối liên hệ chặt chẽ giữa mức độ khí phế thũng và chuyển hóa acid amin (đặc biệt là các chất liên quan đến alanine, histidine, glycine, serine và threonin), các ligand hoạt hóa thụ thể thần kinh đã đề cập và hệ thống vận chuyển ABC.
Mất trọng lượng cơ thể, có hoặc không kèm rối loạn chức năng hệ cơ, khá phổ biến ở bệnh nhân khí phế thũng. Phân tích khía cạnh đặc biệt này, Ubhi và cộng sự, [73] quan sát thấy tình trạng dinh dưỡng có liên quan tiêu cực với mức glutamine, và trực tiếp với mức lipoprotein HDL và Acid Ascorbic vit. C) và nicotinic (Vit. B3, và tiền chất lần lượt là acid NAD VÀ NADH). Tập trung vào sự hiện diện của tình trạng suy dinh dưỡng được xác định, tình trạng này có liên quan đến mức độ thấp của acid amin phân nhánh (như valine và isoleucine), ascorbic acid-ascorbate, pyruvate và glucose, và sự gia tăng methionine, glutamine và glycine, 3-hydroxybutyrate, BAIBA và acetate [73]. Rối loạn chức năng hệ cơ cũng là biểu hiện thường gặp ở nhiều bệnh nhân COPD, và đặc biệt phổ biến ở bệnh nhân khí phế thũng [133]. Chỉ có một nghiên cứu được công bố bởi Rdríguez và cộng sự, [134] hơn 10 năm trước, trong đó đặc điểm chuyển hóa huyết tương được nghiên cứu ở bệnh nhân COPD có rối loạn chức năng cơ xương. Các tác giả này báo cáo sự giảm đáng kể một số acid amin như isoleucie, valine và alanine ở nhóm bệnh nhân này. Mặc dù thực tế là rối loạn chức năng hệ cơ có liên quan nghịch với tuổi thọ bệnh nhân COPD nhưng cho đến hiện tại chưa có công trình nghiên cứu nào được công bố về chủ đề này.
Liên quan đến kiểu hình cổ điển khác, viêm phế quản mạn, còn được gọi là kiểu hình "blue bloater", đặc trưng bởi ho và khạc đờm nhiều, một số nghiên cứu đã điều tra hồ sơ chuyển hóa của kiểu hình này. Công trình công bố bởi Esther và cộng sự, họ phát hiện sự tăng cao của acid α-keto sialic trong đờm của những bệnh nhân này [40], mặc dù sự thay đổi này không có biểu hiện song song trong máu [19, 66, 131]. Sự khác biệt có thể liên quan đến việc tình trạng viêm phế quản mạn tính chủ yếu liên quan đến đường thở, với sự vắng mặt của các biểu hiện toàn thân. Trái lại, sự tăng nhẹ sphingomyelins được ghi nhận trong máu của bệnh nhân có kiểu hình viêm phế quản mạn đơn thuần, mặc dù phát hiện này vẫn còn gây tranh cãi [131].
Về sự khác biệt giữa hai kiểu hình cổ điển (khí phế thũng so với viêm phế quản mạn), C ALLEJÓN-L EBLKIC và cộng sự, [66] báo cáo kiểu hình khí phế thũng cho thấy nồng độ glucose, adenine, và các acid amin và dẫn xuất (như phenylalanine hoặc hydroxylhexanocarnitine) trong huyết thanh cao hơn so với viêm phế quản mạn, nhưng nồng độ pyroglutamate, tyrosine, acetylcarnitine và acid béo myristoleic thấp hơn. Bài báo của Tan và cộng sự [127] ghi nhận sự khác biệt giữa kiểu hình viêm phế quản mạn - khí phế thũng phối hợp (được xác định bao gồm cả mất nhu mô phổi và thay đổi cấu trúc thành phế quản được quan sát trên phim CT) với kiểu hình khí phế thũng đơn thuần, cho thấy glutamine và alanine thấp hơn.
Đợt cấp thường xuyên
Những bệnh nhân với đợt cấp thường xuyên hoặc nghiêm trọng cũng biểu hiện hồ sơ chuyển hóa riêng biệt. Trong các mẫu đờm từ nghiên cứu đoàn hệ SPIROMICS, đợt cấp thường xuyên không những biểu hiện nồng độ cao của acid sialic đã đề cập, mà còn của xanthine, adenine và dạng methyl hóa của metylthioadenosine (chuyển hóa hiếu khí), và glutathion. Một hồ sơ đặc trưng cho phép dự đoán các đợt cấp trong tương lai [40]. Một nghiên cứu khác, nghiên cứu đoàn hệ trong cùng nhóm bệnh nhân, bệnh nhân với tiền sử đợt cấp cho thấy mức độ thấp của nhiều chất chuyển hóa trong huyết thanh, nổi bật là tryptophan và acid amin phân nhánh [135]. Các kết quả tương tự được công bố bởi Cruickshank và cộng sự [17], sử dụng huyết thanh của bệnh nhân trong nghiên cứu đoàn hệ COPDGene, quan sát thấy đợt cấp thường xuyên liên quan đến sự thay đổi ở một số loại đường, các acid amin (serine, threonine, và arginine) và các dẫn xuất (carnitine và aminoacyl-tARN). Các con đường liên quan nhiều nhất là quá trình chuyển hóa protein và nucleosid, các chất vận chuyển ABC. Gllenwater và cộng sự [19], với bệnh phẩm máu từ nghiên cứu đoàn hệ COPDGene, phát hiện ra một dẫn xuất acid amin khác được gọi là trimetyl-L-alanin-L-proline Betain (TMAP) liên quan chặt chẽ với số đợt cấp. Cuối cùng, Bowler và cộng sự [131] phát hiện chuyển hóa sphingolipid bị thay đổi trong huyết tương bệnh nhân COPD từ nghiên cứu đoàn hệ đa trung tâm, nhưng glycerosphingolipid đặc biệt chiếm ưu thế đợt cấp thường xuyên.
6.2 Kiểu hình tăng bạch cầu ái toan và hội chứng chồng lấp hen-COPD
Kiều hình thường gặp (chiếm một phần ba đến một phần tư bệnh nhân COPD) và được định nghĩa rõ ràng là kiểu hình “tăng bạch cầu ái toan", đặc trưng bởi sự gia tăng số lượng các tế bào này trong máu ngoại vi (>300 /µL) là tiêu chuẩn được chấp nhận rộng rãi nhất) [136, 137]. Mặc dù không phải là các khái niệm tương đương, nhưng các nghiên cứu chuyển hóa được công bố thường chồng chéo kiểu hình tăng bạch cầu ái toan với hội chứng lồng lấp hen-COPD (ACO, bao gồm đến 10 tiêu chuẩn bổ sung), do đó cả hai khái niệm được thảo luận cùng nhau ở đoạn sau.
Nhiều nghiên cứu về các biến đồi chuyển hóa ở bệnh nhân ACO tìm thấy mối quan hệ đáng chú ý giữa chức năng phổi và nồng độ huyết thanh của acid amin valine, serine và threonine, carbohydrate Glucose và manose, cholesterol, glutamate, citrate và Acid succinic [138]. Các mối liên hệ tương tự đã cũng được báo cáo với histidin trong nước tiểu [139], hoặc nồng độ của một số acid amin khác (như valie), acid béo, alcohol (isopropanol và metanol), lactat và format, thể ceton và propionate trong khí thở ra [140]. Ngoài các chất chuyển hóa này, các phân tử khác bao gồm acid amin và carbohydrate, ethanolamin và lipid và các dẫn xuất (cholesterol, triglyceride và acid béo như linoleic và stearic) cũng có thể phân biệt bệnh nhân ACO với các kiểu hình COPD khác [141]. Hơn nữa, bệnh nhân ACO liên quan đến các rối loạn rõ rệt về chuyển hóa của nhiều eicosanoid [142] và cytokine [141], các đặc điểm được đề xất có liên quan đến tình trạng gia tăng chuyển hóa [143, 144] và tiến triển xấu đi [48, 145].
COPD so với hen
Một đối tượng bổ sung và thú vị khác cần được khám phá là sự khác biệt về chuyển hóa giữa COPD đơn thuần hoặc hen phế quản. Trong hai bài báo của De Laurentis và cộng sự [146] và Maniscalco và cộng sự [147] ghi nhận bệnh nhân COPD có nồng độ alcohol (ethanol và methanol) trong khí thở ra cao hơn so với bệnh nhân hen, trong khi lượng aceton/acetoin và formate thấp hơn. Đến lượt Liang và cộng sự [148], thấy rằng bệnh nhân COPD thể hiện nồng độ huyết tương của một số acid amin (như valine, norleucine, leucine và phenylalanin), aicd béo và các phân tử liên quan (acid arachidonic và pyroglutamic, indoxyl sulfat), succinate (chu trình Krebs) và một số xanthin cao hơn ở bệnh nhân hen, và lượng xanthin khác thấp hơn, nucleoside inosine, acid palmitic và bilirubin (chuyển hóa của nhóm haem). Adamko và cộng sự [149] báo cáo bệnh nhân COPD cho thấy nồng độ arginine và dimethylamine, 3-hydroxyisovalerate (chuyển hóa CoA), betaine, choline (thành phần của màng tế bào và tiền chất của acetylcholine) và methylnicotinamide trong nước tiểu cao hơn, và nồng độ thấp hơn đối với glutamine (chuyển hóa glutathione và protein), succinate, pantothenate (tổng hợp CoA) và uracil so với bệnh nhân hen.
Tóm tắt
Các kiểu hình khác nhau và/hoặc các đặc điểm có thể điều trị được mô tả trong COPD cũng thể hiện một số đặc điểm chuyển hóa cụ thể mà ở một mức độ nào đó khác biệt với những gì đã được đề cập về bệnh nói chung. Khí phế thũng là một trong những kiểu hình cổ điển nhất và được đặc trưng bởi mức độ thay đổi của các phân tử khác nhau liên quan đến quá trình chuyển hóa protein, lipid và acid nucleic, các thành phần của chu trình Krebs, và hormone tổng hợp. Các phát hiện hệ thống ít rõ ràng hơn ở bệnh nhân với kiểu hình viêm phế quản mạn, biểu hiện những thay đổi trong một số carbohydrate trong dịch tiết hô hấp. Kiều hình đợt cấp thường xuyên ghi nhận những thay đổi về nồng độ của đường, acid amin và glycerophospholipid trong máu, với hậu quả, đối với quá trình chuyển hóa protein và acid nucleic, các chất vận chuyển màng. Cuối cùng, bệnh nhân có liên quan đến tăng bạch cầu ái toan máu và/hoặc ACO đặc trưng không chỉ bởi những thay đổi trong chuyển hóa lipid và protein nói chung, mà còn bởi rối loạn điều hòa các con đường liên quan đến eicosanoid và cytokine.
7 HẠN CHẾ CỦA CÁC NGHIÊN CỨU TRƯỚC ĐÂY VÀ CÁC CÂU HỎI HIỆN TẠI
Hầu hết các nghiên cứu được công bố đến nay đề cập đến sự biểu hiện chuyển hóa chung của COPD, hoặc các kiểu hình đã được xác định rõ ràng hơn, nhưng hầu hết đều sử dụng phương pháp tiếp cận dựa trên giả thuyết. Hơn nữa, nhiều nghiên cứu chuyển hóa tiến hành với mẫu từ một số hạn chế của đoàn hệ, bao gồm quần thể rộng và các tiêu chuẩn lựa chọn và loại trừ rất đặc thù cho cả nhóm bệnh nhân và nhóm chứng. Phần lớn các mô hình mô tả bệnh hoặc các hoàn cảnh khác nhau của nó cho thấy nghiên cứu không dễ dàng tạo lập lại, gây khó khăn để xác định tính tin cậy. Chúng tôi đồng ý với hầu hết các tác giả trong các đánh giá gần đây vẫn còn những thiếu sót quan trọng liên quan đến tầm quan trọng của các yếu tố như tuổi, giới tính, giai đoạn bệnh, mức độ nặng, đợt cấp và tiến triển hướng tới cá nhân hóa các hồ sơ chuyển hóa từ đó cho khả năng nhạy cảm với các phương pháp điều trị khác nhau trong tương lai [48, 150-152]. Hơn nữa, việc sử dụng bổ sung các phương pháp mù như các phương pháp được cung cấp bởi sàng lọc chất chuyển hóa rộng rãi cùng với các phân tích cụm tiếp theo sẽ giúp tìm ra các endotype chưa được biết và các cơ chế bệnh sinh mới liên quan đến COPD.
8 KẾT LUẬN
Như một kết luận, rõ ràng, từ những phát hiện có liên quan nhất được công bố trong các tài liệu có sẵn, COPD chủ yếu tác động đến quá trình chuyển hóa protein (được chứng minh thông qua các phát hiện được quan sát thấy trong acid amin và peptide) và lipid (với sự tham gia đặc biệt của acid béo và phospholipid), vai trò nhỏ đối với những thay đổi trong chuyển hóa carbohydrate.
Những thay đổi này dẫn đến suy giảm khả năng điều hòa cân bằng protein và bắt thường trong các con đường liên quan đến tạo thành và sử dụng năng lượng, đông máu và phản ứng miễn dịch-viêm. Một số phát hiện này, trực tiếp hoặc gián tiếp, liên quan triệu chứng thường gặp ở bệnh nhân COPD, như mất khối lượng cơ thể không chứa mỡ, mệt mỏi, biến chứng huyết khối và tim mạch, nguy cơ đợt cấp và các đặc điểm tiến triển lâm sàng. Một số kiểu hình khác nhau được mô tả (khí phế thũng/viêm phế quản mạn, tăng bạch cầu ái toan-ACO, đợt cấp thường xuyên) cũng có hồ sơ chuyển hóa tương đối đặc hiệu. Ví dụ, khí phế thũng có liên quan đến những thay đổi trong chuyển hóa protein và phospholipid, với tác động tiềm tàng đến tình trạng dinh dưỡng, chức năng hệ và cân bằng nội môi của chất surfactant phổi. Trong khi kiểu hình viêm phế quản mạn biểu hiện những thay đổi khu trú hơn trong đường thở. Bệnh nhân ACO lần lượt đặc trưng bởi những thay đổi về eicosanoid và cytokine đặc hiệu, trong khi đợt cấp thường xuyên cho thấy sự kích thích quá mức của cả con đường viêm và stress oxy hóa, tăng dị hóa và những thay đổi ngoại di truyền có thể xảy ra ở các mức độ khác nhau. Ngoài ra, một số yếu tố khác như nguy cơ tiếp xúc, tuổi, giới, bệnh đồng mắc và thậm chí cả hệ vi sinh vật cũng có thể ảnh hưởng đến quá trình chuyển hóa của bệnh nhân.
Bạn đọc có thể tìm hiểu thêm thông tin về nghiên cứu Điều trị kết hợp ba thuốc ICS/LAMA/LABA trong COPD TẠI ĐÂY
9 Tài liệu tham khảo
1. Miravitlles M, Calle M, Molina J, et al. Spanish COPD guidelines (GesEPOC) 2021: Updated pharmacological treatment of stable COPD. Arch Bronconeumol 2022; 58: 69-81.
2. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for the Diagnosis, Management and Prevention of COPD. 2022. Available from: http://goldcopd.org/.
3. Agusti A, Bel E, Thomas M, et al. Treatable traits: toward precision medicine of chronic airway diseases. Eur Respir J 2016; 47: 410-419.
4. Celli BR, Singh D. Vogelmeier C, et al. New perspectives on chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis 2022; 17:2127-2136.
5. Gea J. COPD therapy: beyond conventional pharmacology. Arch Bronconeumol (Engl Ed) 2020; 56: 343-344.
6. Morita H, Matsumoto K, Saito H. Biologics for allergic and immunologic diseases. J Allergy Clin Immunol 2022; 150: 766-777.
7. Ma H, Wu X, Li Y, et al. Research progress in the molecular mechanisms, therapeutic targets, and drug development of idiopathic pulmonary fibrosis. Front Pharmacol 2022; 13: 963054.
8. Gea J, Pascual S, Castro-Acosta A, et al. The BIOMEPOC Project: personalized biomarkers and clinical profiles in chronic obstructive pulmonary disease. Arch Bronconeumol (Engl Ed) 2019; 55:93-99.
9. Gika HG, Theodoridis GA, Wingate JE, et al. Within-day reproducibility of an LCMS-based method for metabolomic analysis: application to human urine. J Proteome Res 2007; 6: 3291-3303.
10. Soga T, Ohashi Y, Ueno Y. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry. J Proteome Res 2003; 2: 488-494.
11. Schauer N, Steinhauser D, Strelkov S, et al. GC-MS libraries for the rapid identification of metabolites in complex biological samples. FEBS Lett 2005; 579: 1332-1337.
12. Beckonert O, Keun HC, Ebbels TM, et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat Protoc 2007; 2: 2692-2703.
13. Patti GJ, Tautenhahn R, Siuzdak G. Meta-analysis of untargeted metabolomic data from multiple profiling experiments. Nat Protoc 2012; 7: 508-516.
14. Halper-Stromberg E, Gillenwater L, Cruickshank-Quinn C, et al. Bronchoalveolar lavage fluid from COPD patients reveals more compounds associated with disease than matched plasma. Metabolites 2019; 9: 157.
15. Gruzieva O, Jeong A, He S, et al. Air pollution, metabolites and respiratory health across the life-course. Eur Respir Rev 2022; 31: 220038.
16. Lange P, Celli B, Agustí A, et al. Lung-function trajectories leading to chronic obstructive pulmonary disease. N Engl J Med 2015; 373: 111-122.
17. Cruickshank-Quinn CL, Jacobson S, Hughes G, et al. Metabolomics and transcriptomics pathway approach reveals outcome-specific perturbations in COPD. Sci Rep 2018; 8: 17132.
18. Mastej E, Gillenwater L, Zhuang Y, et al. Identifying protein-metabolite networks associated with COPD phenotypes. Metabolites 2020; 10: 124.
19. Gillenwater LA, Pratte KA, Hobb BD, et al. Plasma metabolomic signatures of chronic obstructive pulmonary disease and the impact of genetic variants on phenotype-driven modules. Netw Syst Med 2020; 3: 159-181.
20. Liu J, Liang Q, Frost-Pineda K, et al. Relationship between biomarkers of cigarette smoke exposure and biomarkers of inflammation, oxidative stress, and platelet activation in adult cigarette smokers. Cancer Epidemiol Biomarkers Prev 2011; 20: 1760-1769.
21. Chen Q, Deeb RS, Ma Y, et al. Serum metabolite biomarkers discriminate healthy smokers from COPD smokers. PLoS ONE 2015; 10: e0143937.
22. Frigerio G, Mercadante R, Campo L, et al. Urinary biomonitoring of subjects with different smoking habits. Part II: an untargeted metabolomic approach and the comparison with the targeted measurement of mercapturic acids. Toxicol Lett 2020; 329: 56-66.
23. Tan Y, Barr DB, Ryan PB, et al. High-resolution metabolomics of exposure to tobacco smoke during pregnancy and adverse birth outcomes in the Atlanta African American maternal-child cohort. Environ Pollut 2022; 292: 118361
24. Ohmomo H, Harada S, Komaki S, et al. DNA methylation abnormalities and altered whole transcriptome profiles after switching from combustible tobacco smoking to heated tobacco products. Cancer Epidemiol Biomarkers Prev 2022; 31: 269-279.
25. Zhao M, Fan K, Wang J, et al. Lipidomic analysis reveals the effect of passive smoking on facial skin surface lipid in females. Chem Phys Lipids 2022; 247: 105228.
26. Zhu H, Abdullah AS, He J, et al. Untargeted urinary metabolomics and children's exposure to secondhand smoke: the influence of individual differences. Int J Environ Res Public Health 2021; 18: 710.
27. Liang L, Feng L, Zhou L, et al. Metabolic differences between ex- smokers and nonsmokers: a metabolomic analysis. J Healthc Eng 2022; 2022: 6480749.
28. Orozco-Levi M, Garcia-Aymerich J, Villar J, et al. Wood smoke exposure and risk of chronic obstructive pulmonary disease. Eur Respir J 2006; 27: 542-546.
29. Wang R, Zhang W, Li Y, et al. Evaluation of risk factors for Chronic Obstructive Pulmonary Disease in the middle-aged and elderly rural population of Northeast China using logistic regression and principal component analysis. Risk Manag Healthc Policy 2022; 15: 1717-1726.
30. Sood A, Petersen H, Blanchette CM, et al. Wood smoke exposure and gene promoter methylation are associated with increased risk for COPD in smokers. Am J Respir Crit Care Med 2010; 182: 1098-1104.
31. Nassan FL, Wang C, Kelly RS, et al. Ambient PM2.5 species and ultrafine particle exposure and their differential metabolomic signatures. Environ Int 2021; 151: 106447.
32. Jin L, Godri Pollitt KJ, Liew Z, et al. Use of untargeted metabolomics to explore the air pollution-related disease continuum. Curr Environ Health Rep 2021; 8: 7-22.
33. Nassan FL, Kelly RS, Koutrakis P, et al. Metabolomic signatures of the short-term exposure to air pollution and temperature. Environ Res 2021; 201: 11153.
34. Gaskins AJ, Tang Z, Hood RB, et al. Periconception air pollution, metabolomic biomarkers, and fertility among women undergoing assisted reproduction. Environ Int 2021; 155: 106666.
35. Du X, Zhang Q, Jiang Y, et al. Dynamic molecular choreography induced by traffic exposure: a randomized, crossover trial using multi-omics profiling. J Hazard Mater 2021; 424: 127359.
36. Eggers LF, Miller J, Marella C, et al. Lipidomes of lung cancer and tumour-free lung tissues reveal distinct molecular signatures for cancer differentiation, age, inflammation, and pulmonary emphysema. Sci Rep 2017; 7: 11087.
37. Berdyshev EV, Serban KA, Schweitzer KS, et al. Ceramide and sphingosine-1 phosphate in COPD lungs. Thorax 2021; 76: 821-825.
38. Wendt CH, Nelsestuen G, Harvey S, et al. Peptides in bronchoalveolar lavage in chronic obstructive pulmonary disease. PLoS ONE 2016; 11: e0155724.
39. Balgoma D, Yang M, Sjödin M, et al. Linoleic acid-derived lipid mediators increase in a female-dominated subphenotype of COPD. Eur Respir J 2016; 47: 1645-1656
40. Esther CR, O'Neal WK, Anderson WH, et al. Identification of sputum biomarkers predictive of pulmonary exacerbations in COPD. Chest 2022; 161: 1239-1249.
41. Van der Does AM, Heijink M, Mayboroda OA, et al. Dynamic differences in dietary polyunsaturated fatty acid metabolism in sputum of COPD patients and controls. Biochim Biophys Acta Mol Cell Biol Lipids 2019; 1864: 224-233.
42. Azimzadeh S, Mirzaie M, Jafari M, et al. Signaling network of lipids as a comprehensive scaffold for omics data integration in sputum of COPD patients. Biochim Biophys Acta 2015; 1851: 1383-1393.
43. Celejewska-Wójcik N, Kania A, Górka K, et al. Eicosanoids and eosinophilic inflammation of airways in stable COPD. Int J Chronic Obs Pulm Dis 2021; 16: 1415-1424.
44. Yan Z, Chen B, Yang Y, et al. Multi-omics analyses of airway host-microbe interactions in chronic obstructive pulmonary disease identify potential therapeutic interventions. Nat Microbiol 2022; 7: 1361-1375.
45. Zhu T, Li S, Wang J, et al. Induced sputum metabolomic profiles and oxidative stress are associated with chronic obstructive pulmonary disease (COPD) severity: potential use for predictive, preventive, and personalized medicine. EPMA J 2020; 11: 645-659.
46. Horváth L, Barnes PJ, Loukides S, et al. A European Respiratory Society technical standard: exhaled biomarkers in lung disease. Eur Respir J 2017; 49: 1600965.
47. Peel AM, Wilkinson M, Sinha A, et al. Volatile organic compounds associated with diagnosis and disease characteristics in asthma: a systematic review. Respir Med 2020; 169: 105984.
48. Paris D, Palomba L. Tramice A, et al. Identification of biomarkers in COPD by metabolomics of exhaled breath condensate and serum/plasma. Minerva Med 2022; 113: 424-443.
49. De Laurentiis G, Paris D, Melck D, et al. Metabonomic analysis of exhaled breath condensate in adults by nuclear magnetic resonance spectroscopy. Eur Respir J 2008; 32: 1175-1183.
50. Motta A, Paris D, Melck D, et al. Nuclear magnetic resonance-based metabolomics of exhaled breath condensate: methodological aspects. Eur Respir J 2012; 39: 498-500.
51. Bertini I, Luchinat C, Miniati M, et al. Phenotyping COPD by H-1 NMR metabolomics of exhaled breath condensate. Metabolomics 2014; 10: 302-311.
52. Bregy L, Nussbaumer-Ochsner Y, Sinues P, et al. Real-time mass spectrometric identification of metabolites characteristic of chronic obstructive pulmonary disease in exhaled breath. Clin Mass Spectrom 2018; 7: 29-35.
53. Cazzola M, Segreti A, Capuano R, et al. Analysis of exhaled breath fingerprints and volatile organic compounds in COPD. COPD Res Pract 2015; 1: 277.
54. Westhoff M, Litterst P, Maddula S, et al. Differentiation of chronic obstructive pulmonary disease (COPD) including lung cancer from healthy control group by breath analysis using ion mobility spectrometry. Int J lon Mobil Spectrom 2010; 13: 131-139.
55. Gaida A, Holz O, Nell C, et al. A dual center study to compare breath volatile organic compounds from smokers and non-smokers with and without COPD. J Breath Res 2016; 10: 026006.
56. Rodríguez-Aguilar M, Ramírez-García S, Ilizaliturri-Hernández C, et al. Ultrafast gas chromatography coupled to electronic nose to identify volatile biomarkers in exhaled breath from chronic obstructive pulmonary disease patients: a pilot study. Biomed Chromatogr 2019; 33: e4684.
57. Regan EA, Hokanson JE, Murphy JR, et al. Genetic epidemiology of COPD (COPDGene) study design. COPD 2010: 7:32-43.
58. Couper D, LaVange LM, Han M, et al. Design of the subpopulations and intermediate outcomes in COPD study (SPIROMICS). Thorax 2014; 69: 492-495.
59. Vestbo J, Anderson W, Coxson HO, et al. Evaluation of COPD longitudinally to identify predictive surrogate end- points (ECLIPSE). Eur Respir J 2008; 31: 869-873.
60. Kohler M, Sandberg A, Kjellqvist S, et al. Gender differences in the bronchoalveolar lavage cell proteome of patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol 2013; 131: 743-751.
61. Titz B, Luettich K, Leroy P, et al. Alterations in serum polyunsaturated fatty acids and eicosanoids in patients with mild to moderate chronic obstructive pulmonary disease (COPD). Int J Mol Sci 2016; 17: 1583.
62. Kilk K, Aug A, Ottas A, et al. Phenotyping of chronic obstructive pulmonary disease based on the integration of metabolomes and clinical characteristics. Int J Mol Sci 2018: 19: 666.
63. Kim J. Suresh B, Lim MN, et al. Metabolomics reveals dysregulated sphingolipid and amino acid metabolism associated with chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis 2022; 17:2343-2353.
64. Gillenwater LA, Kechris KJ, Pratte KA, et al. Metabolomic profiling reveals sex specific associations with chronic obstructive pulmonary disease and emphysema. Metabolites 2021; 11: 161.
65. Zhou J, Li Q, Liu C, et al. Plasma metabolomics and lipidomics reveal perturbed metabolites in different disease stages of chronic obstructive pulmonary disease. Int J Chronic Obstr Pulm Dis 2020; 15:553-565.
66. Callejón-Leblic B, Pereira-Vega A, Vázquez-Gandullo E, et al. Study of the metabolomic relationship between lung cancer and chronic obstructive pulmonary disease based on direct infusion mass spectrometry. Biochimie 2019; 157: 111-122.
67. Liu D, Meister M, Zhang S, et al. Identification of lipid biomarker from serum in patients with chronic obstructive pulmonary disease. Respir Res 2020; 21: 242.
68. Kim DJ, Oh JY, Rhee CK, et al. Metabolic fingerprinting uncovers the distinction between the phenotypes of tuberculosis associated COPD and smoking-induced COPD. Front Med 2021; 8: 619077.
69. Wang L, Tang Y, Liu S, et al. Metabonomic profiling of serum and urine by 1H NMR-based spectroscopy discriminates patients with chronic obstructive pulmonary disease and healthy individuals. PLoS ONE 2013; 8: e65675.
70. Brandsma J, Postle AD. Analysis of the regulation of surfactant phosphatidylcholine metabolism using stable isotopes. Ann Anat 2017; 211: 176-183.
71. Bernhard W. Lung surfactant: function and composition in the context of development and respiratory physiology. Ann Anat 2016; 208: 146-150.
72. Milad N, Morissette MC. Revisiting the role of pulmonary surfactant in chronic inflammatory lung diseases and environmental exposure. Eur Respir Rev 2021; 30: 210077.
73. Ubhi BK, Riley JH, Shaw PA, et al. Metabolic profiling detects biomarkers of protein degradation in COPD patients. Eur Respir J 2012; 40: 345-355.
74. Prokic I, Lahousse L, De Vries M, et al. A cross-omics integrative study of metabolic signatures of chronic obstructive pulmonary disease. BMC Pulm Med 2020; 20: 193.
75. Celli BR, Locantore N, Yates J, et al. Inflammatory biomarkers improve clinical prediction of mortality in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012; 185: 1065-1072.
76. Diao W, Labaki WW, Han MK, et al. Disruption of histidine and energy homeostasis in chronic obstructive pulmonary disease. Int J Chronic Obstr Pulm Dis 2019; 14: 2015-2025.
77. Scott JA, Duongh M, Young AW, et al. Asymmetric dimethylarginine in chronic obstructive pulmonary disease (ADMA in COPD). Int J Mol Sci 2014; 15: 6062-6071.
78. Ruzsics IL, Nagy L, Keki S, et al. L-arginine pathway in COPD patients with acute exacerbation: a new potential biomarker. COPD 2016; 13: 139-145.
79. Huang Q, Hu D, Wang X, et al. The modification of indoor PM2.5 exposure to chronic obstructive pulmonary disease in Chinese elderly people: a meet-in-metabolite analysis. Environ Int 2018; 121: 1243-1252.
80. Carpenter CM, Zhang W, Gillenwater L, et al. PaIRKAT: a pathway integrated regression-based kernel association test with applications to metabolomics and COPD phenotypes. PLoS Comput Biol 2021; 17: e1008986.
81. Zheng H, Hu Y, Dong L, et al. Predictive diagnosis of chronic obstructive pulmonary disease using serum metabolic biomarkers and least-squares support vector machine. J Clin Lab Anal 2021; 35: e23641.
82. Zinellu A, Fois AG, Mangoni AA, et al. Systemic concentrations of asymmetric dimethylarginine (ADMA) in chronic obstructive pulmonary disease (COPD): state of the art. Amino Acids 2018; 50: 1169-1176.
83. Yu B, Flexeder C, McGarrah RW, et al. Metabolomics identifies novel blood biomarkers of pulmonary function and COPD in the general population. Metabolites 2019; 9: 61.
84. Xue M, Zeng Y, Lin R, et al. Metabolomic profiling of anaerobic and aerobic energy metabolic pathways in chronic obstructive pulmonary disease. Exp Biol Med 2021; 246: 1586-1596.
85. Naz S, Kolmert J, Yang M, et al. Metabolomics analysis identifies sex-associated metabotypes of oxidative stress and the autotaxin-lysoPA axis in COPD. Eur Respir J 2017; 49: 1602322.
86. Godbole S, Labaki WW, Pratte KA, et al. A metabolomic severity score for airflow obstruction and emphysema. Metabolites 2022; 12: 368.
87. Pallister T, Jackson MA, Martin TC, et al. Hippurate as a metabolomic marker of gut microbiome diversity: modulation by diet and relationship to metabolic syndrome. Sci Rep 2017; 7: 13670.
88. Mochizuki F, Tanabe N, lijima H, et al. Early chronic obstructive pulmonary disease: associations of two spirometry criteria with clinical features. Respir Med 2022; 204: 107011.
89. Chen C, Yang T, Wang C. The Dietary Inflammatory Index and Early COPD: results from the National Health and Nutrition Examination Survey. Nutrients 2022; 14: 2841.
90. Casas-Recasens S, Mendoza N, López-Giraldo A, et al. Telomere length but not mitochondrial DNA copy number is altered in both young and old COPD. Front Med (Lausanne) 2021; 8: 761767.
91. Budinger GRS, Kohanski RA, Gan W, et al. The intersection of aging biology and the pathobiology of lung diseases: a joint NHLBI/NIA Workshop. J Gerontol A Biol Sci Med Sci 2017; 72: 1492-1500.
92. Mangoni AA, Rodionov RN, McEvoy M, et al. New horizons in arginine metabolism, ageing and chronic disease states. Age Ageing 2019; 48: 776-782.
93. Pacitti D, Scotton CJ, Kumar V, et al. Gasping for sulfide: a critical appraisal of hydrogen sulfide in lung disease and accelerated aging. Antioxid Redox Signal 2021; 35: 551-579.
94. Zhang J, Wang X, Chen Y, et al. Exhaled hydrogen sulfide predicts airway inflammation phenotype in COPD. Respir Care 2015; 60: 251-258.
95. Chen YH, Yao WZ, Geng B, et al. Endogenous hydrogen sulfide in patients with COPD. Chest 2005; 128: 3205-3211.
96. Klinge CM, Clark BJ, Prough RA. Dehydroepiandrosterone research: past, current, and future. Vitam Horm 2018; 108: 1-28.
97. Gea J, Agustí A, Roca J. Pathophysiology of muscle dysfunction in COPD. J Appl Physiol (1985) 2013; 114: 1222-1234.
98. Cruz-Jentoft AJ. Beta-hydroxy-beta-methyl butyrate (HMB): from experimental data to clinical evidence in sarcopenia. Curr Protein Pept Sci 2018; 19: 668-672.
99. Cosío BG, Pascual-Guardia S, Borras-Santos A, et al. Phenotypic characterisation of early COPD: a prospective case-control study. ERJ Open Res 2020; 6: 00047-2020.
100. Almqvist C, Worm M, Leynaert B. Impact of gender on asthma in childhood and adolescence: a GA2LEN review. Allergy 2007; 63:47-57.
101. Ausín P, Martínez-Llorens J, Sabaté-Bresco M, et al. Sex differences in function and structure of the quadriceps muscle in chronic obstructive pulmonary disease patients. Chron Respir Dis 2017; 14: 127-139.
102. Gulcev M, Reilly C, Griffin TJ, et al. Tryptofan catabolism in acute exacerbations of chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis 2016; 11: 2435-2446.
103. Fortis S, Lusczek ER, Weinert CR, et al. Metabolomics in COPD acute respiratory failure requiring noninvasive positive pressure ventilation. Can Respir J 2017; 2017: 9480346.
104. McClay JL, Adkins DE, Isern NG, et al. (1)H nuclear magnetic resonance metabolomics analysis identifies novel urinary biomarkers for lung function. J Proteome Res 2010; 9: 3083-3090.
105. Pinto-Plata V, Casanova C, Divo M, et al. Plasma metabolomics and clinical predictors of survival differences in COPD patients. Respir Res 2019; 20: 219.
106. Greenberg CS, Miraglia CC, Rickles FR, et al. Cleavage of blood coagulation factor XIII and fibrinogen by thrombin during in vitro clotting. J Clin Invest 1985; 75: 1463-1470.
107. He Y, Wen Q, Yao F, et al. Gut-lung axis: the microbial contributions and clinical implications. Crit Rev Microbiol 2017; 43: 81-95.
108. Chunxi L, Haiyue L, Yanxia L, et al. The gut microbiota and respiratory diseases: new evidence. J Immunol Res 2020; 2020: 2340670.
109. Kozik AJ, Holguin F, Segal LN, et al. Microbiome, metabolism, and immunoregulation of asthma: an American Thoracic Society and National Institute of Allergy and Infectious Diseases workshop report. Am J Respir Cell Mol Biol 2022; 67: 155-163.
110. Cuello-Garcia CA, Brozek JL, Fiocchi A, et al. Probiotics for the prevention of allergy: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol 2015; 136: 952-961.
111. Li L, Fang Z, Lee Y-K, et al. Prophylactic effects of oral administration of Lactobacillus casei on house dust mite- induced asthma in mice. Food Funct 2020; 11: 9272-9284.
112. Hill C, Guarner F, Reid G, et al. Expert consensus document: the International Scientific Association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nar Rev Gastroenterol Hepatol 2014; 11: 506-514.
113. Bowerman KL, Rehman SF, Vaughan A, et al. Disease-associated gut microbiome and metabolome changes in patients with chronic obstructive pulmonary disease. Nat Commun 2020; 11: 5886.
114. Kotlyarov S. Role of short-chain fatty acids produced by gut microbiota in innate lung immunity and pathogenesis of the heterogeneous course of chronic obstructive pulmonary disease. Int J Mol Sci 2022; 23: 4768.
115. Chiu YC, Lee SW, Liu CW, et al. Comprehensive profiling of the gut microbiota in patients with chronic obstructive pulmonary disease of varying severity. PLoS ONE 2021; 16: e0249944.
116. Millares L, Pascual S, Montón C, et al. Relationship between the respiratory microbiome and the severity of airflow limitation, history of exacerbations and circulating eosinophils in COPD patients. BMC Pulm Med 2019; 19: 112.
117. Yang R, Zhang Q, Ren Z, et al. Different airway inflammatory phenotypes correlate with specific fungal and bacterial microbiota in asthma and chronic obstructive pulmonary disease. J Immunol Res 2022; 2022: 2177884.
118. Opron K, Begley LA, Erb-Downward JR, et al. Lung microbiota associations with clinical features of COPD in the SPIROMICS cohort. NPJ Biofilms Microbiomes 2021; 7: 14.
119. Madapoosi SS, Cruickshank-Quinn C, Opron K, et al. Lung microbiota and metabolites collectively associate with clinical outcomes in milder stage Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2022; 206: 427-439.
120. Yang CY, Li SW, Chin CY, et al. Association of exacerbation phenotype with the sputum microbiome in chronic obstructive pulmonary disease patients during the clinically stable state. J Transi Med 2021; 19: 121.
121. Heinrich A, Heyl KA, Klaile E, et al. Moraxella catarrhalis induces CEACAM3-Syk-CARD9-dependent activation of human granulocytes. Cell Microbiol 2016; 18: 1570-1582.
122. Zahlten J, Kim Y-J, Doehn J-M, et al. Streptococcus pneumoniae-induced oxidative stress in lung epithelial cells depends on pneumococcal autolysis and is reversible by resveratrol. J Infect Dis 2015; 211: 1822-1830.
123. Dicker AJ, Huang JTJ, Lonergan M, et al. The sputum microbiome, airway inflammation, and mortality in chronic obstructive pulmonary disease. J Allergy Clin Immunol 2021; 147: 158-167.
124. McGeachie MJ, Dahlin A, Qiu W, et al. The metabolomics of asthma control: a promising link between genetics and disease. Immun Inflamm Dis 2015; 3: 224-238.
125. Vignoli A, Santini G, Tenori L, et al. NMR-based metabolomics for the assessment of inhaled pharmacotherapy in chronic obstructive pulmonary disease patients. J Proteome Res 2020; 19: 64-74.
126. Quan-Jun Y, Jian-Ping Z, Jian-Hua Z, et al. Distinct metabolic profile of inhaled budesonide and Salbutamol in asthmatic children during acute exacerbation. Basic Clin Pharmacol Toxicol 2017; 120: 303-311.
127. Tan LC, Yang WJ, Fu WP, et al. 1HNMR-based metabolic profiling of healthy individuals and high-resolution CT- classified phenotypes of COPD with treatment of tiotropium bromide. Int J Chron Obstruct Pulmon Dis 2018; 13: 2985-2997.
128. Maniscalco M, Paris D, Cuomo P, et al. Metabolomics of COPD pulmonary rehabilitation outcomes via exhaled breath condensate. Cells 2022; 11: 344.
129. Li X, Cheng J, Shen Y, et al. Metabolomic analysis of lung cancer patients with chronic obstructive pulmonary disease using gas chromatography-mass spectrometry. J Pharm Biomed Anal 2020; 190: 113524.
130. Muñoz-Lucas MÁ, Jareño-Esteban J, Gutiérrez-Ortega C, et al. Influence of chronic obstructive pulmonary disease on volatile organic compounds in patients with non-small cell lung cancer. Arch Bronconeumol 2020; 56: 801-805.
131. Bowler RP, Jacobson 5, Cruickshank C, et al. Plasma sphingolipids associated with chronic obstructive pulmonary disease phenotypes. Am J Respir Crit Care Med 2015; 191: 275-284.
132. Ubhi BK, Cheng KK, Dong J, et al. Targeted metabolomics identifies perturbations in amino acid metabolism that sub-classify patients with COPD. Mol BioSyst 2012; 8: 3125-3133.
133. Gea J, Sancho-Muñoz A, Chalela R. Nutritional status and muscle dysfunction in chronic respiratory diseases: stable phase versus acute exacerbations. J Thorac Dis 2018; 10: Suppl. 12, S1332-S1354.
134. Rodriguez DA, Alcarraz-Vizan G, Diaz-Moralli S, et al. Plasma metabolic profile in COPD patients: effects of exercise and endurance training. Metabolomics 2012; 8: 508-516.
135. Llabaki WW, Gu T, Murray S, et al. Serum amino acid concentrations and clinical outcomes in smokers: SPIROMICS metabolomics study. Sci Rep 2019; 9: 11367.
136. Miravitlles M, Monteagudo M, Solntseva L, et al. Blood eosinophil counts and their variability and risk of exacerbations in COPD: a population-based study. Arch Bronconeumol 2021; 57: 13-20.
137. Miravitlles M, Soler-Cataluña JJ, Soriano JB, et al. Determinants of blood eosinophil levels in the general population and patients with COPD: a population-based, epidemiological study. Respir Res 2022; 23: 49.
138. Ghosh N, Choudhury P, Subramani E, et al. Metabolomic signatures of asthma-COPD overlap (ACO) are different from asthma and COPD. Metabolomics 2019; 15: 87.
139. Oh JY, Lee YS, Min KH, et al. Increased urinary L-histidine in patients with asthma COPD overlap: a pilot study. Int J Chron Obstruct Pulmon Dis 2018; 13: 1809-1818.
140. Ghosh N, Choudhury P, Joshi M, et al. Global metabolome profiling of exhaled breath condensates in male smokers with asthma COPD overlap and prediction of the disease. Sci Rep 2021; 11: 16664.
141. Ghosh N, Choudhury P, Kaushik SR, et al. Metabolomic fingerprinting and systemic inflammatory profiling of asthma COPD overlap (ACO). Respir Res 2020; 21: 126.
142. Cai C, Bian X, Xue M, et al. Eicosanoids metabolized through LOX distinguish asthma-COPD overlap from COPD by metabolomics study. Int J Chron Obstruct Pulmon Dis 2019; 14: 1769-1778.
143. Papaiwannou A, Zarogoulidis P, Porpodis K, et al. Asthma-chronic obstructive pulmonary disease overlap syndrome (ACOS): current literature review. J Thorac Dis 2014; 6: Suppl. 1, S146-S151.
144. Sorino C, Scichilone N, D'Amato M, et al. Asthma-COPD overlap syndrome: recent advances in diagnostic criteria and prognostic significance. Minerva Med 2017; 108: Suppl. 1, 1-5.
145. Menezes AMB, Montes de Oca M, Pérez-Padilla R, et al. Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype: COPD-asthma. Chest 2014; 145: 297-304.
146. De Laurentiis G, Paris D, Melck D, et al. Separating smoking-related diseases using NMR-based metabolomics of exhaled breath condensate. J Proteome Res 2013; 12: 1502-1511.
147. Maniscalco M, Paris D, Melck DJ, et al. Differential diagnosis between newly diagnosed asthma and COPD using exhaled breath condensate metabolomics: a pilot study. Eur Respir J 2018; 51: 1701825.
148. Liang Y, Gai XY, Chang C, et al. Metabolomic profiling differences among asthma, COPD, and healthy subjects: a LC-MS-based metabolomic analysis. Biomed Environ Sci 2019; 32: 659-672.
149. Adamko DJ, Nair P, Mayers L, et al. Metabolomic profiling of asthma and chronic obstructive pulmonary disease: a pilot study differentiating diseases. J Allergy Clin Immunol 2015; 136: 571-580.
150. Godbole S, Bowler RP. Metabolome features of COPD: a scoping review. Metabolites 2022; 12: 621.
151. Fuschillo S, Paris D, Tramice A, et al. Metabolomic profiling of exhaled breath condensate and plasma/ serum in chronic obstructive pulmonary disease. Curr Med Chem 2022; 29: 2385-2398.
152. Pulik K, Mycroft K, Korczynski, et al. Metabolomic analysis of respiratory epithelial lining fluid in patients with Chronic Obstructive Pulmonary Disease: a systematic review. Cells 2023; 12: 833.
Bạn đọc có thể tham khảo cách chẩn đoán và điều trị bệnh phổi tắc nghẽn mãn tính theo GOLD 2022 sau đây:

