Bài viết tổng quan Lao phổi với nguy cơ tắc nghẽn và COPD
TS. BS. NGUYỄN VĂN THÀNH
PCT Hội Hô hấp VN, PCT Hội Phổi Việt Nam
Tải bản PDF TẠI ĐÂY
1 ĐẶT VẤN ĐỀ
Bệnh phổi tắc nghẽn mạn tính (COPD) và bệnh lao (TB) là hai nguyên nhân quan trọng gây tử vong và bệnh tật ở các nước đang phát triển và nằm trong 10 nguyên nhân gây tử vong hàng đầu [1]. Mối liên quan giữa bệnh lao và bệnh phổi tắc nghẽn mạn tính rất phức tạp. Một số lượng đáng kể bệnh nhân lao phát triển bệnh đường hô hấp sau lao hoặc bệnh phổi tắc nghẽn mạn tính liên quan đến lao [2-5]. Đây là mối quan hệ được báo cáo phổ biến. Điều này cũng đã được công bố bởi nhiều hiệp hội chuyên ngành lao và bệnh phổi trên toàn cầu. Trong đó nhấn mạnh: a) Bệnh nhân COPD cũng có nguy cơ cao mắc bệnh lao phổi [6]. b) COPD là bệnh đi kèm phổ biến trên bệnh nhân lao, chỉ đứng sau bệnh tiểu đường [7-9]. c) Tiền sử bệnh lao tác động tiêu cực đến diễn biến lâu dài của bệnh COPD với tỷ lệ tử vong sớm và tần suất các đợt cấp tăng lên [10]. d) COPD cũng làm thay đổi biểu hiện lâm sàng của bệnh lao và là yếu tố nguy cơ làm tăng tỷ lệ mắc bệnh và tử vong do bệnh lao [11,12].
Nghiên cứu của Agarwal và cs (Ấn Độ) ghi nhận 32,4% bệnh nhân COPD có tiền sử bệnh lao [13]. Trong nghiên cứu PLATINO so sánh bệnh nhân COPD có và không có tiền sử lao, đã thấy tắc nghẽn đường thở được quan sát thấy ở 30,7% bệnh nhân có tiền sử dương tính với bệnh lao, trong khi tỷ lệ mắc bệnh tương tự chỉ là 9,0-13,0% ở những người không có tiền sử lao trước đó [14]. Trong một nghiên cứu ở Việt Nam gần đây, các tác giả ghi nhận có 14,20% bệnh nhân COPD đang quản lý điều trị có tổn thương là dấu tích của lao phổi cũ [15]. Thậm trí một nghiên cứu từ Columbia cũng đã báo cáo rằng mối liên quan giữa bệnh lao và tắc nghẽn đường thở mạnh hơn mối liên quan giữa hút thuốc lá và tắc nghẽn đường thở [16]. Trong một nghiên cứu, Yakar và cs đánh giá tác động của bệnh lao lên diễn biến của COPD và nhận thấy bệnh nhân có tiền sử lao được chẩn đoán mắc COPD sớm hơn 5 năm, nhập viện vì đợt cấp COPD thường xuyên hơn và tuổi thọ ngắn hơn 5 năm [10]. Hơn nữa, những bệnh nhân mắc COPD thứ phát sau lao có giá trị FEV1 thấp hơn có ý nghĩa, sức cản đường thở cao hơn và đáp ứng dương tính với thuốc dãn phế quản kém hơn (27% so với 82%) so với bệnh nhân COPD đơn thuần [17]. Những bất thường về chức năng phổi có liên quan có ý nghĩa với mức độ tổn thương phổi, thời gian mắc bệnh, các đợt mắc bệnh lao và độ tuổi trên 40 [18,19].
WHO ước tính COPD ở Việt Nam với tỷ lệ khoảng 7,1% trên dân số nam (1,9% dân số nữ) từ 40 trở lên [20]. Từ một nghiên cứu dịch tễ lao tại Việt Nam gần đây (năm 2020) [21] ghi nhận lao phổi phát hiện chủ động và xác định bằng vi trùng học có tỷ lệ lưu hành là 322/100.000 dân. Điều đáng lưu ý là 32,1% bệnh nhân lao phổi không báo cáo bất kỳ triệu chứng nào phù hợp với bệnh lao, trong khi kết quả chụp X-quang ngực của họ cho thấy 97,7% (95%CI: 94,6-99,1) có hình ảnh chụp X-quang ngực bất thường gợi ý bệnh lao. Trong báo cáo này không số liệu về đặc điểm hút
thuốc lá, đặc điểm đi khám vì triệu chứng hô hấp, có được đo chức năng hô hấp hay không và có bao nhiêu trong số họ được chẩn đoán COPD. Nhìn một cách khái quát, Việt Nam là quốc gia có dịch tễ lao và COPD cao (hình 1).
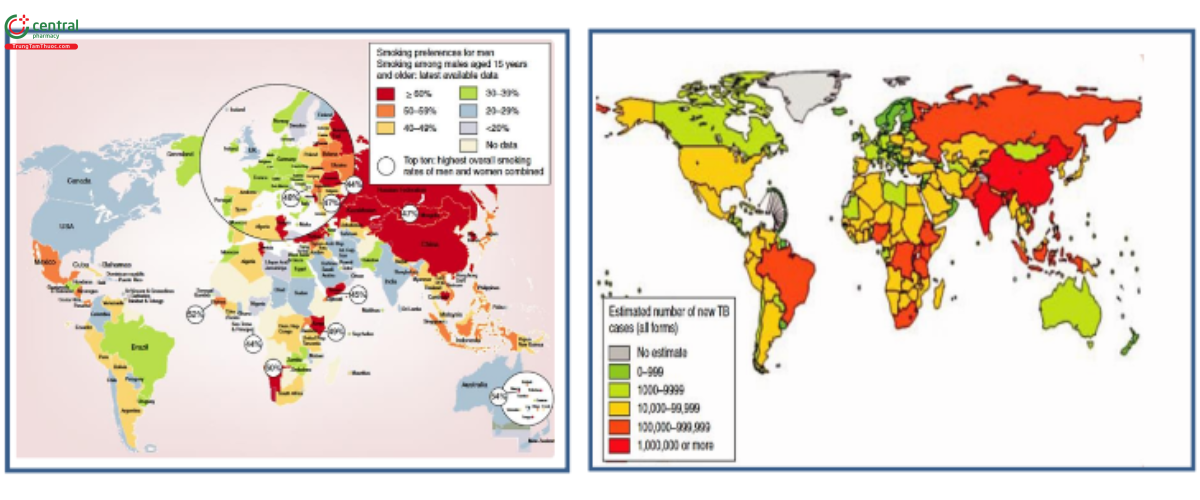
Hình 1. Tỷ lệ hút thuốc toàn cầu ở nam giới. Ước tính số ca mắc bệnh lao mới năm 2005) (Nguồn trích dẫn: Madhukar Pai et al. Lethal interaction: the colliding epidemics of tobacco and tuberculosis. Expert Rev. Anti Infect. Ther. 5(3), 385-391 (2007)
Trong một cứu theo dõi đoàn hệ cộng đồng quy mô quốc gia tại Taiwan năm 2013, các tác giả ghi nhận nguy cơ lao phổi trên người COPD là HR 2.468 (95%CI 2.205-2.762) và họ là những người đang được điều trị corticosteroid và kích thích beta2 uống nhiều hơn so với nhóm chứng [6].
Tổ chức Y tế Thế giới vào năm 2012 (WHO Report) cho biết rằng có hơn 3 triệu người chết vì COPD và hơn 90% số ca tử vong này xảy ra ở các nước đang phát triển [22]. Tỷ lệ tử vong do COPD cũng đang có xu hướng ngày càng tăng. COPD là nguyên nhân gây tử vong đứng thứ tư vào năm 1990 và hiện nay, đây là nguyên nhân gây tử vong đứng thứ ba trên phạm vi toàn cầu [23]. Trong khi đó bệnh lao, cũng theo báo cáo của WHO năm 2014, có 9,6 triệu người mắc bệnh lao hoạt động và 1,5 triệu người chết vì bệnh lao. Đây là nguyên nhân nhiễm trùng gây tử vong hàng đầu trên toàn cầu [24]. Khoảng 58% số ca bệnh lao trên thế giới xảy ra ở Đông Nam Á và Ấn Độ đóng góp tới 23% gánh nặng bệnh lao toàn cầu [24]. Các nước đang phát triển đang phải đối mặt với dịch bệnh kép gồm các bệnh truyền nhiễm như bệnh lao, nhiễm vi-rút gây suy giảm miễn dịch ở người (HIV) và các bệnh không lây nhiễm như hút thuốc lá và COPD [25]. Sự hội tụ của các dịch bệnh này có thể làm tăng khả năng mắc bệnh.
Hút thuốc là yếu tố nguy cơ thông thường của COPD nhưng chắc chắn không phải là yếu tố nguy cơ duy nhất. Lao phổi, dù đã được điều trị cũng là những yếu tố nguy cơ quan trọng trong các nguyên nhân gây bệnh, đặc biệt là ở các nước đang phát triển [26,27]. Tiền sử lao phổi trong quá khứ gần đây đã nổi lên như một yếu tố nguy cơ cho sự phát triển bệnh COPD về sau. Nếu mối quan hệ này là chính xác, nó sẽ đặt ra gánh nặng đáng kể cho ngành y tế vì thực tế là tỷ lệ mắc cả hai bệnh này đều cao ở các nước đang phát triển. Sự phát triển COPD sau lao không phải là một suy nghĩ mới, tuy nhiên, vấn đề này chỉ mới được nghiên cứu chi tiết gần đây. Allwood và cs đặt tên tình trạng bệnh phổi tắc nghẽn liên quan đến bệnh lao là TOPD (tuberculosis - associated obstructive pulmonary disease) [28], nhưng vấn đề kết hợp vẫn còn được tranh luận rằng liệu tắc nghẽn luồng khí mạn tính và TOPD là hai thực thể bệnh khác nhau hay giống nhau.
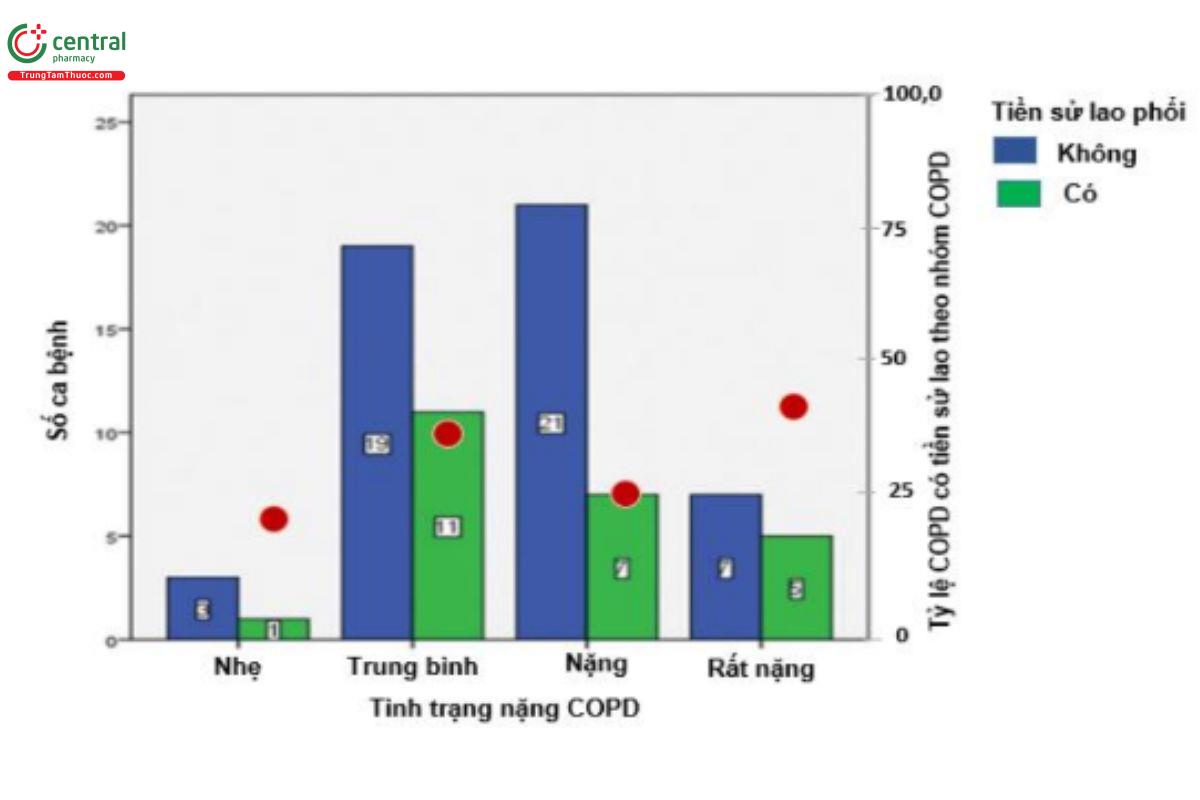
Hình 2. Phân bố bệnh nhân COPD có tiền sử lao phổi hay không theo mức độ nặng của tình trạng tắc nghẽn. Hình tròn đỏ: Tỷ lệ kết hợp COPD với tiền sử lao phổi với từng nhóm bệnh nhân theo mức độ nặng. (Nguồn trích dẫn: Aggarwal D, Gupta A, Janmeja AK, Bhardwaj M. Evaluation of tuberculosis-associated chronic obstructive pulmonary disease at a tertiary care hospital: A case- control study. Lung India 2017;34:415-9 có chỉnh sửa).
Là một nước có dịch tễ lao và COPD cao. Mối quan tâm của các thầy thuốc lâm sàng và các nhà hoạch định chiến lược điều trị cho hai bệnh lý này rất quan tâm, và thực tế, Việt Nam còn thiếu các nghiên cứu đánh giá tác động của mối liên hệ bệnh lý giữa lao và COPD. Bài tổng quan y văn này cung cấp các thông tin cần thiết cho tới hiện nay về sự kết hợp giữa lao phổi và COPD.
2 LIÊN QUAN VÀ SINH BỆNH HỌC LAO PHỔI - COPD
2.1 Lao phổi với nguy cơ tắc nghẽn và COPD
Bệnh nhân lao phổi có thể bị tắc nghẽn luồng khí trong giai đoạn tổn thương đang hoạt động hoặc giai đoạn sau điều trị bệnh. Tỷ lệ tắc nghẽn luồng khí trong bệnh lao phổi rất khác nhau tùy thuộc vào bản chất của nghiên cứu, định nghĩa về tắc nghẽn luồng khí được sử dụng và vị trí địa lý. Mối liên quan giữa tiền sử bệnh lao và sự phát triển tắc nghẽn mạn tính luồng khí sau đó đã được báo cáo ngay từ những năm 1950 và 1960. Tuy nhiên, nhược điểm lớn nhất trong các nghiên cứu ban đầu là thiếu sự kiểm soát đầy đủ do tác động gây nhiễu từ việc hút thuốc đối với sự tắc nghẽn luồng khí không được hiệu chỉnh [29].
Gaensler và cs trong một nghiên cứu được thực hiện vào năm 1959 [30], đã báo cáo bằng chứng tắc nghẽn luồng khí ở 61% trong số 1.533 bệnh nhân lao phổi. Trong một nghiên cứu cắt ngang, Snider và cs sau đó [31] đã đánh giá trên 1.403 bệnh nhân bệnh lao phổi đã báo cáo tình trạng tắc nghẽn luồng khí (được xác định bằng thể tỷ lệ FVC <70%) ở 23% bệnh nhân. Các tác giả nhận thấy không có mối liên hệ đáng kể nào giữa hút thuốc và tắc nghẽn luồng khí mặc dù tỷ lệ hút thuốc rất cao ở những bệnh nhân nghiên cứu. Không có mối liên quan giữa độ dài thời gian của bệnh lao hoạt động trước khi biểu hiện tắc nghẽn luồng khí. Tắc nghẽn luồng khí thường gặp hơn ở những bệnh nhân có tiền sử có khạc đờm buổi sáng. Anno và cs trong một nghiên cứu vào năm 1995 đã báo cáo sự suy giảm chức năng hô hấp ở bệnh nhân lao phổi. Có sự gia tăng về thể tích cặn (RV), tỷ lệ thể tích cặn/tổng dung tích phổi và giảm dung tích thở tối đa ở một nhóm bệnh nhân lao phổi [32]. Một số nghiên cứu trong những năm gần đây hơn đã củng cố thêm những phát hiện trước đó về mối tương quan thuận giữa bệnh lao và sự phát triển của tắc nghẽn luồng khí mạn tính. Lam và cs năm 2010 [33] trong một nghiên cứu đã báo cáo tiền sử bệnh lao trong quá khứ là một yếu tố dự báo độc lập về tắc nghẽn luồng khí với OR là 1,37 sau khi hiệu chỉnh giới tính, tuổi và mức độ phơi nhiễm với thuốc lá. Tuy nhiên, trong nghiên cứu này, tỷ lệ FEV1/FVC trước thuốc giãn phế quản đã được sử dụng thay cho tỷ lệ FEV1/FVC sau thuốc giãn phế quản như thông thường để xác định tắc nghẽn luồng khí. Lee và cs [34] trong một nghiên cứu quốc gia ở Hàn Quốc năm 2011, đã phân tích ảnh hưởng của bệnh lao trước đây đến nguy cơ phát triển bệnh phổi tắc nghẽn. Tổng số 294 đối tượng có bằng chứng về bệnh lao trước đó trên X-quang ngực. Sau khi hiệu chỉnh theo giới, tuổi và tiền sử hút thuốc, bằng chứng X-quang của bệnh lao trước đó có liên quan độc lập với tắc nghẽn luồng khí với OR là 2,56. Nguy cơ này cũng hiện diện ngay cả ở những bệnh nhân chỉ có những thay đổi tối thiểu trên X-quang. Nghiên cứu PLATINO dựa trên dân số đa trung tâm [14] cũng đánh giá mối quan hệ giữa tiền sử bệnh lao trong quá khứ và sự phát triển tình trạng tắc nghẽn đường thở ở năm quốc gia Mỹ La-tinh. Đối tượng ở độ tuổi ≥40 được đo phế dung ký trước và sau thuốc giãn phế quản. Tỷ lệ tắc nghẽn đường thở chung là 30,7% ở những người có tiền sử bệnh lao, so với 13,9% ở những người không có tiền sử bệnh lao với OR 2,33 sau khi hiệu chỉnh các yếu tố gây nhiễu như tuổi, giới, học vấn, dân tộc, hút thuốc, phơi nhiễm bụi và khói, bệnh tật về đường hô hấp khi còn là trẻ em và bệnh tật hiện tại. Nguy cơ ở nam cao hơn nữ với OR sau hiệu chỉnh lần lượt là 3,99 và 1,71. Mối liên quan giữa bệnh lao và COPD thậm chí còn mạnh mẽ hơn ở những người chưa bao giờ hút thuốc. Tiền sử bệnh lao trước đây cũng cho thấy dạng COPD nặng hơn. Nghiên cứu về gánh nặng của bệnh phổi tắc nghẽn (BOLD) cũng cho thấy tiền sử bệnh lao trong quá khứ là yếu tố nguy cơ phát triển tắc nghẽn luồng khí sau này với OR sau hiệu chỉnh là 2,51 [35]. Hai tổng quan hệ thống gần đây hơn cũng xác nhận mối liên quan này [36,37].
Allwood và cs năm 2013 [36] trong một tổng quan hệ thống đã đánh giá mối quan hệ giữa bệnh lao phổi và sự phát triển của tắc nghẽn luồng khí mạn tính. Tổng số 19 nghiên cứu bao gồm 1 nghiên cứu loạt ca, 3 nghiên cứu bệnh chứng, 4 nghiên cứu đoàn hệ, 8 nghiên cứu cắt ngang đơn trung tâm và 3 nghiên cứu cắt ngang đa trung tâm, đủ điều kiện để phân tích. Các tác giả đã xác nhận có mối tương quan thuận giữa tiền sử bệnh lao trong quá khứ và sự hiện diện của tắc nghẽn luồng khí mạn tính. Mối tương quan này độc lập với việc hút thuốc lá và tiếp xúc với nhiên liệu sinh khối. Byrne và cs năm 2015 [37] trong một tổng quan hệ thống và phân tích gộp khác cho thấy mối liên quan giữa tiền sử bệnh lao trước đây và sự hiện diện của COPD là mạnh nhất ở những người chưa bao giờ hút thuốc và những người trẻ tuổi (<40 tuổi). Sự phát triển tắc nghẽn luồng khí mạn tính cũng phụ thuộc vào khu vực địa lý. Tỷ lệ này cao hơn ở những quốc gia có tỷ lệ mắc bệnh lao cao. Tỷ lệ phát triển tắc nghẽn luồng khí mạn tính cao hơn ba lần ở các quốc gia có tỷ lệ mắc bệnh lao tính trên 100/100.000. Cụ thể OR sau hiệu chỉnh là 3,13 đối với người trưởng thành Hàn Quốc [34]; 4,9 và 6,6 đối với nam và nữ ở Nam Phi [38] và 6,31 đối với Philippines [39].
Bệnh nhân lao phổi thường bị mất chức năng phổi tối đa trong vòng sáu tháng kể từ khi được chẩn đoán mắc bệnh lao và bệnh sẽ ổn định sau 18 tháng sau khi hoàn thành điều trị [40, 41]. Hnizdo và cs [19](1:19) đã quan sát thấy giá trị FEV1 giảm 56,8 mL mỗi tháng, với mức thấp nhất giá trị FEV1 được thấy ở khoảng 6 tháng sau điều trị bệnh lao và nó ổn định lại dần từ 7 đến 12 tháng sau đó. Vargha và cs [42] đã đo dung tích sống (VC), FEV1 và RV ở những bệnh nhân mắc bệnh lao xuất viện vào năm 1958/59. Trên 40 bệnh nhân có dạng tắc nghẽn dựa trên tỷ lệ FEV1/VC%. Việc đánh giá lại được thực hiện sau khoảng 15 năm sau cho thấy thay đổi FEV1 là 35,3 mL/năm. Tuy nhiên, không thể loại trừ tác động của các yếu tố môi trường độc hại khác trong thời gian theo dõi dài như vậy [41]. Rhea và cs báo cáo mức giảm trung bình hàng năm về giá trị FEV1 là 38,24±7,98 mL [43]. Các tác giả trong nghiên cứu này cũng nhấn mạnh sự tương quan thuận giữa độ rộng của tổn thương và mức độ giảm chức năng phổi, nhiều đợt cấp. Từ một số nghiên cứu khác [44-46], theo dõi bệnh nhân tắc nghẽn luồng khí sau lao phổi các tác giả cho thấy những bệnh nhân này có nhiều triệu chứng hơn, nhiều đợt cấp hơn, nhập viện và tỷ lệ tử vong cao hơn so với COPD không sau lao phổi. (hình 3)
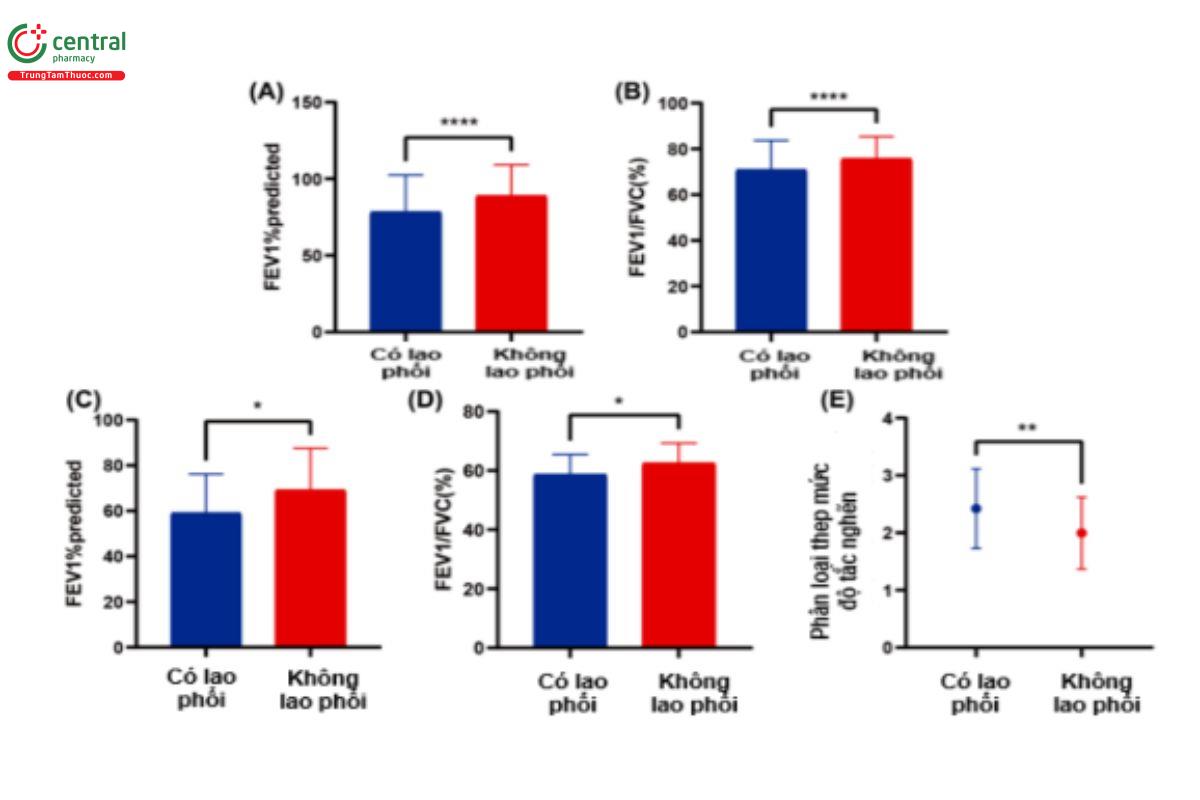
Hình 3. Mối liên quan giữa tiền sử bệnh lao và tắc nghẽn luồng khí. Chú thích: Hàng trên: Trên toàn bộ các đối tượng được thu tuyển vào nghiên cứu. Hàng dưới: Trên bệnh nhân COPD (Nguồn trích dẫn: Wang et al. Impact of Previous Pulmonary Tuberculosis on Chronic Obstructive Pulmonary Disease: Baseline Results from a Prospective Cohort Stud. Combinatorial Chemistry & High Throughput Screening, 2023, Vol. 26, No. 1.)
Tần suất và mức độ nghiêm trọng của tắc nghẽn luồng khí trong lao phổi phụ thuộc vào số lần bị bệnh lao. Hnizdo và cs [19] đã nghiên cứu mối quan hệ này ở 27.660 thợ mỏ vàng ở Nam Phi. Tần suất tắc nghẽn luồng khí mạn tính tỷ lệ thuận với số lần bệnh lao. Tỷ lệ tắc nghẽn luồng khí mạn tính sau một lần lao là 18,4%, trong khi tỷ lệ tắc nghẽn luồng khí sau 2 và 3 lần lượt là 27,1% và 35,2%. Các tổn thương cấu trúc của phổi tăng lên cùng với số lượng các đợt bệnh lao tăng và vẫn tồn tại ở một số lượng lớn bệnh nhân mặc dù đã được điều trị hóa trị liệu chống lao. Mức giảm FEV1 cũng được báo cáo cao nhất trong nghiên cứu này, có thể liên quan đến tác động tổng hợp của các yếu tố khác như hút thuốc và phơi nhiễm bụi từ môi trường lao động (trong nghiên cứu này không thực hiện hiệu chỉnh các yếu tố có thể liên quan). Số lần bệnh lao tăng cũng làm tăng tốc độ mất FEV1 và lượng mất trung bình sau một, hai và ba lần lao trở lên lần lượt là 153mL, 326mL và 410mL. Plit và cs [40] đã đánh giá tiến cứu tác động của hóa trị liệu chống lao lên chức năng phổi của bệnh nhân lao phổi mới được chẩn đoán. Hóa trị chống lao giúp cải thiện chức năng phổi ở 54% bệnh nhân. Tuy nhiên, hội chứng hạn chế và tắc nghẽn vẫn còn thấy 28% và 24% bệnh nhân tương ứng sau điều trị. Sự suy giảm chức năng phổi còn lại phụ thuộc vào cả mức độ tổn thương X-quang trước và sau điều trị lao. Nghiên cứu này cho thấy sự suy giảm chức năng phổi có thể phát triển ngay cả sau khi điều trị lao phổi thành công.
Lao phổi cũng là yếu tố nguy cơ gây tắc nghẽn luồng khí mạn tính mạnh hơn so với hút thuốc. Nghiên cứu về tỷ lệ mắc COPD ở Colombia (PREPOCOL) đã đánh giá tỷ lệ hiện mắc và các yếu tố nguy cơ của bệnh COPD ở năm thành phố của Colombia. Người ta đã thấy mối liên hệ chặt chẽ giữa tiền sử bệnh lao và sự phát triển của tắc nghẽn luồng khí (OR là 2,94) và mối liên hệ này lớn hơn so với hút thuốc [16]. Tương tự, Ehrlich và cs [38] trong một cuộc khảo sát toàn quốc với 13.826 người trưởng thành ở Nam Phi, phát hiện tiền sử bệnh lao phổi là yếu tố dự báo bệnh COPD mạnh hơn so với việc hút thuốc lá hoặc tiếp xúc với khói nhiên liệu sinh khối. Ngahane và cs [47] đã nghiên cứu tỷ lệ lưu hành và các yếu tố dự báo suy giảm chức năng phổi tại một phòng khám lao ở Cameroon. Các tác giả báo cáo suy giảm chức năng phổi ở 45,4% bệnh nhân. Thời gian của các triệu chứng và kiểu X-quang xơ hóa là các yếu tố nguy cơ độc lập đối với suy giảm chức năng phổi trên phân tích đa biến. Bệnh nhân lao phổi được điều trị có thể bị tắc nghẽn luồng khí ở phế quản đầu xa, được xác định bằng FEF25-75% <65% và tỷ lệ ≥FEV1/FVC ≥0,70. Pefura-Yone và cs [48] đã báo cáo tắc nghẽn luồng khí ở khu vực này là 62,9% trên bệnh nhân lao phổi đã được điều trị thành công. Sự tắc nghẽn luồng khí ở phế quản đầu xa có liên quan độc lập với các dấu hiệu phổi mạn tính dai dẳng. Bệnh nhân càng nhiều lần bị lao, chức năng hô hấp càng giảm [49]. Một phân tích gộp do Huanhuan Fan và cs [49b] ghi nhận so với nhóm đối chứng, bệnh nhân lao phổi có nguy cơ cao hơn (OR=2,59; CI 95%: 2,12-3,15; P<0,001) phát triển COPD. Phân tích dưới nhóm cho thấy kết luận vẫn tương tự trên những người không bao giờ hút thuốc (OR 2,41; 95% CI: 1,74-3,32; P<0,001), trên bệnh nhân lao phổi được chẩn đoán bằng X-quang ngực (OR 2,47; 95% CI: 1,23- 4,97; P<0,001) và ở những quốc gia có thu nhập thấp và trung bình (OR 2,70; CI 95%: 2,08-3,51; P<0,001). Tỷ lệ lưu hành gộp của COPD ở bệnh nhân bị lao phổi trước đó là 21% (CI 95% 16-25%; P <0,001). Trên cơ sở các dữ liệu phân tích này, các tác giả kết luận rằng những người có tiền sử lao phổi có nguy cơ cao hơn và tỷ lệ mắc COPD cao hơn.
Nguy cơ phát triển COPD về sau không đặc hiệu đối với bệnh lao do Mycobacteria tuberculosis. Diễn biến này cũng đã được báo cáo ngay cả với các loài mycobacteria không lao (NTM). Yeh và cs [50] trong một nghiên cứu đoàn hệ ở Đài Loan gồm 3.005 bệnh nhân NTM cho thấy bệnh nhân NTM có nguy cơ mắc bệnh COPD cao gấp 3,08 lần so với không phải NTM. Bệnh nhân NTM có chức năng phổi bất thường ban đầu cho thấy có sự cải thiện sau khi điều trị bằng macrolide [51].
Thành phần kháng nguyên thành của M. tuberculosis là lipoarabinomannan kích thích giải phóng men phá hủy cấu trúc nền ngoại bào phổi (metalloproteinase matrix, MMP) [52,53]. Trong khí đó, sự biểu hiện gia tăng của MMP, tế bào lympho CD8, bạch cầu đa nhân trung tính, interleukin 8 và phát triển nội mô mạch máu dẫn đến những thay đổi về cấu trúc cũng được thấy trên những người hút thuốc lá bị COPD. Mối quan hệ phức tạp giữa hút thuốc, COPD và lao với sự biểu hiện ngày càng tăng của các men phân giải protein, cytokine và Interleukin dẫn đến tổn thương cấu trúc được thấy ở cả COPD và lao [54,55]. Tuy nhiên, hút thuốc không phải là yếu tố duy nhất trong cơ chế bệnh sinh của bệnh phổi tắc nghẽn mạn tính và bệnh lao. Trong một nghiên cứu về COPD ở những người chưa bao giờ hút thuốc, chỉ có 5,3% bệnh nhân COPD có tiền sử bệnh lao [56]. Có vẻ như khả năng một cá thể phát triển bệnh lao hoạt động và COPD còn liên quan đến sự tương tác phức tạp giữa di truyền với môi trường, và kết quả phụ thuộc vào tác động thực sự của men phân giải protein (Protease), mất cân bằng protease/anti-protease và mức độ oxy hóa quá mức [29,55,57,58].
Cơ chế chính xác của tắc nghẽn luồng khí mạn tính ở bệnh nhân sau lao còn chưa rõ ràng. Các cơ chế còn mang tính giả thuyết, bao gồm: giãn phế quản, hẹp tiểu phế quản và viêm phế quản tắc nghẽn và gia tăng khí phế thũng [59] hình 4. Đường thở nhỏ là đường thở không có sụn, đường kính nội lòng <2 mm. Đây là vị trí quan trọng hình thành thông khí cạm khi tổn thương phế quản khu vực này lan rộng. Các tổn thương do lao có thể liên quan đến đường thở nhỏ và dẫn đến tắc nghẽn luồng khí. Im và cs báo cáo có các nốt trung tâm tiểu thùy, xuất hiện hình ảnh dạng “chồi cây” và các nốt không rõ ràng ở 95% số người lao phổi [60]. Những tổn thương này biến mất sau 5 tháng bắt đầu hóa trị. Ở các nước lưu hành bệnh lao, bệnh lao là nguyên nhân quan trọng gây viêm tiểu phế quản tắc nghẽn. Trong loạt nghiên cứu của Gothi và cs [61], 92% trường hợp viêm tiểu phế quản tắc nghẽn là sau nhiễm trùng và 78% trong số đó là sau lao. Đặc điểm X-quang của viêm tiểu phế quản là tình trạng khí cạm được đặc trưng trên chụp cắt lớp vi tính (CT) là các vùng giảm đậm độ (low attenuation area, LAA) trên CT thì thở ra. Đặc điểm X quang này có thể tồn tại sau khi điều trị bệnh lao mặc dù những thay đổi trong nhu mô và nội phế quản đã được giải quyết [62]. Jeong và cs [63] cũng có báo cáo sự liên quan đến đường thở nhỏ ở bệnh nhân nhiễm NTM. Allwood và cs đã có đánh giá trên bệnh nhân lao phổi đã lành và tắc nghẽn luồng khí bằng hình ảnh phổi CT định lượng động và phép đo phế dung, phép đo thể tích và khả năng khuếch tán. Những bệnh nhân bị tắc nghẽn luồng khí mạn tính đã xác định mắc có bệnh lao trước đó có điểm khí cạm, xơ hóa và khí phế thũng cao hơn so với những đối tượng không mắc bệnh lao trước đó. Khả năng khuếch tán cũng thấp hơn đáng kể ở những bệnh nhân đã xác định mắc bệnh lao trước đó [28].
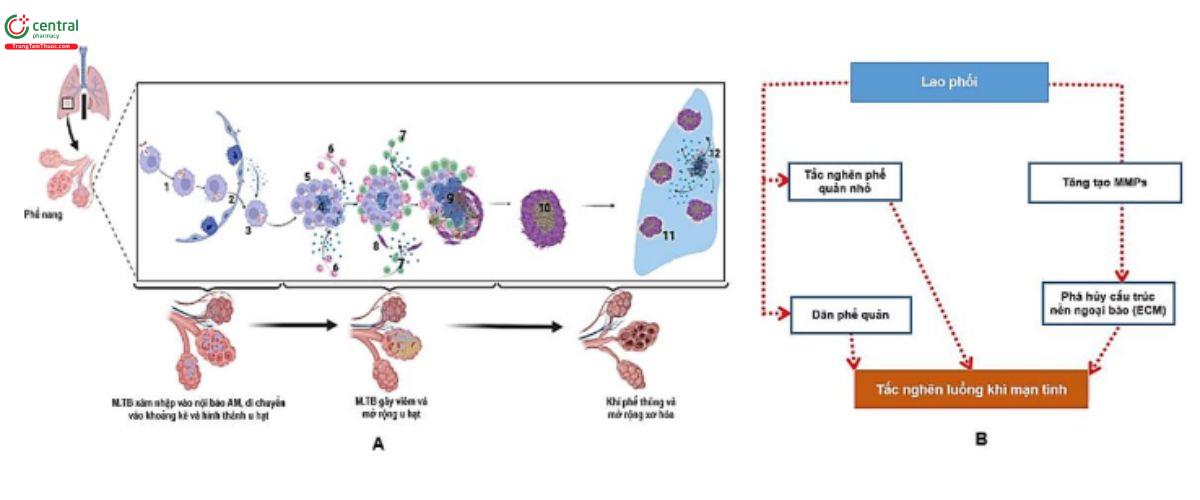
Hình 4. Cơ chế vi thể (A) và sơ đồ hình thành thông khí tắc nghẽn sau lao phổi (Nguồn trích dẫn: A) Kayongo A, Nyiro B, Siddharthan T, Kirenga B, Checkley W, Lutaakome Joloba M, Ellner J and Salgame P (2023) Mechanisms of lung damage in tuberculosis: implications for chronic obstructive pulmonary disease. Front. Cell. Infect. Microbiol. 13:1146571 và B) Malay Sarkar et al. Tuberculosis associated chronic obstructive pulmonary disease. Clin Respir J. 2017;11:285-295).
Giãn phế quản sau lao là di chứng phổ biến của lao phổi ở các nước đang phát triển, đặc biệt ở những bệnh nhân có tiền sử bệnh lao tái phát [64]. Palwatwichai và cs [65] trong một nghiên cứu tiến cứu ở Thái Lan đã tìm thấy tiền sử bệnh lao ở 32% trong số 50 bệnh nhân bị dãn phế quản, khiến tỷ lệ này là nguyên nhân cơ bản cao nhất của bệnh giãn phế quản. Natarajan và cs [66] trong một nghiên cứu tiến cứu từ Tây Ấn Độ đã báo cáo bệnh aspergillosis phế quản phổi dị ứng và di chứng phổi sau lao là nguyên nhân phổ biến nhất được thấy ở 23% mỗi nguyên nhân. Giãn phế quản phát triển do tắc nghẽn nội phế quản hoặc xơ hóa quanh phế quản hoặc tắc nghẽn do các hạch bạch huyết phì đại và là nguyên nhân quan trọng gây tắc nghẽn luồng khí mạn tính [67]. Giãn phế quản trong vùng tổn thương sẹo được gọi là giãn phế quản do co kéo. Bệnh nhân lao cũng có thể bị hẹp phế quản và tắc nghẽn đường thở. Chae và cs [68] đã báo cáo xẹp phổi (84%) và khí phế thũng kèm giãn phế quản (89%) là những phát hiện CT phổ biến nhất ở bệnh nhân bị lao có phá hủy phổi.
Sinh lý bệnh dẫn đến sự phát triển tắc nghẽn đường thở ở bệnh lao có tính chất đa yếu tố [69]. Sự phá hủy nhu mô phổi cũng có thể ảnh hưởng đến độ dãn nở của phổi dẫn đến xu hướng xẹp đường hô hấp ngoại vi tăng lên và sau đó là tạo ra thông khí cạm. Điều này trở nên tồi tệ hơn do những bất thường trong mối quan hệ thông khí-tưới máu. Những thay đổi về nhu mô và đường thở dẫn đến những vùng giảm thông khí nhưng có thể được tưới máu đầy đủ. Ngược lại, nhiễm vi khuẩn mycobacteria có thể gây ra những thay đổi về mạch máu trong phổi dẫn đến tình trạng giảm tưới máu ở những khu vực được thông khí đầy đủ. Do đó, không có gì đáng ngạc nhiên, kết quả cuối cùng của những điều trên là sự suy giảm chức năng phổi và sự phát triển của tắc nghẽn luồng khí dẫn đến trao đổi khí bất thường.
Các con đường miễn dịch có thể thúc đẩy quá trình sinh bệnh miễn dịch của bệnh phổi tắc nghẽn mạn tính liên quan đến bệnh lao và ý nghĩa của chúng trong việc kiểm soát bệnh lao liên quan đến bệnh phổi tắc nghẽn mạn tính (COPD). Trong lao, các phản ứng miễn dịch chủ yếu được đặc trưng bởi sự kích hoạt và di chuyển của các đại thực bào phế nang vào nhu mô phổi, cùng với việc huy động bạch cầu trung tính, đại thực bào có nguồn gốc bạch cầu đơn nhân, tế bào B, tế bào bạch huyết bẩm sinh, Th1, Th17 và tế bào T CD8+ gây độc tế bào vào môi trường phổi. Sự tương tác của chúng với các tế bào biểu mô đường dẫn khí, nguyên bào sợi và chất nền ngoại bào dẫn đến tình trạng viêm kéo dài, hoại tử mô và tái cấu trúc đường thở. Do đó, những thay đổi này dần dần làm tổn hại đến chức năng phổi.
Viêm nhu mô phổi trong bệnh lao có thể dẫn đến phá hủy chất nền ngoại bào phổi (ECM), một đặc điểm tương tự như của COPD [63]. Matrix metallicoproteinase (MMP) là một men thuộc họ endpeptidase [70] chứa Kẽm phụ thuộc Canxi có chức năng điều hòa quá trình tái cấu trúc mô trong bệnh lao [71]. MMP tham gia vào cơ chế bệnh sinh của cả bệnh lao và bệnh phổi tắc nghẽn mạn tính bằng cách phân hủy các thành phần của ECM, khung của thành phế nang. Các MMP khác nhau có vai trò khác nhau trong nhiễm trùng mycobacteria. MMP-9 giúp tạo ra u hạt ổn định, từ đó ngăn chặn sự lây nhiễm trong tổn thương viêm lao. Tuy nhiên, việc tái hoạt động của bệnh lao tiềm ẩn sẽ dẫn đến sự bài tiết MMP-1. MMP-1 gây ra sự phá hủy phế nang và là nguyên nhân tạo hang trong bệnh lao [72]. Finlay và cs [73] đã tìm thấy các đại thực bào phế nang là nguồn cung cấp MMP đáng kể trong phổi bị khí thũng. Họ đã tìm thấy số lượng đáng kể MMP, đặc biệt là MMP-9 trong dịch BAL của bệnh nhân COPD so với những người tình nguyện khỏe mạnh bình thường. Tương tự, Imai và cs tìm thấy biểu hiện tăng MMP-1 trong nhu mô phổi của bệnh nhân COPD so với nhóm chứng bình thường. Chính tế bào phổi loại II tạo ra MMP-1 và tham gia phá hủy phổi [74]. Do đó, MMP là chất trung gian phổ biến có thể kết nối cả hai tình trạng bệnh lý (lao phổi và khí phế thũng phổi). Singh và cs [75] đã nghiên cứu tác động của các chất chống vi khuẩn khác nhau lên mức MMP ở bệnh nhân lao. Mức độ MMP như MMP-1, 2, 3, 7, 8 và 9 tăng cao trong dịch rửa phế quản-phế nang của bệnh nhân lao và cho thấy có mối tương quan với tổn thương mô liên quan đến bệnh lao. Các thuốc kháng vi khuẩn khác nhau, ví dụ như rifampin, moxifloxacin và Azithromycin cho thấy tác dụng điều hòa miễn dịch bằng cách giảm biểu hiện gen tế bào biểu mô và bài tiết MMP.
Có rất ít tài liệu so sánh các đặc điểm lâm sàng và sinh lý của tắc nghẽn đường thở mạn tính (chronic airway obstructive, CAO) thứ phát do lao với đặc điểm được thấy ở bệnh nhân mắc bệnh COPD liên quan đến thuốc lá. Một nghiên cứu của Hàn Quốc đã theo dõi 21 bệnh nhân bị tắc nghẽn đường thở mạn tính thứ phát do bệnh lao cũng như nghiên cứu các đặc điểm lâm sàng và các phép đo chức năng phổi khác nhau [17]. Tất cả các bệnh nhân nhóm tắc nghẽn sau lao đều bị tổn thương nhu mô trên nửa phổi do lao nhưng không có bằng chứng lao đang hoạt động, hiện tại không hút thuốc và có tiền sử hút thuốc dưới 20 gói/năm (trung bình 3,6 gói/năm). Những dữ liệu này được so sánh với nhóm đối chứng gồm 11 bệnh nhân khác được chẩn đoán COPD liên quan đến thuốc lá mà theo xác định đã hút thuốc (trung bình là 44,1 gói/năm) mà không có bằng chứng X-quang về thâm nhiễm phổi. Không có sự khác biệt đáng kể được ghi nhận giữa 2 nhóm về mức độ và tần suất xuất hiện các triệu chứng khó thở và ho mặc dù có xu hướng ho ra máu với tần suất cao hơn ở bệnh nhân tắc nghẽn sau lao. Ngoài ra, cũng không có sự khác biệt đáng kể giữa 2 nhóm về các đợt cấp và nhập viện. Phản ứng với thuốc dãn phế quản cũng được nghiên cứu ở 2 nhóm. Phản ứng dương tính được thấy nhiều hơn ở nhóm COPD liên quan đến thuốc lá so với bệnh nhân tắc nghẽn sau lao (82% so với 27%; p<0,05). FEV1 ở nhóm tắc nghẽn sau lao sau khi hít thuốc giãn phế quản cũng thấp hơn đáng kể so với bệnh nhân COPD (1,15 lít so với 1,37 lít; p<0,05). Trong một nghiên cứu theo dõi bệnh nhân COPD có tiền sử lao vào viện vì đợt cấp COPD cho thấy bệnh nhân COPD có triệu chứng lâm sàng và chức năng hô hấp xấu hơn và tỷ lệ tử vong trước 5 năm sau khi có chẩn đoán COPD cao hơn so với nhóm COPD không có tiền sử lao [76].
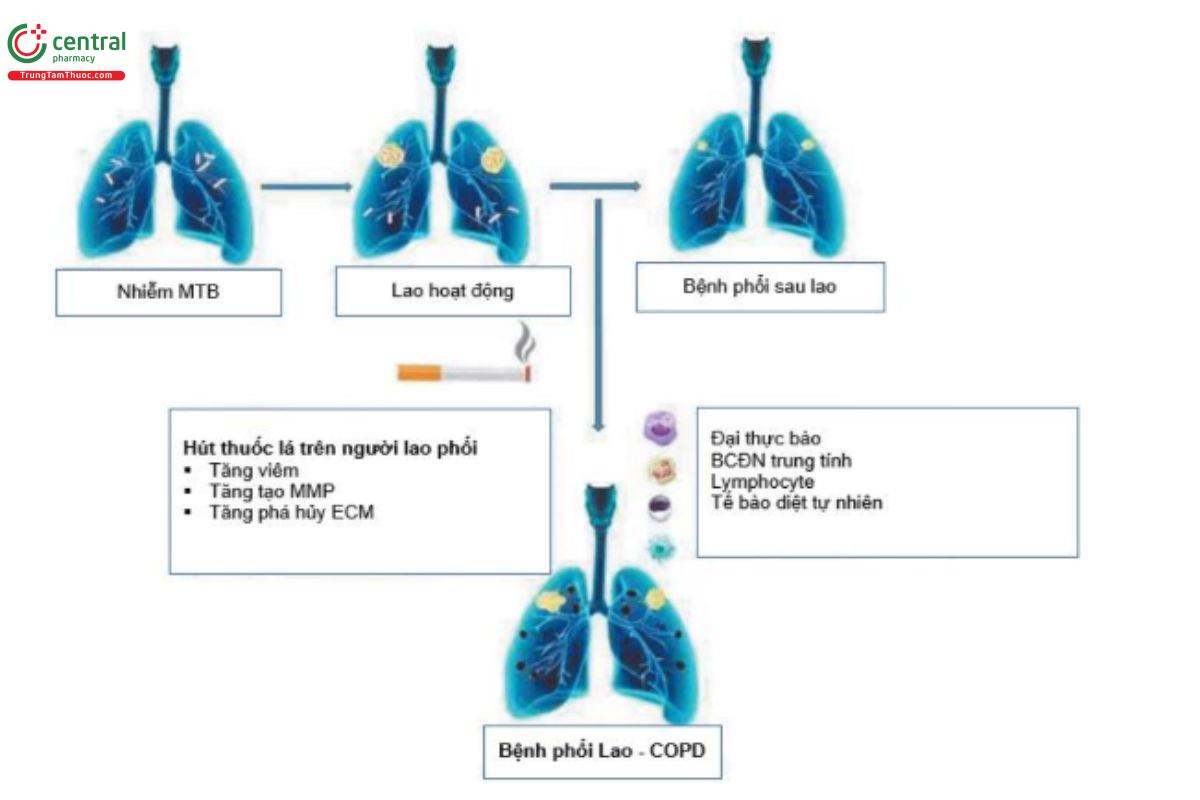
Hình 5. Hình minh họa sự tương tác giữa bệnh phổi sau lao và hút thuốc lá trong COPD liên quan đến bệnh lao (Nguồn trích dẫn: Xiaoyan Gai et al. Post-tuberculosis lung disease and chronic obstructive pulmonary disease. Chinese Medical Journal 2023;136(16).
Trong một tổng quan hệ thống từ các báo cáo quốc gia trên toàn cầu [77](4) để đánh giá mối liên quan giữa tiền sử bệnh lao và sự hiện diện của bệnh phổi tắc nghẽn mạn tính (COPD). Các tác giả cho thấy có mối liên quan đáng kể giữa tiền sử bệnh lao và sự hiện diện của COPD ở người lớn trên 40 tuổi (OR gộp 3,05, CI 95% 2,42 - 3,85). Các tác giả kết luận ở những vùng lưu hành bệnh lao, bệnh lao có liên quan chặt chẽ với sự hiện diện của bệnh hô hấp mạn tính ở người lớn. Đáng lưu ý một nghiên cứu ở Taiwan còn thấy rằng tác động của bệnh lao gia tăng nguy cơ COPD nếu điều trị kháng lao trễ [78].
Tỷ lệ điều trị bệnh lao thành công ngày càng tăng. Tuy nhiên, bệnh lao phổi trước đó có thể đã gây tổn thương giải phẫu vĩnh viễn đối với phổi và có liên quan đến mất chức năng phổi [79]. Không rõ liệu suy giảm chức năng phổi do bệnh lao có liên quan đến tắc nghẽn luồng khí, dấu hiệu đặc trưng của COPD hay không. Một tổng quan hệ thống được công bố vào năm 2013 chỉ tóm tắt nguy cơ mắc COPD ở bệnh nhân lao phổi trước đó nhưng nghiên cứu này không phân tích định lượng [36]. Một tổng quan hệ thống khác được công bố vào năm 2015 đã phân tích định lượng mối quan hệ giữa bệnh lao phổi trước đó và COPD nhưng tổng quan hệ thống này lại bao gồm các nghiên cứu về bệnh dãn phế quản [37]. Từ năm 2015, nhiều nghiên cứu mới đã xem xét mối liên quan giữa lao phổi và COPD. Huanhuan Fan và cs trong một tổng quan hệ thống và phân tích gộp mối liên hệ dịch tễ học và mức độ liên quan giữa COPD với tiền sử có bệnh lao phổi trước đó vào năm 2021 [49b] đã kết luận rằng những người mắc bệnh lao phổi trước đó có nguy cơ và tỷ lệ mắc bệnh COPD cao hơn. Tuy nhiên các cơ chế giải thích hiện tượng kết hợp dịch tễ này vẫn cần được nghiên cứu thêm.
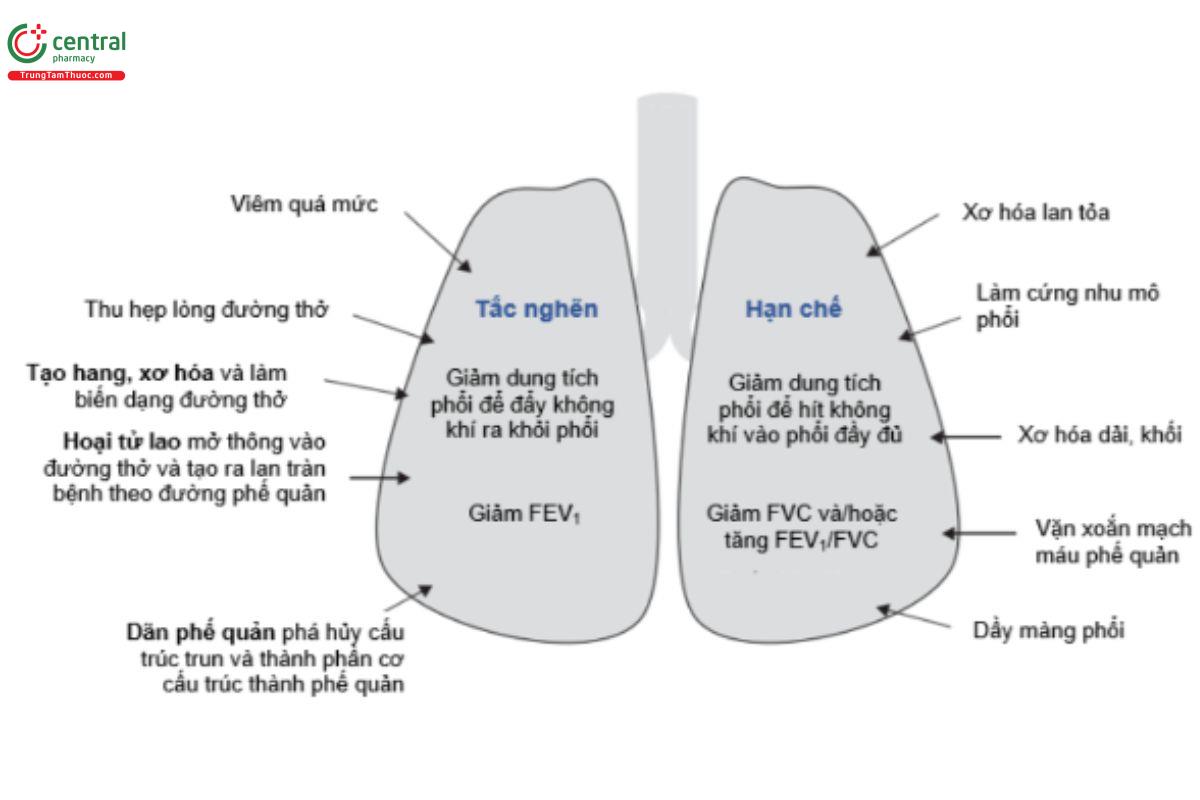
Hình 6. Hình mô tả cơ chế làm suy giảm chức năng hô hấp sau lao (Nguồn trích dẫn: Ravimohan S, Kornfeld H, Weissman D, et al. Tuberculosis and lung damage: from epidemiology to pathophysiology. Eur Respir Rev 2018; 27: 170077)
2.2 Nguy cơ hút thuốc lá, COPD với lao phổi
Bệnh phổi tắc nghẽn mạn tính (COPD) là một thuật ngữ chung cho nhiều thực thể lâm sàng khác nhau và tình trạng tắc nghẽn luồng khí không thể hồi phục hoàn toàn vì nhiều lý do [80]. Yếu tố nguy cơ thông thường nhất đối với COPD là hút thuốc, nhưng hút thuốc chắc chắn không phải là yếu tố duy nhất [81]. Hơn 90% tỷ lệ mắc bệnh và tử vong liên quan đến COPD xảy ra ở các quốc gia có thu nhập thấp và trung bình, nơi một tỷ lệ đáng kể những người mắc COPD không bao giờ hút thuốc [82,83]. Vì vậy, sự hiểu biết hiện tại về các yếu tố nguy cơ của COPD vẫn chưa đầy đủ ở nhiều khía cạnh.
Hút thuốc lá là yếu tố chính trong sự phát triển của COPD. Mối liên quan giữa hút thuốc lá, mất chức năng phổi nhanh và COPD đã được xác định rõ ràng. Hút thuốc lá cũng làm tăng nguy cơ phát triển bệnh lao lên gấp 3-5 lần [84,85]. Bệnh lao ở người hút thuốc diễn biến nặng hơn với tổn thương lan tỏa nhiều hơn, tạo khoang đóng ít hơn [11]. Trong một nghiên cứu gần đây ở Đài Loan trên một mẫu lớn gồm 5.567 bệnh nhân lao các tác giả đã nhận thấy rằng hút thuốc lá làm tăng gấp đôi nguy cơ bệnh lao tái phát [86]. Hút thuốc, lao và COPD đều gây tổn hại cho cấu trúc phổi và điều này hiển nhiên tác động tới chức năng hô hấp. Hút thuốc ngăn chặn phản ứng miễn dịch bẩm sinh và thu được cùng với giảm nồng độ của các cytokine tiền viêm và globulin miễn dịch lưu hành, đồng thời làm giảm hoạt động của đại thực bào phế nang, tế bào đuôi gai và tế bào diệt tự nhiên [87,88].
Có một số bằng chứng chỉ ra sự phổ biến của bệnh lao phổi, bệnh phổi nặng hơn và có liên quan tổn thương ở vùng trên (upper-zone) phổi trên những người hút thuốc lá [12,89], tất cả đều tương thích với một tác động cụ thể tại chỗ của khói thuốc lá hít vào. Mặc dù các cơ chế được đưa ra là rất hợp lý, nhưng cần phải kiểm tra xem liệu các mối liên hệ quan sát thấy có thể là do sai lệch và gây nhiễu hay không. Ví dụ, việc sử dụng rượu và tình trạng kinh tế xã hội có thể làm xáo trộn mối liên hệ giữa thuốc lá và bệnh lao. Các nghiên cứu được công bố đã kiểm soát độ lệch và nhiễu ở các mức độ khác nhau và, mặc dù vậy, các nghiên cứu sau khi đã hiệu chỉnh nhiễu vẫn thấy những tác động đáng kể trong mối liên hệ lao-thuốc lá. Tuy nhiên, ít nhất đã có một số tác động quan sát được có thể được giải thích bằng hiện tượng gây nhiễu, và các nghiên cứu trong tương lai sẽ cần phải kiểm soát tất cả các yếu tố gây nhiễu chính để xác định được các cơ chế tạo điều kiện thuận lợi tới sự hình thành, phát triển của bệnh lao liên quan đến thuốc lá [88]. Trên bệnh nhân COPD có tổn thương lao cũ trên X-quang (latent tuberculosis features) ngoài triệu chứng và chức năng hô hấp xấu hơn, một nghiên cứu [90] còn cho thấy CRP cũng tăng cao hơn và Albumin huyết thanh, Sắt huyết thanh thấp hơn so với nhóm COPD không có tổn thương cũ.
Các cơ chế làm cơ sở cho mối liên hệ giữa hút thuốc và bệnh lao vẫn chưa rõ ràng, mặc dù các con đường giả định đã được đề xuất [89,91]. Một lượng lớn bằng chứng khoa học cho thấy rằng đại thực bào, tế bào T CD4, quá trình tự hủy của các tế bào bị nhiễm bệnh, IFN-γ, IL-12 và TNF-α rất cần thiết cho khả năng miễn dịch của cơ thể chủ đối với bệnh lao ở người [92]. Khói thuốc lá ức chế việc sản xuất TNF-α bởi các đại thực bào trong phổi thông qua tương tác với các thụ thể acetylcholine α7 nicotinic [93] và nicotin tăng cường sự nhân lên của các vi sinh nội bào và điều hòa giảm chọn lọc việc sản xuất IL-12 và TNF-α [94]. Khói thuốc lá ngăn cản sự mở rộng và kích hoạt đặc hiệu tế bào T CD4 đối với tác nhân vi sinh gây bệnh [95] và làm giảm số lượng tế bào T CD4 và CD8 đặc hiệu adenoid sản xuất IFN-γ [96]. Hiện tại đã có bằng chứng cho thấy khói thuốc điều chỉnh nhiều chức năng quan trọng của đại thực bào [97]. Các cơ chế tiềm ẩn khác mà việc hút thuốc có thể làm giảm hoạt động diệt khuẩn mycobacterium bao gồm stress oxy hóa trong các mô phổi và rối loạn cơ học hoạt động chức năng lông chuyển và các cơ chế thanh thải khác trên đường thở [59].
Hiện nay đã có bằng chứng đáng kể cho thấy hút thuốc lá có liên quan đến bệnh lao. Bằng chứng mạnh mẽ về bệnh lao nhưng lại ít mạnh mẽ hơn về nhiễm trùng lao (TB infection) và tỷ lệ tử vong do lao. Mặc dù hiệu quả khá nhất quán giữa các nghiên cứu nhưng nguy cơ ước tính cho thấy mối liên quan này là khiêm tốn. Tuy nhiên, tác động của bất kỳ yếu tố rủi ro nào đều được xác định bởi mức độ liên quan (tức là RR) và mức độ phổ biến của phơi nhiễm trong dân số. Do đó, ngay cả khi tác động thực sự còn khiêm tốn thì rủi ro cho dân số quy thuộc (population attributable) vẫn có thể rất lớn do tính chất phổ biến của việc phơi nhiễm với thuốc lá và nhất là ở các vùng có dịch tễ lao cao. Ví dụ, nếu RR của bệnh lao chỉ là 1,5, với 30% dân số tiếp xúc với khói thuốc lá, tỷ lệ rủi ro do dân số quy thuộc sẽ là khoảng 15%. Nói cách khác, 15% số ca mắc bệnh lao trên thế giới mỗi năm có thể là do phơi nhiễm thuốc lá. Trên thực tế, tác động có thể lớn hơn vì các cách ước tính nguy cơ nhiễm lao, bệnh tật và tử vong không độc lập [59]. Nếu hút thuốc lá làm tăng nguy cơ nhiễm lao, điều này sẽ làm tăng tỷ lệ người hút thuốc bị nhiễm lao và có nguy cơ mắc bệnh lao. Do đó, nếu hút thuốc làm tăng nguy cơ mắc bệnh lao ở những người đã nhiễm bệnh, điều này sẽ làm tăng số người hút thuốc có nguy cơ tử vong do bệnh lao. Do đó, tác động tổng thể của việc hút thuốc đối với bệnh lao có thể là đáng kể, ngay cả khi chưa xem xét đến tác động của hút thuốc thụ động. Mặc dù các đánh giá được công bố chủ yếu tập trung vào hút thuốc lá chủ động, kết quả cũng có thể áp dụng cho hút thuốc thụ động và ô nhiễm không khí trong nhà, mặc dù tác động có thể nhỏ hơn [98].
Bệnh nhân COPD có nguy cơ mắc bệnh lao cao hơn. Inghammar và cs [99] đã nghiên cứu tác động của COPD lên tỷ lệ mắc và tử vong do bệnh lao. Trên 115.867 bệnh nhân trên 40 tuổi xuất viện tại bệnh viện Thụy Điển với chẩn đoán COPD được đánh giá nguy cơ mắc bệnh lao. Nguy cơ phát triển bệnh lao ở bệnh nhân COPD cao gấp 3 lần so với nhóm chứng và tỷ lệ mắc bệnh lao có tương quan nghịch với giá trị FEV1. Ngoài ra, nguy cơ tử vong do mọi nguyên nhân cao gấp 2 lần trong năm đầu tiên sau khi chẩn đoán lao phổi hoạt động trên bệnh nhân COPD so với dân số mắc bệnh lao nói chung. Lee và cs [6] đã nghiên cứu các yếu tố nguy cơ mắc bệnh lao phổi ở bệnh nhân COPD. Trong số 23.594 trường hợp COPD và 47.188 đối tượng không bị COPD, phân tích hồi quy cho thấy COPD là yếu tố nguy cơ độc lập đối với bệnh lao với tỷ lệ nguy cơ là 2,47. Bệnh nhân COPD mắc bệnh lao được dùng nhiều corticosteroid đường uống và thuốc chủ vận beta đường uống hơn. Việc sử dụng corticosteroid dạng hít cũng có liên quan đến nguy cơ mắc bệnh lao cao hơn và nguy cơ cao hơn khi sử dụng corticosteroid dạng hít liều cao tương đương với Fluticasone 1.000 mg/ngày trở lên [100]. Do đó, ở các quốc gia lưu hành bệnh lao, cần bắt buộc phải loại trừ nhiễm trùng/bệnh lao trước khi sử dụng corticosteroid dạng hít liều cao [101]. Corticosteroid làm tăng nguy cơ mắc bệnh lao bằng cách gây ức chế miễn dịch [102]. Shang và cs [103] đã nghiên cứu phản ứng miễn dịch đối với M. tuberculosis ở chuột tiếp xúc với khói thuốc lá. Các đại thực bào và các tế bào đuôi gai giải phóng IL-12 và TNF-a ở mức độ thấp hơn ở những con chuột tiếp xúc với khói thuốc lá (hình 7). Do đó, việc tiếp xúc với khói thuốc lá sẽ làm thay đổi phản ứng miễn dịch bảo vệ đối với M. tuberculosis. Tình trạng suy giảm miễn dịch ở bệnh nhân lao phổi kết hợp COPD nặng hơn so với từng bệnh riêng lẻ lao phổi hay COPD [104]. Tang và cs [104] đã định lượng các cytokine khác nhau trong máu ngoại vi của 152 trường hợp mắc bệnh lao phổi - COPD kết hợp, 150 trường hợp bệnh nhân lao phổi, 157 bệnh nhân COPD và 50 trường hợp tình nguyện viên khỏe mạnh. Bệnh nhân lao - COPD kết hợp có tỷ lệ tế bào T CD4 + thấp hơn đáng kể so với bệnh nhân lao không COPD. Bệnh nhân lao có tỷ lệ tế bào T CD8+ cao hơn đáng kể so với nhóm đối chứng. Nồng độ các cytokine như sIL-2R, IL-6, TNF-α, IFN-ϒ ở bệnh nhân COPD mắc bệnh lao cao hơn đáng kể so với bệnh nhân COPD không mắc bệnh lao. Mức độ cao của các cytokine này, bằng cách tạo ra phản ứng viêm mạnh, có thể gây ra sự tiến triển của bệnh lao ở bệnh nhân COPD. Bản thân bệnh nhân COPD phát triển rối loạn chức năng của đại thực bào phế nang không phụ thuộc vào steroid, điều này cũng gây thêm nguy cơ mắc bệnh lao [105,106]. Đại thực bào là một trong những tế bào quan trọng trong bệnh lao và cũng đóng vai trò trong việc chữa lành và hồi phục tổn thương [107]. Các tế bào này có thể gây ra sự tái cấu trúc (remodelling) đường thở. Mycobacteria trong phổi có thể dẫn đến việc kích hoạt không kiểm soát được các đại thực bào chữa lành vết thương, dẫn đến việc tái cấu trúc đường thở và phát triển tình trạng tắc nghẽn luồng khí mạn tính [108].

Hình 7. Giảm đáp ứng miễn dịch tế bào trong phối hợp lao/COPD (Nguồn trích dẫn: Tang S, Cui H, Yao L, Hao X, Shen Y, et al. (2013) Increased Cytokines Response in Patients with Tuberculosis Complicated with Chronic Obstructive Pulmonary Disease. PLoS ONE 8(4): e62385)
Trong một nghiên cứu đoàn hệ cộng đồng thực hiện trên 115.876 bệnh nhân >40 ở Thụy Điển [99] tuổi ghi nhận bệnh nhân COPD có nguy cơ (HR) phát triển bệnh lao hoạt động tăng gấp ba lần (HR= 3.0, CI 95% 2,4-4,0). Hơn nữa, ước tính hồi quy logistic cho thấy bệnh nhân COPD phát triển bệnh lao hoạt động có nguy cơ tử vong do mọi nguyên nhân tăng gấp hai lần trong năm đầu tiên (OR=2,2, CI95% 1,2-4,1). Phân tích hồi quy từ nghiên cứu của của Lee và cs [6] như đã trích dẫn ở trên cho thấy tuổi tác, giới tính nam, đái tháo đường, bệnh thận giai đoạn cuối và xơ gan cũng như COPD (HR 2,468, CI 95% 2,205-2,762) là các yếu tố nguy cơ độc lập đối với bệnh lao. Trong số các trường hợp mắc bệnh COPD, những người mắc bệnh lao được dùng nhiều corticosteroid đường uống và thuốc chủ vận beta đường uống hơn. Trong nghiên cứu này các tác giả không thấy xuất hiện nguy cơ bệnh lao có liên quan tới ICS (HR=1,01; CI 95% 0,99-1,03; p=0,245).
Từ góc độ kinh tế-xã hội, trong một tổng quan hệ thống cho thấy có ba nghiên cứu đoàn hệ đã báo cáo có mối liên quan độc lập có ý nghĩa thống kê giữa COPD và nguy cơ mắc bệnh lao ở các quốc gia có thu nhập cao (n=711.389) với HR dao động từ 1,44 đến 3,14 sau hiệu chỉnh với nhiều yếu tố gây nhiễu, bao gồm tuổi tác, giới tính và bệnh đi kèm.
Câu hỏi quan trọng luôn được quan tâm rằng liệu ICS kéo dài trong COPD có là nguy cơ làm cho lao phổi xuất hiện hay diễn biến xấu đi hay không. Một phân tích gộp gần đây [109] xem xét trên 36.351 bệnh nhân COPD có sử dụng ICS và 147.171 bệnh nhân không sử dụng cho thấy bất kỳ loại ICS nào cũng đều có liên quan đến việc tăng nguy cơ mắc bệnh lao so với việc không sử dụng ICS (OR=1,46; 95% CI 1,06 đến 2,01; p=0,02; I2=96%). Kết quả tương tự cũng được nhận thấy giữa việc sử dụng ICS hiện tại so với trước đây / không sử dụng ICS, cũng như đối với liều ICS (cao, trung bình và thấp) so với không sử dụng ICS. Kết quả tương tự cũng được tìm thấy khi đánh giá việc sử dụng OCS đồng thời, sự đóng góp độc lập của ICS chỉ được xác nhận ở những bệnh nhân không dùng OCS (OR=1,63; 95% CI 1,05 đến 2,52; p=0,03; I2=94%). Tuy nhiên, các tác giả của phân tích này cũng nhìn nhận rằng còn thiếu đánh giá tác động của những yếu tố khác có thể thúc đẩy hình thành lao phổi, nhất là trên những người có lao phổi tiềm ẩn. (Hình 8). Hơn nữa, tác động này không cho thấy rõ mối liên quan của hút thuốc lá đối với sự xuất hiện của bệnh lao.
Trong một phân tích gộp khác, Songshi Ni và cs năm 2013 [110] đã phân tích từ năm nghiên cứu liên quan đến 4.851 trường hợp và 28.477 trường hợp đối chứng khi xem xét mối liên quan nguy cơ nhiễm mycobacteria trên những trường hợp có bệnh hô hấp mạn tính có điều trị ICS hoặc không. Các tác giả cho thấy có mối liên quan có ý nghĩa giữa điều trị ICS và nguy cơ nhiễm vi khuẩn mycobacteria (RR=1,81; CI 95% 1,23-2,68; P=0,003). Trong đó nguy cơ mắc lao trên bệnh nhân sử dụng ICS cũng có ý nghĩa (RR = 1,34; CI 95% 1,15-1,55; P=0,0001). Phân tích dưới nhóm đối với bệnh nhân COPD cũng cho thấy có mối liên quan có ý nghĩa giữa điều trị ICS và xuất hiện lao phổi (RR = 1,42; 95% CI, 1,18-1,72; P=0,0003). Việc sử dụng ICS làm tăng nguy cơ mắc bệnh lao ở những bệnh nhân mắc bệnh hô hấp mạn tính, trong đó có COPD. Nhận định này cũng tương tự như một phân tích gộp trước đó năm 2007 [59] đánh giá tác động của hút thuốc lá đối với nguy cơ lao phổi cho rằng hút thuốc lá có tác động làm tăng nguy cơ đối với cả nhiễm lao và bệnh lao. Nguy cơ phát triển lao (RR) là 1,4-1,7 trên cộng đồng người bị nhiễm lao.
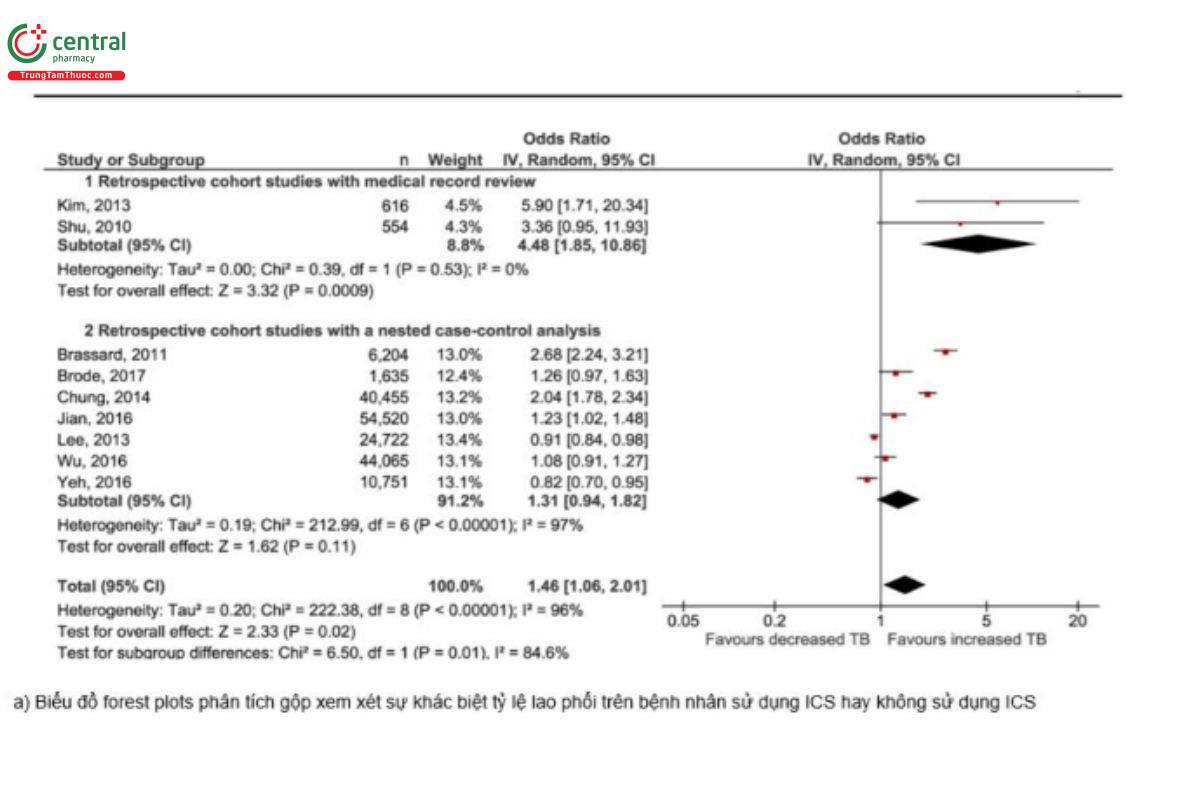
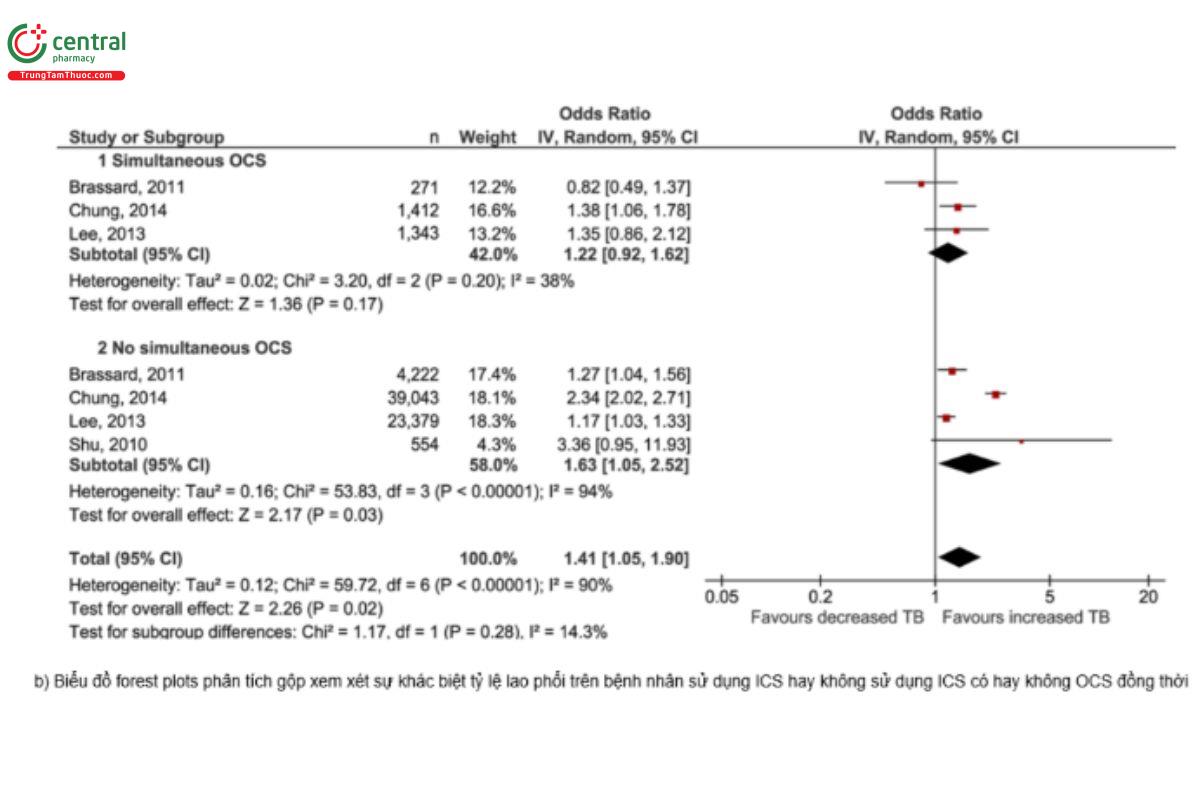
Hình 8. Tổng quan hệ thống và phân tích gộp tác động của ICS và xuất hiện lao phổi trên bệnh nhân COPD sử dụng corticosteroid (Nguồn trích dẫn: Giorgio Castellana et al. Inhaled Corticosteroids And Risk Of Tuberculosis In Patients With Obstructive Lung Diseases: A Systematic Review And Meta-Analysis Of Non-randomized Studies. International Journal of Chronic Obstructive Pulmonary Disease 2019:14 2219-2227)
Tác động của hút thuốc lá đối với kết cục điều trị lao phổi đã được xem xét trong một tổng quan hệ thống và phân tích gộp gần đây, năm 2020 [111]. Các tác giả thông báo trong số 22 nghiên cứu được đưa vào phân tích định tính, 12 nghiên cứu báo cáo giá trị p <0,05 trong đó việc hút thuốc làm tăng đáng kể kết quả điều trị kém. 10 nghiên cứu còn lại báo cáo giá trị p>0,05 ngụ ý rằng hút thuốc không ảnh hưởng đến kết quả điều trị. Nhưng khi phân tích gộp, cho thấy hút thuốc làm tăng đáng kể khả năng điều trị bệnh lao kém, lên tới 51% (OR = 1,51; 95% CI 1,30 - 1,75 và I2= 75,1%). Bên cạnh đó, một nghiên cứu đoàn hệ còn cho thấy tần suất đợt cấp, số đợt cấp nặng, tần suất nhập viện và số ca tử vong ở bệnh nhân bệnh phổi tắc nghẽn sau lao cao hơn so với COPD [44].
2.3 Liên quan tới điều trị tình trạng tắc nghẽn luồng khí mạn tính, COPD sau lao
Tổng quan các tài liệu hướng dẫn cho thấy các hướng dẫn không đề cập cụ thể về điều trị các bệnh mạn tính trong đó có COPD sau lao [112]. Chiến lược Chấm dứt bệnh lao của WHO và các Mục tiêu Phát triển Bền vững vẫn chỉ tập trung vào việc giảm tỷ lệ mắc bệnh lao và tỷ lệ tử vong do bệnh lao mà không đề cập đến các bệnh phổi mạn tính sau lao [113,114].
Chẩn đoán sớm và điều trị tích cực lao phổi để giảm thiểu phá hủy phổi và để lại di chứng là yêu cầu cơ bản. Bên cạnh đó, hút thuốc lá đã được chứng minh là có tác động xấu tới kết cục diễn biến lao phổi và rõ ràng đây là yếu tố đồng vận cùng với viêm lao hình thành nên tình trạng nghẽn luồng khí về sau. Do vậy yêu cầu ngưng thuốc lá là rất cần thiết khi chẩn đoán lao phổi.
Tài liệu GOLD (năm 2024) cũng cho rằng có bằng chứng điều trị ICS trong COPD là nguy cơ đối với lao phổi. Mặc dù không có bằng chứng từ các nghiên cứu RCT nên không thể rút ra được kết luận chắc chắn [115] nhưng những gì chúng ta đã biết và đã có bằng chứng cho thấy cần chỉ định thận trọng và theo dõi lao phổi trên những người sử dụng ICS kéo dài, nhất là khi đã có tiền sử lao phổi. GOLD 2024 đề nghị không (against use) sử dụng ICS trên người có tiền sử nhiễm mycobacterium (history of mycobacterium infection) và không khuyến cáo OCS vì nguy cơ tác dụng phụ là lớn hơn so với lợi ích.
Điều trị bện hphổi tắc nghẽn sau lao không có gì khác biệt so với điều trị COPD đơn thuần. Yum và cs [116] đã nghiên cứu hiệu quả của Tiotropium bromide dạng hít trong thời gian 2 tháng trên 29 bệnh nhân bị lao phổi có phá hủy nhu mô phổi. Có sự cải thiện đáng kể về giá trị FEV1 và FVC so với giá trị đầu vào khi điều trị bằng tiotropium. Lee và cs [17] phát hiện ra rằng những bệnh nhân tắc nghẽn luồng khí mạn tính do phổi bị phá hủy sau lao có biểu hiện thở khò khè cho thấy phản ứng với dãn phế quản tốt hơn. Bất chấp tất cả những kết quả này, điều đáng chú ý là việc điều trị COPD không thay đổi tùy thuộc vào các yếu tố căn nguyên sinh bệnh.
3 KẾT LUẬN
Tóm lại, chúng ta đã có những hiểu biết về các con đường miễn dịch có thể thúc đẩy quá trình sinh bệnh của bệnh COPD liên quan đến bệnh lao và ý nghĩa của chúng trong việc kiểm soát bệnh phổi liên quan đến bệnh lao. Các phản ứng miễn dịch chủ yếu được đặc trưng bởi sự kích hoạt và di chuyển của các đại thực bào phế nang vào nhu mô phổi, cùng với việc huy động bạch cầu trung tính, đại thực bào có nguồn gốc bạch cầu đơn nhân, tế bào B, tế bào bạch huyết bẩm sinh, Th1, Th17 và tế bào T CD8+ gây độc tế bào vào môi trường phổi. Sự tương tác của chúng với các tế bào biểu mô đường dẫn khí, nguyên bào sợi và chất nền ngoại bào dẫn đến tình trạng viêm kéo dài, hoại tử mô và tái cấu trúc đường thở. Những thay đổi này dần dần làm tổn hại đến chức năng phổi. Nghiên cứu của Agarwal và cs [13] cũng như các nghiên cứu dịch tễ chỉ cho thấy một mặt của mối liên hệ này. Cần có nghiên cứu sâu hơn về sự tương tác phức tạp giữa hai bệnh lý này để xác định biểu hiện lâm sàng chính xác, diễn biến tiếp theo của bệnh lao ở bệnh nhân COPD và COPD ở bệnh nhân lao ảnh hưởng xấu đến sự tiến triển của bệnh, tỷ lệ mắc bệnh và tử vong như thế nào.
Mặc dù vậy, các yếu tố rủi ro liên quan đến suy phổi sau lao (thuật ngữ bao gồm cả ý niệm về giải phẫu và chức năng (pulmonary impairment after TB, PIAT) còn chưa được làm sáng tỏ đầy đủ và các mối quan hệ có thể phức tạp. Có ý kiến cho rằng hút thuốc lá, một yếu tố nguy cơ đã được xác định đối với COPD, có thể góp phần gây ra PIAT [19]. Tuy nhiên, một số báo cáo không tìm thấy mối liên hệ nào như vậy [117-119]. Ví dụ, trong một nghiên cứu, những người có tiền sử bệnh lao có khả năng hút thuốc lá cao gấp đôi so với những người trong nhóm không mắc bệnh lao. Tuy nhiên, theo thời gian, rối loạn chức năng phổi nhiều hơn ở nhóm mắc bệnh lao mà không phụ thuộc vào việc hút thuốc trong một phân tích đa biến [117]. Sự thiếu liên quan tương tự giữa hút thuốc và suy giảm chức năng phổi cũng được quan sát thấy ở những bệnh nhân hoàn thành điều trị lao ở Indonesia [118,119]. Đồng nhiễm HIV (một tình trạng nhiễm trùng kết hợp với lao khá phổ biến) có thể là một yếu tố nguy cơ bổ sung làm suy giảm chức năng phổi. Một số nghiên cứu cũng đã chỉ ra rằng bệnh nhân nhiễm HIV có nguy cơ bị suy giảm trao đổi khí cũng như tắc nghẽn đường thở [25,120,121]. Tuy nhiên, dữ liệu còn ít và mâu thuẫn về chức năng phổi ở bệnh nhân đồng nhiễm HIV/TB [19]. Bên cạnh đó, các biến chứng về giải phẫu và chức năng sau lao phổi (PIAT) là khá đa dạng (thí dụ như di chứng lao không xác định, nhiễm aspergillosis, hẹp phế quản hoặc dãn phế quản…) làm giảm chức năng hô hấp ngay cả khi bệnh nhân không hút thuốc. Bản thân các tổn thương di chứng lao cũng có thể là cơ sở làm xuất hiện nhiễm trùng thứ phát tái diễn và từ đó gây ra suy giảm chức năng phổi.
Bệnh lao nên được xem xét ở bệnh nhân mắc COPD trong quá trình chẩn đoán và điều trị và COPD có thể là hậu quả của bệnh lao ngay cả khi không có bất kỳ yếu tố nguy cơ nào khác. Lao liên quan đến COPD thường kết hợp với có các đợt cấp thường xuyên, xét nghiệm chức năng phổi xấu đi và khởi phát COPD sớm hơn so với bệnh nhân mắc COPD do các yếu tố nguy cơ khác. Những lưu ý của GOLD (GOLD 2024) [115] như đã nói ở trên là rất đáng quan tâm.
4 Tài liệu tham khảo
1. India/Institute for Health Metrics and Evaluation. Available from: http:// www.Health.Org>India. [Last seen on 2017 Jun 21].
2. Snider GL, Doctor L, Demas TA, Shaw AR. Obstructive airway disease in patients with treated pulmonary tuberculosis. Am Rev Respir Dis 1971;103:625 40.
3. Jain NK, Thakkar MS, Jain N, Rohan KA, Sharma M. Chronic obstructive pulmonary disease: Does gender really matter? Lung India 2011;28:258 62.
4. Verma SK, Kumar S, Narayan K, Sodhi R. Post tubercular obstructive airway impairment. Indian J Allergy Asthma Immunol 2009;23:95 9.
5. Zakaria M, Moussa H. Chronic obstructive pulmonary disease in treated pulmonary tuberculosis patients. Egypt J Bronchol 2015;9:10 3
6. Lee CH, Lee MC, Star CC, Lim CS, Wang JY, Lee LN, et al. Risk factors for pulmonary tuberculosis in patients with chronic obstructive airway disease in Taiwan: A nationwide cohort study. BMC Infect Dis 2013;13:194 6.
7. Aktogu S, Yorgancioglu A, Cirak K, Köse T, Dereli SM. Clinical spectrum of pulmonary and pleural tuberculosis: A report of 5,480 cases. Eur Respir J 1996;9:2031 5.
8. Didilescu C, Ibraim E, Plopeanu D. A study of the risk factors for relapse in pulmonary tuberculosis patients and the results of the re treatment. Pneumologia 2000;49:247 52.
9. Wang JY, Lee LN, Hsueh PR. Factors changing the manifestation of pulmonary tuberculosis. Int J Tuberc Lung Dis 2005;9:777 83.
10. Yakar HI, Gunen H, Pehlivan E, Aydogan S. The role of tuberculosis in COPD. Int J Chron Obstruct Pulmon Dis 2017;12:323 9.
11. Shprykov AS, Zhadnov VZ. Effects of tobacco smoking on the course of infiltrative pulmonary tuberculosis and effectiveness of its treatment. Probl Tuberk 1994;5;26-7.
12. Leung CC, Yew WW, Chan CK, Tam CM, Lam CW, Chang KC, et al. Smoking and tuberculosis in Hong Kong. Int J Tuberc Lung Dis 2003;7:980 6
13. Agarwal D, Gupta A, Janmeja AK, Bhardwaj M. Evaluation of tuberculosis associated chronic obstructive pulmonary disease at a tertiary care hospital: A case control study. Lung India 2017; 34;415-9.
14. Menezes AM, Hallal PC, Perez Padilla R, Jardim JR, Muiño A, Lopez MV, et al. Tuberculosis and airflow obstruction: Evidence from the PLATINO study in Latin America. Eur Respir J 2007;30:1180 5.
15. NV Thanh et al. Patient characteristics and short-term effectiveness of short-acting brochodilator combination of salbutamol/ipratropium in patients with COPD: Across-sectional multicenter study in Vietnam. Vietnam medical journal. Vol 532, no. 2/2023. 21-27
16. Caballero A, Torres Duque CA, Jaramillo C, Bolívar F, Sanabria F, Osorio P, et al. Prevalence of COPD in five Colombian cities situated at low, medium, and high altitude (PREPOCOL study). Chest 2008;133:343 9
17. Lee JH, Chang JH. Lung function in patients with chronic airflow obstruction due to tuberculous destroyed lung. Respir Med 2003;97:1237 42
18. Birath G, Caro J, Malmberg R, Simonsson BG. Airways obstruction in pulmonary tuberculosis. Scand J Respir Dis 1966;47:27 36.
19. Hnizdo E, Singh T, Churchyard G. Chronic pulmonary function impairment caused by initial and recurrent pulmonary tuberculosis following treatment. Thorax 2000;55:32 8.
20. WHO Vietnam. https://www.who.int/vietnam/vietnam/health-topic/copd
21. Nguyen HV, Tiemersma EW, Nguyen HB, Cobelens FGJ, Finlay A, Glaziou P, et al. (2020) The second national tuberculosis prevalence survey in Vietnam. PLoS ONE 15(4): e0232142. https://doi. org/10.1371/journal.pone.0232142
22. World Health Organization. Chronic obstructive pulmonary disease (COPD). Fact Sheet 2016. http://www.who.int/mediacentre/fact-sheets
23. Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2095–2128.
24. WHO. Global tuberculosis report 2015. Geneva: World Health Organization; 2015. http://apps.who.int/iris/bitstream/10665/ 191102/1/9789241565059_eng.pdf?ua51
25. van Zyl Smit RN, Pai M, Yew WW, et al. Global lung health: the colliding epidemics of tuberculosis, tobacco smoking, HIV and COPD. Eur Respir J. 2010;35(1):27–33.
26. Zeng G, Sun B, Zhong N. Non-smoking-related chronic obstructive pulmonary disease: a neglected entity? Respirology. 2012;17:908–912
27. Salvi SS, Barnes PJ. Chronic obstructive pulmonary disease in non-smokers. Lancet. 2009;374:733–743.
28. Allwood BW, Gillespie R, Galperin-Aizenberg M, et al. Mechanism of airflow obstruction in tuberculosis associated obstructive pulmonary disease (TOPD). Am J Respir Crit Care Med. 2014;189:A5832
29. Chakrabarti B, Calverley PM, Davies PD. Tuberculosis and its incidence, special nature and relationship with chronic obstructive pulmonary disease. Int J Chron Obstruct Pulm Dis. 2007;2 (3):263–272
30. Gaensler EA, Lindgren I. Chronic bronchitis as an etiologic factor in obstructive emphysema: preliminary report. Amer Rev Resp Dis. 1959;80:185
31. Sinder GL, Doctor L, Demas TA. Obstructive airway disease in patients with treated pulmonary tuberculosis. Am Rev Resp Dis. 1971;103:625–640.
32. Anno H, Tomashefski JF. Studies on the impairment of respiratory function in pulmonary tuberculosis. Am Rev Tuberc. 1955; 71:333–348.
33. Lam KB, Jiang CQ, Jordan RE, et al. Prior TB, smoking, and airflow obstruction: a cross-sectional analysis of the Guangzhou Biobank cohort study. Chest. 2010;137:593–600
34. Lee SW, Kim YS, Kim DS, Oh YM, Lee SD. The risk of obstructive lung disease by previous pulmonary tuberculosis in a country with intermediate burden of tuberculosis. J Korean Med Sci. 2011;26:268–273.
35. Gunen H, Yakar H. The role of TB in COPD. Chest. 2016; 150:856A.
36. Allwood BW, Myer L, Bateman ED. A systematic review of the association between pulmonary tuberculosis and the development of chronic airflow obstruction in adults. Respiration. 2013;86(1):76–85.
37. Byrne AL, Marais BJ, Mitnick CD, Lecca L, Marks GB. Tuberculosis and chronic respiratory disease: a systematic review. Int J Infect Dis. 2015;32:138–146
38. Ehrlich RI, White N, Norman R, et al. Predictors of chronic bronchitis in South Africa adults. Int J Tuberc Lung Dis. 2004; 8:369–376. [
39. Idolor LF, De Guia T, Fransisco NA, et al. Burden of obstructive lung disease in a rural setting in the Philippines. Respirology. 2011;16:1111–111
40. Plit ML, Anderson R, Van Rensburg CE, et al. Influence of antimicrobial chemotherapy on spirometric parameters and pro-infl ammatory indices in severe pulmonary tuberculosis. Eur Respir J. 1998;12:351–356.
41. Chung KP, Chen JY, Lee CH, et al. Trends and predictors of changes in pulmonary function after treatment for pulmonary tuberculosis. Clinics. 2011;66(4):549–556.
42. Vargha G. Fifteen year follow-up of lung function in obstructive and non-obstructive pulmonary tuberculosis. Acta Med Hung. 1983;40:271–276
43. Rhee CK, Yoo KH, Lee JH, et al. Clinical characteristics of patients with tuberculosis-destroyed lung. Int J Tuberc Lung Dis. 2013;17(1):67–75.
44. Swain S, Pothal S, Behera A, Manjhi R, Dutta P, Pradhan G. Treatment outcome among Post TB obstructive airways diseases and COPD: A prospective cohort study. J Family Med Prim Care 2021;10:3411-6.
45. Yide Wang et al. Impact of Previous Pulmonary Tuberculosis on Chronic Obstructive Pulmonary Disease: Baseline Results from a Prospective Cohort Study. Combinatorial Chemistry & High Throughput Screening, 2023, 26, 93-102
46. Lindiwe Malefane et al. Post-tuberculosis lung disease and inflammatory role players: can we characterise the myriad inflammatory pathways involved to gain a better understanding?. Chemico-Biological Interactions 387 (2024) 110817
47. Mbatchou Ngahane BH, Nouyep J, Nganda Motto M, et al. Post-tuberculous lung function impairment in a tuberculosis reference clinic in Cameroon. Respir Med. 2016;114:67–71
48. Pefura-Yone EW, Kengne AP, Tagne-Kamdem PE, et al. Clinical significance of low forced expiratory flow between 25% and 75% of vital capacity following treated pulmonary tuberculosis: a cross-sectional study. BMJ Open. 20
49. Mohamed A. Zamzam et al. Relation between pulmonary tuberculosis and chronic obstructive pulmonary disease. The Egyptian Journal of Chest Diseases and Tuberculosis 2022, 71:15–19
49b. Huanhuan Fan et al. Pulmonary tuberculosis as a risk factor for chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Transl Med 2021;9(5):390 | http://dx.doi.org/10.21037/atm-20-4576
50. Yeh JJ, Wang YC, Sung FC, Chou CY, Kao CH. Nontuberculosis mycobacterium disease is a risk factor for chronic obstructive pulmonary disease: a nationwide cohort study. Lung. 2014; 192(3):403–411
51. Khan Z, Miller A, Bachan M, Donath J. 2010;Mycobacterium avium complex (MAC) lung disease in two inner city community hospitals: recognition, prevalence, co-infection with mycobacterium tuberculosis (MTB) and pulmonary function (PF) Improvements after treatment. Open Respir Med J. 2010;4:76–81.
52. Hrabec E, Strek M, Zieba M, Kwiatkowska S, Hrabec Z. Circulation level of matrix metalloproteinase 9 is correlated with disease severity in tuberculosis patients. Int J Tuberc Lung Dis 2002;6:713 9.
53. Elkington PT, Friedland JS. Matrix metalloproteinases in destructive pulmonary pathology. Thorax 2006;61:259 66.
54. Sundarajan S, Babu S, Das SD. Comparison of localised versus systemic levels of matrix metalloproteinases (MMPs) in tissue inhibitors and cytokines in tuberculosis and non tubercular pleurosis. Hum Immunol 2012;73:985 91.
55. MacNee W. Oxidative stress and lung inflammation in airways disease. Eur J Pharmacol 2001;429:195 207
56. Lamprecht B, McBurnie MA, Vollmer WM, Gudmundsson G, Welte T, Nizankowska Mogilnicka E, et al. COPD in never smokers: Results from the population based burden of obstructive lung disease study. Chest 2011;139:752 63
57. Lundbäck B, Lindberg A, Lindström M, Rönmark E, Jonsson AC, Jönsson E, et al. Not 15 but 50% of smokers develop COPD? Report from the Obstructive Lung Disease in Northern Sweden Studies. Respir Med 2003;97:115 22.
58. Alcaïs A, Fieschi C, Abel L, Casanova JL. Tuberculosis in children and adults: Two distinct genetic diseases. J Exp Med 2005;202:1617 21.
59. Bates MN, Khalakdina A, Pai M, Chang L, Lessa F, Smith KR. Risk of tuberculosis from exposure to tobacco smoke: A systematic review and meta analysis. Arch Intern Med 2007;167:335 42.
60. Hwang YI, Kim JH, Lee CY, et al. The association between airflow obstruction and radiologic change by tuberculosis. J Thorac Dis. 2014;6(5):471–476
61. Gothi D, Shah DV, Joshi JM. Clinical profile of diseases causing chronic airflow limitation in a tertiary care centre in India. J Assoc Physicians India. 2007;55:551–555
62. Long R, Maycher B, Dhar A, Manfreda J, Hershfield E, Anthonisen N. Pulmonary tuberculosis treated with directly observed therapy serial changes in lung structure and function. Chest. 1998;113(4):933
63. Jeong YJ, Lee KS, Koh WJ, et al. Nontuberculous mycobacterial pulmonary infection in immunocompetent patients: comparison of thin-section CT and histopathologic findings. Radiology. 2004;231:880–886
64. Hamel NC, Briggs JN, Schulkins TA. Post-tuberculous bronchiectasis–indications for surgical treatment. Calif Med. 1962; 97:233–234.
65. Palwatwichai A, Chaoprasong C, Vattanathum A, et al. Clinical, laboratory findings and microbiologic characterization of bronchiectasis in Thai patients. Respirology. 2002;7:63–66.
66. Natarajan S, Rudrawar P. Bronchiectasis in western India: clinical presentations and socio-economic burden. J Indian Med Assoc. 2014;112(2):89–92.
67. Lopez-Campos JL, Calero C. Infectious causes of chronic obstructive pulmonary disease: ’TB or not TB, that is the question’. Respiration. 2013;86(1):15–16
68. Chae JN, Jung CY, Shim SW, Rho BH, Jeon YJ. CT radiologic findings in patients with tuberculous destroyed lung and correlation with lung function. Tuberc Respir Dis. 2011;71:2
69. Bromberg PA, Robin ED. 1963. Abnormalities of lung function in tuberculosis. Bibl Tuberc, 17:1–2
70. Verma RP, Hansch C. Matrix metalloproteinases (MMPs): chemical–biological functions and (Q)SARs. Bioorg Med Chem. 2007;15:2223–2268
71. Salgame P. MMPs in tuberculosis: granuloma creators and tissue destroyers. J Clin Invest. 2011;121(5):168
72. Elkington P, Shiomi T, Breen R, et al. MMP-1 drives immunopathology in human tuberculosis and transgenic mice. J Clin Invest. 2011;121(5):1827–1833
73. Finlay GA, O’driscoll LR, Russell KJ, et al. Matrix metalloproteinase expression and production by alveolar macrophages in emphysema. Am J Respir Crit Care Med. 1997;156:240–247.
74. Imai K, Dalal SS, Chen ES, et al. Human collagenase (matrix metalloproteinase-1) expression in the lungs of patients with emphysema. Am J Respir Crit Care Med. 2001;163:786–791.
75. Singh S, Kubler A, Singh UK, et al. Antimycobacterial drugs modulate immunopathogenic matrix metalloproteinases in a cellular model of pulmonary tuberculosis. Antimicrob Agents Chemother. 2014;58(8):4657– 466
76. Halil Ibrahim Yakar et al. The role of tuberculosis in COPD. International Journal of COPD 2017:12 323–329
77. Anthony L. Byrne et al. Tuberculosis and chronic respiratory disease: a systematic review. International Journal of Infectious Diseases 32 (2015) 138–146
78. Lee C-H, Lee M-C, Lin H-H, Shu C-C, Wang J-Y, et al. (2012) Pulmonary Tuberculosis and Delay in Anti Tuberculous Treatment Are Important Risk Factors for Chronic Obstructive Pulmonary Disease. PLoS ONE 7(5): e37978. doi:10.1371/journal.pone.0037978
79. Ravimohan S, Kornfeld H, Weissman D, et al. Tuberculosis and lung damage: from epidemiology to pathophysiology. Eur Respir Rev 2018;27.
80. Celli BR, Wedzicha JA. Update on Clinical Aspects of Chronic Obstructive Pulmonary Disease. N Engl J Med 2019;381:1257-66.
81. Postma DS, Bush A, van den Berge M. Risk factors and early origins of chronic obstructive pulmonary disease. Lancet 2015;385:899-90
82. Salvi SS, Barnes PJ. Chronic obstructive pulmonary disease in non-smokers. Lancet 2009;374:733-43.
83. Siddharthan T, Gupte A, Barnes PJ. COPD Endotypes in Low- and Middle-income Country Settings: Precision Medicine for All. Am J Respir Crit Care Med 2020.
84. van Gemert F, Kirenga B, Chavannes N, et al. Prevalence of chronic obstructive pulmonary disease and associated risk factors in Uganda (FRESH AIR Uganda): a prospective cross-sectional observational study. Lancet Global Health 2015;3:e44-51
85. Govender N, Lalloo UG, Naidoo RN. Occupational exposures and chronic obstructive pulmonary disease: a hospital based case-control study. Thorax 2011;66:597-601.
86. Yen YF, Yen MY, Lin YS, Lin YP, Shih HC, Li LH, et al. Smoking increases risk of recurrence after successful anti tuberculosis treatment: A population based study. Int J Tuberc Lung Dis 2014;18:492 8.
87. Arcavi L, Benowitz NL. Cigarette smoking and infection. Arch Intern Med 2004;164:2206 16.
88. Pai M, Mohan A, Dheda K, Leung CC, Yew WW, Christopher DJ, et al. Lethal interaction: The colliding epidemics of tobacco and tuberculosis. Expert Rev Anti Infect Ther 2007;5:385 91.
89. Leung CC, Li T, Lam TH et al. Smoking and tuberculosis among the elderly in Hong Kong. Am. J. Respir. Crit. Care Med. 170, 1027–1033 (2004).
90. Hridaya Ghimire. Role of Latent Tuberculosis Infection in the Pathogenesis and Severity of COPD. Chest. 2011;140 (4_MeetingAbstracts):564A. doi:10.1378/chest.1118939
91. Davies PD, Yew WW, Ganguly D et al. Smoking and tuberculosis: the epidemiological association and immunopathogenesis. Trans. R. Soc. Trop. Med. Hyg. 100, 291–298 (2006).
92. Rook GA, Dheda K, Zumla A. Immune responses to tuberculosis in developing countries: implications for new vaccines. Nat. Rev. Immunol. 5, 661–667 (2005).
93. Borovikova LV, Ivanova S, Zhang M et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature 405, 458–462 (2000)
94. Matsunaga K, Klein TW, Friedman H, Yamamoto Y. In vitro therapeutic effect of epigallocatechin gallate on nicotineinduced impairment of resistance to Legionella pneumophila infection of established MH-S alveolar macrophages. J. Infect. Dis. 185, 229–236 (2002).
95. Robbins CS, Dawe DE, Goncharova SI et al. Cigarette smoke decreases pulmonary dendritic cells and impacts antiviral immune responsiveness. Am. J. Respir. Cell Mol. Biol. 30, 202–211 (2004).
96. Avanzini MA, Ricci A, Scaramuzza C et al. Deficiency of INF γ producing cells in adenoids of children exposed to passive smoke. Int. J. Immunopathol. Pharmacol. 19, 609–616 (2006)
97. Nordskog BK, Fields WR, Hellmann GM. Kinetic analysis of cytokine response to cigarette smoke condensate by human endothelial and monocytic cells. Toxicology 212, 87–97 (2005).
98. Lin HH, Ezzati M, Murray M. Tobacco smoke, indoor air pollution and tuberculosis: a systematic review and meta-analysis. PLoS Med. 4, e20 (2007)
99. Inghammar M, Ekbom A, Engstrom G, et al. COPD and the risk of tuberculosis- a population-based cohort study. PLoS One. 2010;5:e10138.
100. Brassard P, Suissa S, Kezouh A, Ernst P. Inhaled corticosteroids and risk of tuberculosis in patients with respiratory diseases. Am J Respir Crit Care Med. 2011;183(5):67
101. Malay Sarkar et al. Tuberculosis associated chronic obstructive pulmonary disease. Clin Respir J. 2017;11:285–295.
102. Segal BH, Sneller MC. Infectious complications of immuno-suppressive therapy in patients with rheumatic diseases. Rheum Dis Clin North Am. 1997;23:219–237
103. Shang S, Ordway D, Henao-Tamayo M, et al. Cigarette smoke increases susceptibility to tuberculosis e evidence from in vivo and in vitro models. J Infect Dis. 2011;203:1240–1248
104. Tang S, Cui H, Yao L, et al. Increased cytokines response in patients with tuberculosis complicated with chronic obstructive pulmonary disease. PLoS One. 2013;8(4):e62385.
105. Taylor AE, Finney-Hayward TK, Quint JK, et al. Defective macrophage phagocytosis of bacteria in COPD. Eur Respir J. 2010;35(5):1039–1047
106. Hiemstra PS. Altered macrophage function in chronic obstructive pulmonary disease. Ann Am Thorac Soc. 2013;10(Suppl): S180–S185.
107. Holloway RA, Donnelly LE. Immunopathogenesis of chronic obstructive pulmonary disease. Curr Opin Pulm Med. 2013;19: 95–102.
108. Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 2008;8:958– 969
109. Giorgio Castellana et al. Inhaled Corticosteroids And Risk Of Tuberculosis In Patients With Obstructive Lung Diseases: A Systematic Review And Meta-Analysis Of Non-randomized Studies. International Journal of Chronic Obstructive Pulmonary Disease 2019:14 2219–2227
110. Songshi Ni et al. Inhaled corticosteroids (ICS) and risk of mycobacterium in patients with chronic respiratory diseases: a meta-analysis. J Thorac Dis 2014;6(7):971-978
111. Abay Burusie et al. Effect of smoking on tuberculosis treatment outcomes: A systematic review and meta analysis. PLOS ONE | https://doi.org/10.1371/journal.pone.0239333 September 17, 2020
112. van Kampen SC, Wanner A, Edwards M, et al. International research and guidelines on post-tuberculosis chronic lung disorders: a systematic scoping review. BMJ Glob Health 2018;3:e000745. doi:10.1136/ bmjgh-2018- 00074
113. WHO. The End TB Strategy. Geneva: World Health Organization, 2015.
114. UN. Transforming our world: the 2030 agenda for sustainable development. New York: United Nations, 2015. 115. GOLD report 2024. Htpp:// goldcopd.org
116. Yum HK, Park IN. Effect of inhaled tiotropium on spirometric parameters in patients with tuberculous destroyed lung. Tuberc Respir Dis (Seoul). 2014;77(4):167–171.
117. Ross J, Ehrlich RI, Hnizdo E, et al. Excess lung function decline in gold miners following pulmonary tuberculosis. Thorax 2010; 65: 1010–1015.
118. Maguire GP, Anstey NM, Ardian M, et al. Pulmonary tuberculosis, impaired lung function, disability and quality of life in a high-burden setting. Int J Tuberc Lung Dis 2009; 13: 1500–1506.
119. Ralph AP, Kenangalem E, Waramori G, et al. High morbidity during treatment and residual pulmonary disability in pulmonary tuberculosis: under-recognised phenomena. PLoS One 2013; 8: e80302.
120. Gingo MR, George MP, Kessinger CJ, et al. Pulmonary function abnormalities in HIV-infected patients during the current antiretroviral therapy era. Am J Respir Crit Care Med 2010; 182: 790–796.
121. Gingo MR, He J, Wittman C, et al. Contributors to diffusion impairment in HIV-infected persons. Eur Respir J 2014; 43: 195–203.

