Hỗ trợ sự sống cơ bản và nâng cao trong hồi sức sau ngưng tim
Tác giả: Ths. Bs Hồ Hoàng Kim - EDICU - BV Nguyễn Tri Phương
Tải file PDF TẠI ĐÂY
Chapter 21 NGƯNG TIM
Năm 1960, một báo cáo xuất hiện trên Tạp chí của Hiệp hội Y khoa Hoa Kỳ, báo cáo này cuối cùng đã thay đổi cách chúng ta tiếp cận quá trình hấp hối. Báo cáo có tựa đề “Xoa bóp tim ngực kín” (1), bao gồm 5 trường hợp ngừng tim hô hấp đã được xử lý thành công bằng cách ấn ngực, sốc điện và hỗ trợ hô hấp. Cùng năm đó (và không có bất kỳ nghiên cứu xác nhận nào), Hiệp hội Tim mạch Hoa Kỳ đã bắt đầu một chương trình giáo dục các bác sĩ về hồi sức tim ngực kín, sau đó phát triển thành hồi sức tim phổi (CPR). Kể từ khi ra đời, CPR đã trở thành một hoạt động bắt buộc trên toàn thế giới, chỉ được thực hiện khi có yêu cầu và yêu cầu chứng nhận 2 năm một lần để đảm bảo năng lực của người hành nghề. Và tất cả những điều này chỉ dành cho một phương thức điều trị mà thất bại trong hầu hết các trường hợp, như thể hiện trong Bảng 21.1 (2).
Chương này mô tả các khía cạnh thực tế của CPR và cách xử lý sau một nỗ lực hồi sức thành công. Các khuyến nghị trong chương này được trích từ các hướng dẫn và sổ tay hướng dẫn mới nhất và có liên quan nhất về CPR, được liệt kê trong phần tài liệu tham khảo ở cuối chương (3–8).
| BẢNG 21.1 Dữ liệu về ngừng tim tại Hoa Kỳ, năm 2021 | ||
|---|---|---|
| OHCA | IHCA | |
| Số lượng | 143018 | 8619 |
| Nhanh thất/ rung thất | 17% | 13% |
| PEA/ Vô tâm thu | 75% | 78% |
| Sống sót khi xuất viện | 9% | 19% |
| Sống sót với chức năng thần kinh tốt | 7% | 1% |
1 HỖ TRỢ SỰ SỐNG CƠ BẢN – BLS
Các yếu tố hỗ trợ sự sống cơ bản (BLS) là ép ngực và thổi phồng phổi định kỳ thông qua đường hô hấp trên phải được thông thoáng. Mức độ ưu tiên của các yếu tố này được chỉ ra bằng cách ghi nhớ phổ biến CAB (Tuần hoàn, Đường thở và Hơi thở).
1.1 Phụ thuộc thời gian
Một trong những yếu tố hạn chế chính trong thành công của CPR là khoảng thời gian rất ngắn giữa lúc ngừng lưu thông máu và tế bào chết không hồi phục. Tổng lượng O2 trong cơ thể người trưởng thành là khoảng một lít, và với mức tiêu thụ O2 bình thường là khoảng 250 mL/phút khi nghỉ ngơi, điều này chỉ để lại khoảng 4 phút sau khi ngừng lưu thông máu cho đến khi lượng O2 trong cơ thể cạn kiệt hoàn toàn. Do đó, sau khi ngừng lưu thông máu do ngừng tim, tế bào chết do thiếu oxy dự kiến chỉ trong vòng 4–5 phút. (Một ngoại lệ đối với điều này là đuối nước lạnh, khi nhiệt độ lạnh sẽ làm giảm lượng O2 tiêu thụ và kéo dài thời gian tổn thương tế bào do thiếu oxy.) Điều này nhấn mạnh "nhu cầu về tốc độ" khi bắt đầu CPR.
1.2 Tổng quan
Yếu tố kích hoạt CPR là không có mạch đập ở bệnh nhân không phản ứng, có nỗ lực thở tự nhiên tối thiểu hoặc không có. Ép tim ngoài lồng ngực nên bắt đầu trong vòng 10 giây sau khi kích hoạt, sử dụng độ sâu và tần suất ép tim được thể hiện trong Bảng 21.2. Nên thực hiện hai lần thổi phồng phổi (bằng thiết bị túi-mặt nạ) sau mỗi 30 lần ép tim ngoài lồng ngực, mà không làm gián đoạn các lần ép tim (3–5). Sau khi đặt ống nội khí quản (ET), thổi phồng phổi – bóp bóng giúp thở được thực hiện ở các khoảng thời gian 6 giây (10 lần/phút) mà không làm gián đoạn các lần ép tim ngoài lồng ngực. Tuy nhiên, ép tim ngoài lồng ngực và thổi phồng phổi đồng thời sẽ hạn chế thể tích thổi phồng và nên tránh (4). Cuối cùng, nên áp máy theo dõi ECG/máy khử rung tim cho bệnh nhân càng sớm càng tốt.
| BẢNG 21.2 Các yếu tố thiết yếu của hỗ trợ sự sống cơ bản - BLS |
|---|
|
1.3 Ấn ngực ép tim
Xương sống của BLS là ép ngực chất lượng cao với sự gián đoạn tối thiểu. Các nghiên cứu quan sát đã chỉ ra rằng sự gián đoạn trong ép ngực có thể chiếm tới 50% tổng thời gian hồi sức (9) và sự gián đoạn kéo dài có thể dẫn đến kết quả kém. Các khuyến nghị hiện tại là tiếp tục ép ngực mà không bị gián đoạn cho đến khi máy khử rung tim được áp vào bệnh nhân. (Sau đó, có thể tạm dừng ép ngực để khử rung và kiểm tra nhịp tim, như mô tả sau.)
1.4 Ấn ngực ép tim chất lượng cao
Ép ngực chất lượng cao được định nghĩa là có độ sâu từ 2–2,4 inch (5–6 cm) và tốc độ từ 100 đến 120 lần/phút, với độ nảy ngực hoàn toàn giữa các lần ép (3–5). Việc ước tính độ sâu của các lần ép rất khó khăn, đặc biệt là khi phạm vi mục tiêu chỉ là 0,4 inch. Có những thiết bị được sử dụng để đào tạo CPR để đo độ sâu của lần ép và cung cấp phản hồi bằng âm thanh (ví dụ: sử dụng lời nhắc đôi khi gây khó chịu, "ép mạnh hơn"), nhưng chúng không có sẵn để sử dụng trong lâm sàng. Mệt mỏi có thể ảnh hưởng đến độ sâu của lần ép và mỗi người thực hiện ép nên được thay thế sau 2 phút, nếu có thể (4,5).
1.5 Bơm “phồng” phổi
Thổi phồng phổi được thực hiện bằng cách bóp một túi thông khí tự phồng (ví dụ: Bóng thở Ambu) chứa đầy oxy. Thể tích khuyến nghị cho mỗi lần thổi phồng phổi là 500–600 mL hoặc bất kỳ thể tích nào tạo ra sự gia tăng rõ rệt ở thành ngực (4). Tuy nhiên, thể tích thổi phồng không được theo dõi trong quá trình “bóp bằng túi” và thể tích thổi phồng lớn thường xảy ra trong quá trình hồi sức tim phổi (10), điều này có thể gây tổn thương cho phổi (tương tự như “tổn thương phổi do máy thở”, được mô tả trong Chương 24). Có thể tuân thủ chặt chẽ hơn các thể tích thổi phồng được khuyến nghị nếu biết dung tích thể tích của túi thông khí. Ví dụ, nếu túi thông khí có dung tích thể tích là 1 lít, việc bóp túi cho đến khi đầy khoảng một nửa sẽ cung cấp thể tích khoảng 500 mL. (Dung tích thể tích của hầu hết các túi thông khí dành cho người lớn là 1 đến 2 lít.) Một cách tiếp cận khác là sử dụng một tay để bóp túi thông khí, cung cấp thể tích khoảng 600 đến 700 mL (quan sát cá nhân) và không có khả năng gây ra tình trạng thổi phồng phổi gây đến mức gây hại.
1.6 Việc bóp bóng quá nhanh
Bóp thông khí phổi lên nhanh thường gặp trong quá trình CPR (11,12), và tốc độ trung bình là 30 lần/phút (gấp 3 lần tốc độ khuyến cáo) đã được báo cáo (12). Thở nhanh là vấn đề vì phổi không có đủ thời gian để làm rỗng không khí, dẫn đến tình trạng tăng áp động tiến triển (tăng bơm động) và sinh áp lực dương đường thở cuối thì thở ra (PEEPi). PEEPi do thở nhanh tạo ra được gọi là "PEEP nội tại" và được mô tả chi tiết trong Chương 23. Sự gia tăng áp lực trong lồng ngực trung bình từ PEEP có hai tác động có hại: 1) làm giảm lượng máu tĩnh mạch trở về tim, hạn chế khả năng của ép ngực trong việc tăng lưu lượng tim và 2) làm giảm áp lực tưới máu động mạch vành (11), đây là yếu tố quan trọng quyết định kết quả trong trường hợp ngừng tim. Vì những lý do này, việc tránh tốc độ bơm phổi nhanh sẽ làm tăng cơ hội có kết quả thuận lợi với CPR.
1.7 Đường tiếp cận mạch máu – thiết lập vein hồi sức
Nên thiết lập đường truyền mà không làm gián đoạn ép ngực. Đường vào tĩnh mạch ngoại vi được coi là phù hợp (4), nhưng đường truyền vào xương thường được ưa chuộng hơn vì dễ thiết lập mà không làm gián đoạn ép ngực và an toàn hơn catheter tĩnh mạch ngoại vi. (Xem Chương 1 để biết mô tả về đường vào xương.)
2 HỖ TRỢ SỰ SỐNG NÂNG CAO
Hỗ trợ tim mạch nâng cao (ACLS) bao gồm sốc điện (khử rung tim) và sử dụng thuốc hỗ trợ nỗ lực hồi sức. Phương pháp này chia việc quản lý ngừng tim thành hai con đường: một là quản lý rung thất (VF) và nhịp nhanh thất vô mạch (VT), và con đường còn lại là hoạt động điện vô mạch (PEA) và vô tâm thu.
2.1 Rung thất và nhanh thất vô mạch
Biện pháp can thiệp chính đối với VF và VT vô mạch là “khử rung” bằng điện, do đó các rối loạn nhịp tim này được gọi là “nhịp có thể sốc điện”.
2.2 Sốc điện khử rung tim
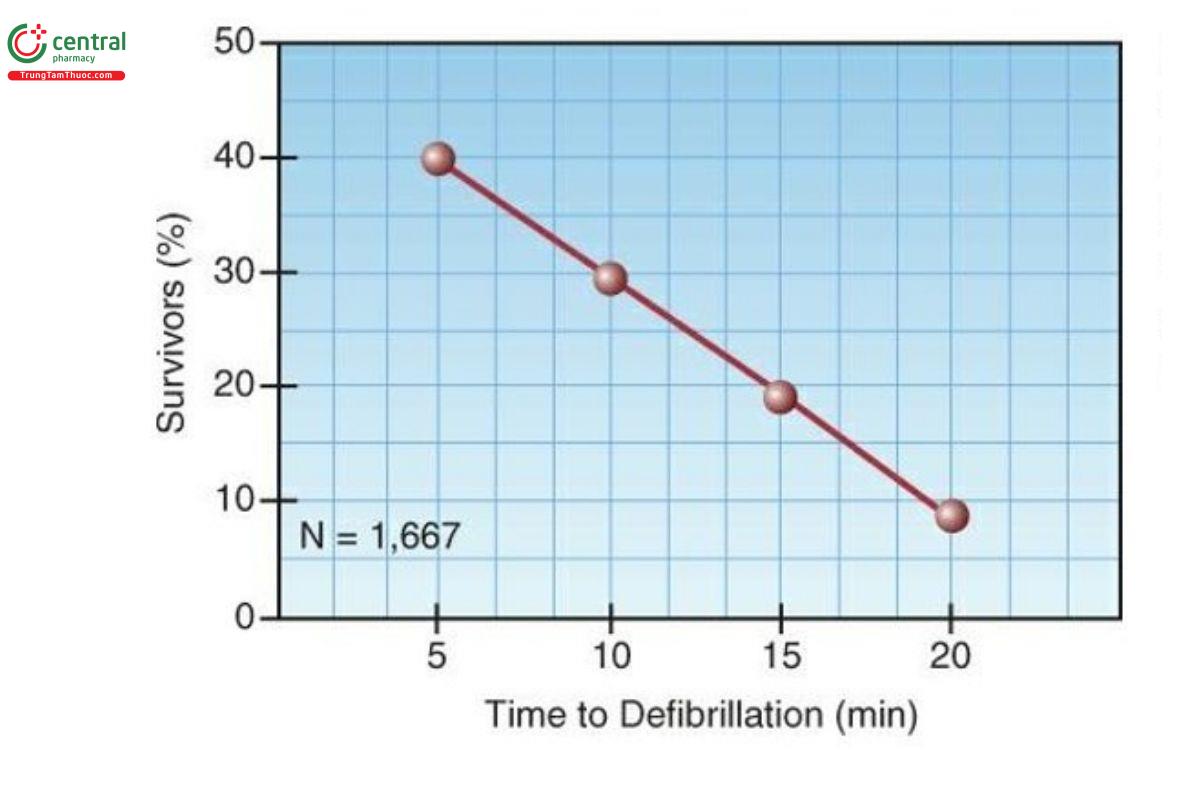
Khử rung chuyển nhịp tim bằng điện sử dụng các cú sốc không đồng bộ (tức là không tính theo thời gian của phức hợp QRS) được gọi là khử rung tim và đây là một trong số ít các biện pháp can thiệp giúp cải thiện khả năng sống sót ở nạn nhân ngừng tim. Tuy nhiên, lợi ích về khả năng sống sót phụ thuộc vào thời gian. Điều này được thể hiện trong Hình 21.1, trích từ một nghiên cứu về mối quan hệ giữa khả năng sống sót và thời gian (từ khi ngã gục) đến khi khử rung tim trong các trường hợp ngừng tim liên quan đến VF hoặc VT (13). Lưu ý rằng 40% bệnh nhân sống sót khi cú sốc đầu tiên được thực hiện 5 phút sau khi ngừng tim, trong khi ít hơn 10% bệnh nhân sống sót nếu khử rung tim bị trì hoãn cho đến 20 phút sau khi ngừng tim.
NĂNG LƯỢNG KHỬ RUNG: Máy khử rung tim hiện đại cung cấp các cú sốc hai pha (VF và VT ở mức năng lượng thấp hơn so với các cú sốc một pha) và mức năng lượng hiệu quả có thể thay đổi từ mức thấp tới 100 J đến mức cao tới 360 J, với mức năng lượng cao hơn cần thiết cho các đợt VF/VT kháng trị hoặc tái phát (14). Máy khử rung tim bên ngoài trời tự động (AED) thường cung cấp các cú sốc năng lượng cố định, trong khi các máy khử rung tim khác có mức năng lượng được chọn trước cho các cú sốc hoặc cho phép người dùng chọn mức năng lượng mong muốn.
Thuật toán (lưu đồ) quản lý điều trị:
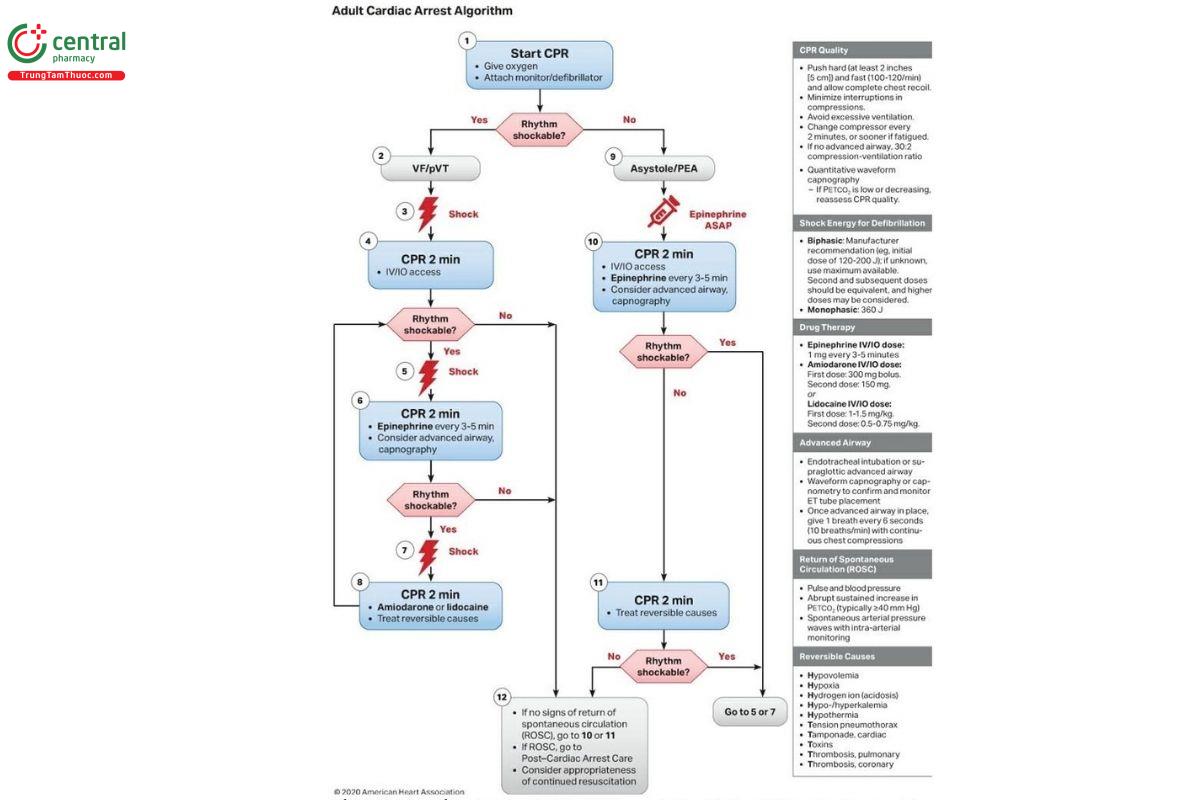
Thuật toán lưu đồ ACLS cho ngừng tim ở người lớn được thể hiện trong Hình 21.2 (8) và phía bên trái của sơ đồ dòng chảy chỉ ra cách xử lý khi nhịp ban đầu là VF hoặc VT. Các đặc điểm chính của cách xử lý được tóm tắt dưới đây.
- Việc xử lý bao gồm một loạt 3 lần khử rung tim, nếu cần. Sốc ban đầu thường là 120– 200 J đối với sốc hai pha (hoặc được nhà sản xuất khuyến nghị). Nếu cách này không hiệu quả, có thể sử dụng mức năng lượng cao hơn cho các lần sốc tiếp theo, nếu máy khử rung tim cho phép.
- Tạm dừng ép ngực khi sốc khử rung tim được thực hiện và tiếp tục ngay sau đó. Khuyến nghị nên thực hiện ít nhất 2 phút ép ngực không ngắt quãng sau khi khử rung tim trước khi kiểm tra nhịp sau sốc.
- Nếu cần khử rung tim lần thứ hai, hãy bắt đầu dùng epinephrine bằng cách sử dụng liều bolus 1 mg (tiêm tĩnh mạch hoặc tiêm trong xương) sau mỗi 3–5 phút trong suốt thời gian hồi sức.
- Nếu cần khử rung tim lần thứ ba, amiodarone được dùng dưới dạng liều bolus 300 mg (IV hoặc IO), sau đó có thể dùng liều thứ hai 150 mg nếu cần. Nếu không có Amiodarone, có thể dùng Lidocaine với liều khởi đầu là 1–1,5 mg/kg (IV hoặc IO), sau đó là 0,5–0,75 mg/kg cứ sau 5–10 phút nếu cần, đến liều tối đa là 3 mg/kg (8).
CÁC TRƯỜNG HỢP KHÁNG SỐC: Thất bại sau ba lần khử rung tim để chuyển VT và VF có tiên lượng rất kém, với kết quả khả quan chỉ ở 5% trường hợp (15). Kết quả cải thiện đã được báo cáo ở VF/VT kháng sốc được xử lý bằng hỗ trợ sự sống ngoài cơ thể khẩn cấp (ECMO) (16) và phương pháp này chắc chắn là một cân nhắc nếu ECMO có sẵn trên cơ sở 24 giờ.
2.3 Vô tâm thu/ Hoạt động điện vô mạch – PEA
Việc quản lý tình trạng ngừng tim liên quan đến hoạt động điện vô mạch (PEA) và vô tâm thu thất được thể hiện ở nửa bên phải của lưu đồ thuật toán ACLS trong Hình 21.2. Can thiệp chính là liệu pháp dùng thuốc co mạch bằng epinephrine sử dụng cùng chế độ liều dùng cho VF và VT vô mạch. Không thực hiện khử rung tim trừ khi nhịp tim thay đổi thành VF hoặc VT.
2.4 PEA có những nguyên nhân có thể đảo ngược được
PEA có những nguyên nhân có khả năng hồi phục, có thể được xác định bằng chữ cái “T”: tức là, Tràn khí màng phổi căng thẳng, Tràn dịch màng ngoài tim, Thuyên tắc huyết khối tĩnh mạch và Tắc nghẽn huyết khối động mạch vành. Mặc dù có ít thời gian để chẩn đoán trong quá trình ngừng tim, siêu âm tại chỗ có thể là một trợ giúp có giá trị trong việc phát hiện một số tình trạng này (xem phần sau).
2.5 Epinephrine
Epinephrine là loại thuốc hỗ trợ tuần hoàn duy nhất được sử dụng cho CPR. Mặc dù nó đã được chứng minh là làm tăng tỷ lệ hồi phục tuần hoàn tự nhiên (17), nhưng tác động đến khả năng sống sót vẫn chưa rõ ràng. Hầu hết các nghiên cứu cho thấy không có sự cải thiện nào về khả năng sống sót liên quan đến epinephrine (17,18), nhưng có một nghiên cứu cho thấy khả năng sống sót tăng lên sau 30 ngày (19), mặc dù nhiều người sống sót không còn nguyên vẹn về mặt tinh thần.
2.6 Các hoạt động
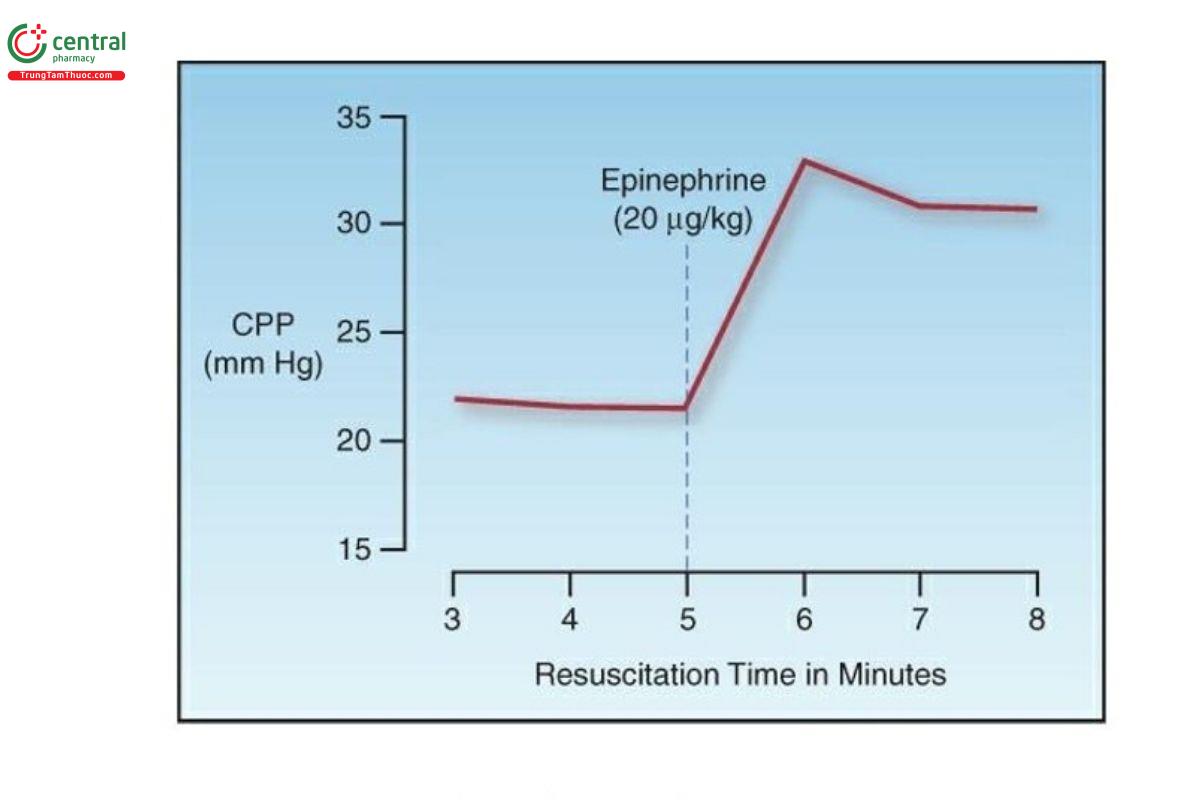
Lợi ích thu được từ epinephrine là co mạch toàn thân, có thể làm tăng lưu lượng trong cả tuần hoàn não và động mạch vành. Sự gia tăng lưu lượng máu động mạch vành là do tăng áp lực tưới máu động mạch vành (sự khác biệt giữa áp lực động mạch chủ và tâm nhĩ phải giữa các lần ấn tim). Điều này được chứng minh trong Hình 21.3 (20). Trong trường hợp này, có sự gia tăng 30% áp lực tưới máu động mạch vành sau khi tiêm tĩnh mạch epinephrine và tác dụng kéo dài ít nhất 3 phút (khoảng thời gian khuyến cáo giữa các liều epinephrine).
Nhược điểm của epinephrine là kích thích tim qua trung gian thụ thể β, có thể xóa bỏ lợi ích của việc tăng tưới máu động mạch vành và cũng có liên quan đến suy tim sau hồi sức (20).
3 THEO DÕI QUÁ TRÌNH HỒI SINH
Theo truyền thống, việc theo dõi sự trở lại của tuần hoàn tự nhiên (ROSC) chỉ giới hạn ở việc sờ nắn thủ công để tìm mạch, nhưng phương pháp này có độ nhạy thấp (21) và thường đòi hỏi phải ngừng ép tim trong thời gian dài (22). Siêu âm để phát hiện mạch đập của động mạch cảnh có thể đẩy nhanh quá trình phát hiện mạch (23), nhưng cũng đòi hỏi phải ngừng ép tim. PCO2 cuối thì thở ra cung cấp đánh giá đáng tin cậy hơn (và sinh lý hơn) về tuần hoàn và có thể được sử dụng để dự đoán khả năng xảy ra ROSC.
3.1 End-Tidal PCO2 – CO2 cuối thì thở ra
(Đo PCO2 cuối thì thở ra được mô tả chi tiết trong Chương 7: xem Hình 7.6.) PCO2 trong khí thở ra ở cuối thì thở ra (PCO2 cuối thì thở ra) phản ánh sự cân bằng giữa thông khí và tưới máu trong phổi. PCO2 cuối thì thở ra (ETCO2) thay đổi trực tiếp theo những thay đổi về cung lượng tim so với thông khí; nghĩa là, khi thông khí phế nang không đổi, những thay đổi về PCO2 cuối thì thở ra phản ánh những thay đổi theo tỷ lệ về cung lượng tim (ví dụ, giảm 30% PCO2 cuối thì thở ra cho thấy cung lượng tim giảm 30%). PCO2 cuối thì thở ra ban đầu thường tương đương với PCO2 động mạch (tức là khoảng 40 mm Hg), nhưng thấp hơn PCO2 động mạch trong các tình trạng phổi liên quan đến tăng khoảng chết sinh lý (tức là tỷ lệ V/Q > 1), chẳng hạn như bệnh phổi tắc nghẽn mạn tính.
3.2 Sử dụng PCO2 cuối thì thở ra
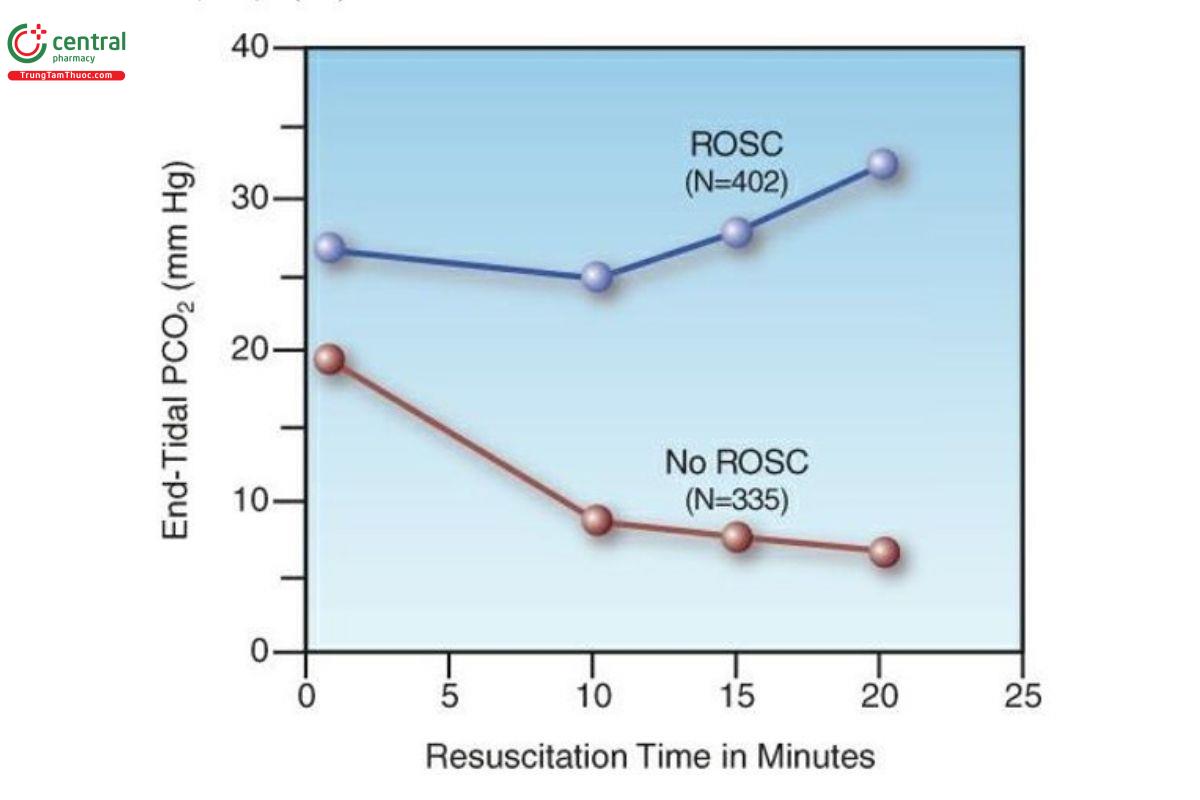
ETCO2 được đề xuất để theo dõi chất lượng ép ngực; tức là, độ sâu ép ngực tăng lên đi kèm với sự gia tăng ETCO2 (24). Quan trọng hơn, các giá trị chuỗi ETCO2 trong quá trình CPR có thể được sử dụng để xác định khả năng tuần hoàn tự nhiên trở lại (ROSC). Điều này được chứng minh bằng biểu đồ trong Hình 21.4, biểu đồ này cho thấy những thay đổi loạt chuỗi trong ETCO2 trong quá trình CPR liên quan đến ROSC (25). Những bệnh nhân đạt được ROSC cho thấy sự gia tăng dần dần ETCO2 trong thời gian hồi sức 20 phút, trong khi những bệnh nhân không đạt được ROSC cho thấy sự suy giảm dần dần ETCO2. ETCO2 phân biệt những người đáp ứng với những người không đáp ứng trong nghiên cứu này là 15 mm Hg sau 20 phút. Các nghiên cứu khác đã chỉ ra ETCO2 phân biệt là 10 mm Hg để phân biệt những người đáp ứng với những người không đáp ứng (26,27).
Tổng hợp các bằng chứng cho thấy rằng hồi sức thành công là không có khả năng nếu PCO2 cuối thì thở ra không cao hơn 10–15 mm Hg sau 20 phút CPR. Khi PCO2 cuối thì thở ra vẫn ở mức này, việc tiếp tục hồi sức trong thời gian dài tới 11⁄2 giờ có liên quan đến kết quả thuận lợi (28).
3.3 Siêu âm
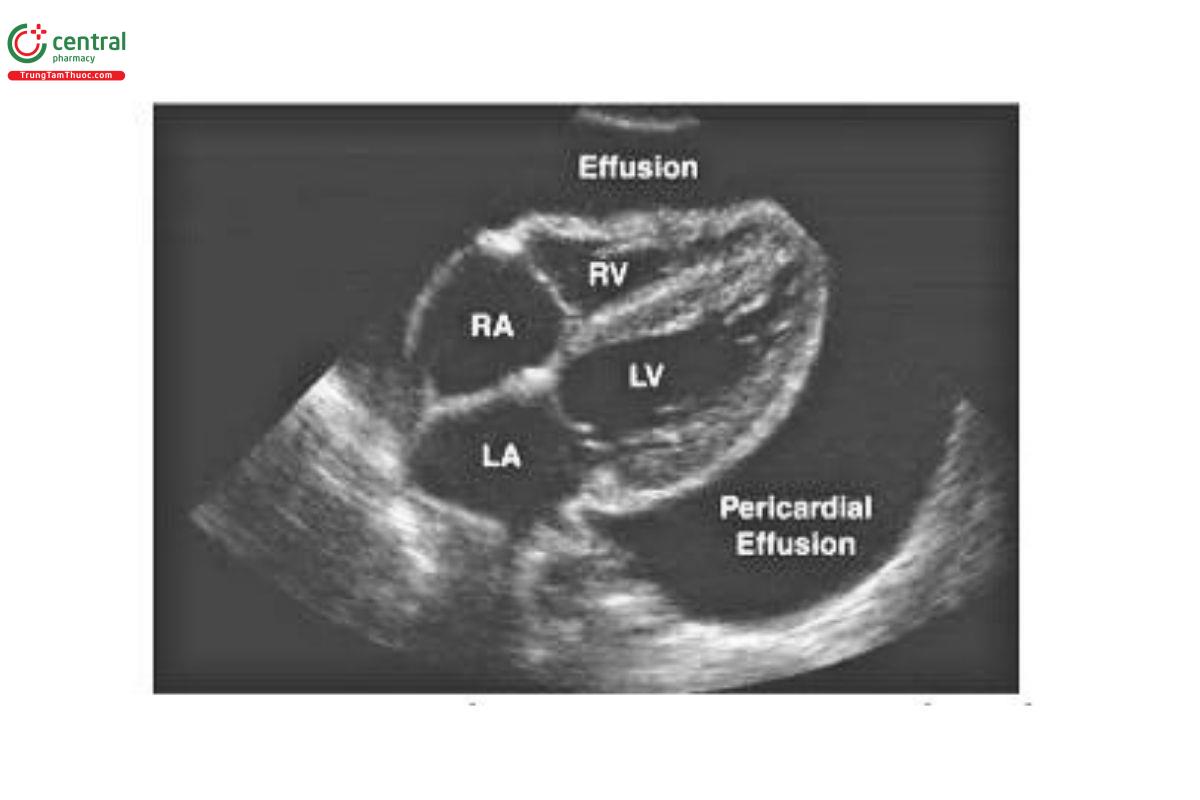
Siêu âm tại chỗ rất có giá trị trong việc phát hiện các nguyên nhân có khả năng hồi phục gây ngừng tim, chẳng hạn như tràn khí màng phổi có áp lực hoặc chèn ép màng ngoài tim. Siêu âm có độ nhạy cao (91%) và độ đặc hiệu (99%) trong việc phát hiện Tràn khí màng phổi ở tư thế nằm ngửa (29) và tràn dịch màng ngoài tim dễ dàng được phát hiện ở chế độ xem mặt cắt trục dài dưới sườn hoặc cạnh ức (xem Hình 21.5) (30). Các dấu hiệu truyền thống của chèn ép màng ngoài tim (tức là sự sụp đổ tâm trương của tâm thất phải) không đáng tin cậy trong quá trình ngừng tim (do áp lực trong tim thấp), vì vậy sự hiện diện của bất kỳ tràn dịch màng ngoài tim nào cũng nên thúc đẩy chọc dịch màng ngoài tim ngay lập tức.
Các nghiên cứu về ngừng tim liên quan đến chấn thương đã chỉ ra rằng bằng chứng siêu âm về tình trạng ngừng tim có khả năng dự đoán 100% khả năng tử vong (31). Tuy nhiên, có sự bất đồng đáng kể trong việc nhận biết tình trạng ngừng tim giữa các bác sĩ thực hiện siêu âm tại chỗ (32); do đó, các hướng dẫn thực hành lâm sàng về tình trạng ngừng tim không khuyến nghị phát hiện tình trạng ngừng tim bằng siêu âm là lý do để chấm dứt CPR (4).
4 HỒI SỨC GIAI ĐOẠN SAU NGƯNG TIM
Mục tiêu trước mắt của CPR là phục hồi tuần hoàn tự nhiên, nhưng điều này không đảm bảo kết quả khả quan. Trên thực tế, khoảng 70% bệnh nhân sống sót sau hồi sức không sống sót sau khi nằm viện (33). Phần này mô tả các vấn đề thường gặp trong những ngày sau khi hồi sức thành công cho bệnh nhân ngừng tim.
4.1 Hội chứng sau ngưng tim
Sự trở lại của tuần hoàn tự phát thường đi kèm với rối loạn chức năng ở một hoặc nhiều cơ quan chính có thể tiến triển và cuối cùng gây tử vong. Hội chứng sau ngừng tim này được cho là do sự kết hợp giữa tổn thương do thiếu máu cục bộ trong quá trình ngừng tim và tổn thương tái tưới máu do các chất độc hại giải phóng từ các mô bị thiếu máu cục bộ khi lưu lượng máu được thiết lập lại (33,34). Các đặc điểm chính của hội chứng này được tóm tắt dưới đây:
- Tổn thương não là biểu hiện phổ biến nhất của hội chứng sau ngừng tim và là nguyên nhân gây ra 23% đến 68% số ca tử vong sau khi ngừng tim (33). Các biểu hiện lâm sàng bao gồm không tỉnh, rung giật cơ và co giật toàn thể. Tỷ lệ tổn thương não cao sau khi ngừng tim được cho là do khả năng chịu đựng hạn chế đối với tình trạng thiếu máu cục bộ và khuynh hướng tổn thương tái tưới máu oxy hóa từ các gốc oxy phản ứng (34).
- Rối loạn chức năng tim sau ngừng tim là sự kết hợp của rối loạn chức năng tâm thu và tâm trương có thể tiến triển thành sốc tim trong vòng vài giờ sau ROSC (33). Vấn đề cơ bản là một loại tổn thương tái tưới máu được gọi là “choáng váng” cơ tim, thường sẽ khỏi trong vòng 72 giờ (33).
- Phản ứng viêm toàn thân (tức là sốt, tăng bạch cầu, v.v.) gần như phổ biến sau khi ngừng tim và có thể dẫn đến tổn thương viêm lan rộng với suy đa cơ quan và sốc tuần hoàn. (Xem Chương 17 để biết thêm về sốc viêm.)
4.2 Mục tiêu quản lý thân nhiệt sau ngưng tim
Nhiệt độ cơ thể tăng cao được biết đến nhiều vì có khả năng làm trầm trọng thêm tình trạng tổn thương não do thiếu máu cục bộ (35) và việc kiểm soát nhiệt độ cơ thể là trọng tâm chính trong các nỗ lực nhằm hạn chế tổn thương thần kinh ở những bệnh nhân sống sót sau cơn ngừng tim.
4.3 Một thoáng lịch sử
Hạ thân nhiệt gây ra (ban đầu được gọi là làm lạnh cơ thể người) đã được đưa ra để xử lý các nạn nhân sau cơn ngừng tim vào những năm 1950 (36), nhưng đã bị hủy bỏ vì những rủi ro liên quan đến hạ thân nhiệt. Khoảng nửa thế kỷ sau (năm 2002), hai nghiên cứu đã được công bố cho thấy hạ thân nhiệt nhẹ (32–34° C) cải thiện cơ hội phục hồi thần kinh ở những người sống sót sau cơn ngừng tim vẫn hôn mê (37,38). Điều này dẫn đến việc áp dụng ngay lập tức hạ thân nhiệt gây ra ở mức 32–34° C cho những người sống sót sau cơn ngừng tim hôn mê. Khoảng 10 năm sau, một nghiên cứu đa trung tâm lớn đã chỉ ra rằng nhiệt độ mục tiêu là 36°C tương đương với 33° C để ảnh hưởng đến kết quả (39) và cũng làm giảm nguy cơ suy giảm huyết động (40). Sau 10 năm nữa, cùng nhóm các nhà điều tra đã chỉ ra rằng nhiệt độ mục tiêu là 37,5° C (nhiệt độ bình thường) tương đương với 33° C để ảnh hưởng đến kết quả (41). Điều này đưa chúng ta đến tình hình hiện tại, khi mục tiêu của việc quản lý nhiệt độ mục tiêu là ngăn ngừa sốt ở những người sống sót sau cơn ngừng tim và hôn mê.
| BẢNG 21.3 Quản lý nhiệt độ mục tiêu | |
| Đặc điểm | Các khuyến cáo† |
| Chỉ định | Nhiệt độ cơ thể ≤37,5° C (≤99,5° F) trong 72 giờ |
| Mục tiêu | Bệnh nhân không tỉnh lại sau ROSC |
| Theo dõi | Theo dõi liên tục nhiệt độ cơ thể lõi; ví dụ, bằng catheter bàng quang được trang bị nhiệt điện trở |
| Kế hoạch | 1. Bệnh nhân bị hạ thân nhiệt nhẹ (32°–36° C) sau khi ROSC không nên được làm ấm lại chủ động. |
†Trích từ tài liệu hướng dẫn số 3.
4.4 Phương pháp
Các đặc điểm nổi bật của quản lý nhiệt độ mục tiêu (TTM) được nêu trong Bảng 21.3 (3,41). Các ứng viên cho TTM bao gồm tất cả các bệnh nhân không tỉnh lại sau khi tuần hoàn tự nhiên trở lại (ROSC) và mục tiêu là duy trì nhiệt độ cơ thể ≤37,5° C (99,5°F) trong 72 giờ sau ROSC hoặc cho đến khi bệnh nhân tỉnh lại. Cần theo dõi liên tục nhiệt độ cơ thể cốt lõi và có thể dễ dàng thực hiện bằng catheter bàng quang có gắn nhiệt điện trở. Chỉ sử dụng thiết bị làm mát có kiểm soát nhiệt độ nếu nhiệt độ cơ thể tăng trên 37,7° C (99,9° F) và nếu điều này xảy ra, cần làm mát bề mặt đủ, với nhiệt độ mục tiêu được đặt ở mức 37,5° C.
Mặc dù có khuyến cáo về TTM nhiệt độ bình thường trong các hướng dẫn thực hành lâm sàng gần đây nhất (3), nhưng vẫn còn sự miễn cưỡng trong việc từ bỏ TTM hạ thân nhiệt và tùy chọn sử dụng nhiệt độ mục tiêu là 33° C vẫn chưa được giải quyết. Tuy nhiên, việc gây hạ thân nhiệt cũng kéo theo một số yếu tố không mong muốn, chẳng hạn như nguy cơ hạ huyết áp (do tình trạng lợi tiểu do lạnh và ức chế tim), nhịp tim chậm (thường gặp trong quá trình hạ thân nhiệt) và run rẩy, thường đòi hỏi phải dùng thuốc an thần mạnh (có thể làm chậm quá trình đánh giá trạng thái tinh thần) và đôi khi đòi hỏi phải ức chế thần kinh cơ (điều này không bao giờ mong muốn).
4.5 Những liên quan khác
Ngoài việc ngăn ngừa sốt, còn có những mối quan tâm khác đối với việc quản lý bệnh nhân trong giai đoạn đầu sau khi ngừng tim. Những điều này được tóm tắt trong Bảng 21.4.
| BẢNG 21.4 Những vấn đề khác trong quản lý sau khi ngừng tim | |
| Can thiệp | Bàn luận |
| Thở oxi | Tăng oxy máu làm trầm trọng thêm tổn thương thần kinh sau khi ngừng tim, do đó chỉ nên sử dụng O2 để điều chỉnh tình trạng thiếu oxy máu (SaO2 <90%). |
| Thuốc co mạch | Duy trì huyết áp động mạch trung bình cao hơn bình thường (ví dụ: ≥75 mm Hg) có thể có lợi cho quá trình phục hồi thần kinh. |
| Chọn thuốc | Norepinephrine được ưa chuộng hơn epinephrine (xem văn bản để biết giải thích) |
| Đường máu | Tăng đường huyết làm trầm trọng thêm tổn thương thần kinh sau khi ngừng tim, nhưng tránh kiểm soát đường huyết quá chặt chẽ vì hạ đường huyết cũng làm trầm trọng thêm tổn thương thần kinh. |
4.6 Oxi liệu pháp
Tăng oxy máu có thể làm trầm trọng thêm tổn thương thần kinh sau khi ngừng tim (42) và chỉ nên sử dụng oxy để điều chỉnh tình trạng thiếu oxy máu (độ bão hòa O2 động mạch <90%) (6). Các gốc oxy phản ứng có liên quan đến tổn thương tái tưới máu sau khi tuần hoàn tự nhiên trở lại (34), đây là một lý do khác để hạn chế thở O2 trong giai đoạn sau khi ngừng tim.
4.7 Quản lý điều trị tụt huyết áp
Chấn thương não do thiếu máu cục bộ có liên quan đến tình trạng tự điều hòa lưu lượng máu não bị rối loạn; trong tình huống này, lưu lượng máu não phụ thuộc vào huyết áp động mạch. Do đó, hạ huyết áp (thường gặp sau khi tuần hoàn tự nhiên trở lại) có thể làm trầm trọng thêm tổn thương não sau ngừng tim và cần được điều trị tích cực. Tuy nhiên, huyết áp tối ưu trong giai đoạn sau ngừng tim vẫn chưa rõ ràng. Mặc dù khuyến cáo chuẩn đối với tình trạng hạ huyết áp là duy trì huyết áp động mạch trung bình (MAP) ≥65 mm Hg (xem Chương 14), các nghiên cứu quan sát cho thấy những bệnh nhân có huyết áp cao hơn trong giai đoạn đầu sau ngừng tim có kết quả thần kinh tốt hơn (43,44). Do đó, việc nhắm mục tiêu vào MAP cao hơn bình thường (ví dụ: ≥75 mm Hg là một cân nhắc hợp lý trong những giờ đầu sau khi tuần hoàn não tự nhiên trở lại.
THUỐC CO MẠCH: Có xu hướng tiếp tục sử dụng epinephrine làm thuốc làm tăng huyết áp cho tình trạng hạ huyết áp sau khi tuần hoàn não tự nhiên trở lại, nhưng có bằng chứng cho thấy norepinephrine có liên quan đến ít ca tử vong do tim mạch hơn và cải thiện kết quả thần kinh khi so sánh với epinephrine (45).
4.8 Kiểm soát đường máu
Tăng đường huyết trong giai đoạn đầu sau ngừng tim có liên quan đến kết quả thần kinh kém (46), do đó cần chú ý đến việc kiểm soát đường huyết. Tuy nhiên, kiểm soát đường huyết chặt chẽ ở những bệnh nhân bệnh nặng có liên quan đến các đợt hạ đường huyết thường xuyên (47), điều này cũng thúc đẩy tổn thương thần kinh, do đó, phạm vi cao hơn bình thường từ 145–180 mg/dL đối với đường huyết được coi là mục tiêu kiểm soát đường huyết hợp lý sau khi ngừng tim (48). Là một biện pháp bổ sung cho thực hành này, có vẻ khôn ngoan khi tránh các Dung dịch tĩnh mạch có chứa dextrose bất cứ khi nào có thể.
4.9 Tiên lượng phục hồi thần kinh
Ở những bệnh nhân không tỉnh lại sau khi tuần hoàn tự nhiên trở lại (ROSC) hoặc kiểm soát nhiệt độ mục tiêu, quyết định quan trọng nhất là khả năng phục hồi thần kinh. Sau đây là mô tả về những gì liên quan đến quyết định này. Các yếu tố dự báo kết quả kém với mức độ chắc chắn cao (tức là ít hoặc không có kết quả dương tính giả) được thể hiện trong Bảng 21.5. (Kết quả kém được định nghĩa là tử vong, hôn mê dai dẳng hoặc trạng thái thực vật, hoặc tàn tật nghiêm trọng.)
| BẢNG 21.5 Các yếu tố dự báo kết quả thần kinh kém với mức độ chắc chắn cao |
| 1. Không có phản xạ ánh sáng đồng tử ở cả hai bên vào ngày thứ 4 sau ROSC. 2. Không có phản xạ giác mạc ở cả hai bên vào ngày thứ 4 sau ROSC. 3. Không có phản xạ mắt đầu (búp bê) hoặc phản xạ nôn vào ngày thứ 2 sau ROSC. 4. Trạng thái rung giật cơ bất kỳ lúc nào sau ROSC. 5. Không có đỉnh N20 ở cả hai bên trên điện thế kích thích cảm giác cơ thể. 6. Điện não đồ cho thấy trạng thái động kinh không co giật hoặc ức chế nền với các đợt phóng điện định kỳ. 7. Chụp CT cho thấy phù não lan tỏa. |
4.10 Thời gian đánh thức
Hầu hết (80–95%) bệnh nhân tỉnh lại sau ROSC đều tỉnh sau 72 giờ (49), nhưng có thể mất 5 ngày hoặc thậm chí lâu hơn để tất cả bệnh nhân tỉnh lại, đặc biệt là những bệnh nhân bị hạ thân nhiệt do gây ra (tức là nhiệt độ mục tiêu là 32–34° C) (50). Nhìn chung, thời gian tỉnh lại có thể là yếu tố dự báo kém về kết quả thần kinh trong tuần đầu tiên sau CPR, đặc biệt là ở những bệnh nhân được dùng thuốc an thần mạnh trong giai đoạn đầu sau ROSC.
4.11 Thăm khám lâm sàng
Những phát hiện duy nhất khi khám lâm sàng có khả năng dự đoán cao về kết quả kém là không có phản xạ thân não. Những phát hiện dự đoán kết quả kém với mức độ chắc chắn cao bao gồm không có phản xạ ánh sáng đồng tử ở cả hai bên hoặc phản xạ giác mạc ở cả hai bên vào ngày thứ 4 sau ROSC và không có phản xạ nôn hoặc phản xạ mắt đầu vào ngày thứ 2 sau ROSC (51). Trái ngược với nhận thức phổ biến, phản ứng duỗi bất thường với cơn đau (tức là tư thế mất não) không có khả năng dự đoán cao về sự phục hồi thần kinh kém (51).
4.12 Rung giật cơ
Sự xuất hiện của chứng rung giật cơ (giật cơ đột ngột, ngắn, không tự chủ) sớm sau ROSC là một dấu hiệu bất lợi, nhưng nó không loại trừ khả năng phục hồi thần kinh. Tuy nhiên, sự xuất hiện của trạng thái động kinh giật cơ bất cứ lúc nào sau ROSC đều dự đoán kết quả kém với độ chắc chắn gần như 100% (51).
4.13 Điện thế gợi lên
Điện thế gợi lên do kích thích cảm giác là phản ứng trung bình trong hệ thần kinh trung ương đối với kích thích thần kinh ngoại biên và được đo trên bề mặt da (giống như EEG). Sự vắng mặt của đỉnh N20 2 bên (từ vỏ não cảm giác somatosensory) với kích thích thần kinh giữa có khả năng dự đoán cao về kết quả kém (51).
4.14 Điện não đồ
Những phát hiện sau đây trên điện não đồ (EEG) có khả năng dự đoán cao về kết quả thần kinh kém: 1) EEG đẳng điện (tức là mọi hoạt động <2 μV); 2) sự hiện diện của trạng thái động kinh không co giật và 3) ức chế nền với các đợt phóng điện định kỳ chồng lên nhau (51).
4.15 Hình ảnh
Chụp cắt lớp vi tính não có thể phát hiện đột quỵ lớn hoặc xuất huyết não kèm thoát vị, cả hai đều cho thấy tiên lượng rất kém. Bằng chứng chụp CT về phù não lan tỏa cũng có khả năng dự đoán cao về kết quả kém, đặc biệt nếu xuất hiện vào ngày thứ 2 hoặc sau đó sau khi ngừng tim (51).
5 LỜI KẾT
Nhận thức so với Thực tế
Hồi sức tim phổi luôn được ưa chuộng hơn nhiều so với mức đáng có. Điều này thể hiện rõ trong các cuộc khảo sát công chúng, trong đó 95% số người được hỏi có kỳ vọng không thực tế về CPR (52), bao gồm niềm tin rằng hơn một nửa số nạn nhân ngừng tim sống sót và trở lại cuộc sống hàng ngày mà không có di chứng nào (53). Các chương trình truyền hình thúc đẩy nhận thức này, trong đó CPR được mô tả là thành công trong 75% trường hợp (54).
Thực tế về CPR khác xa với nhận thức của công chúng, như thể hiện trong Bảng 21.1, cho thấyCPR chỉ có kết quả thành công trong 1–7% trường hợp.
Tại sao điều này lại quan trọng như vậy? Vì bệnh nhân quyết định có thực hiện CPR hay không, nên nhận thức sai lầm, chứ không phải thực tế, đang quyết định việc thực hiện CPR.
6 Tài liệu tham khảo
1. Kouwenhoven WB, Ing, Jude JR, Knickerbocker GG. Closed-chest cardiac massage. JAMA 1960; 173:1064–1067.
2. Tsao CW, Aday AW, Almarzoog ZI, et al. Heart disease and stroke statistics—2023 update: A report from the American Heart Association. Circulation 2023; 147:e93–e621. Clinical Practice Guidelines
3. Wyckoff MH, Greif R, Morley PT, et al. 2022 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations: Summary from the Basic Life Support; Advanced Life Support; Pediatric Life Support; Neonatal Life Support; Education, Implementation and Teams; and First Aid Task Forces. Resuscitation 2022; 208–288.
4. Panchal AR, Bartos JA, Cabañas JG, et al. Adult Basic and Advanced Life Support Writing Group. Part 3: Adult basic and advanced life support: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2020; 142(suppl 2):S366–S468.
5. Travers AH, Perkins GD, Berg RA, et al., on behalf of the Basic Life Support Chapter Collaborators. Part 3: Adult basic life support and automated external defibrillation. 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Circulation 2015; 132(suppl 1):S51–S83.
6. Callaway CW, Soar J, Aibiki M, et al. Part 4: Advanced life support. 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Circulation 2015; 132(suppl1):S84–S145. Instruction Manuals
7. American Heart Association. Basic Life Support Provider Manual. Dallas, TX: American Heart Association, 2016.
8. American Heart Association. Advanced Cardiovascular Life Support Provider Manual. Dallas, TX: American Heart Association, 2016. Basic Life Support
9. Wit L, Kramer-Johansen J, Mykelbust H, et al. Quality of cardiopulmonary resuscitation during out-of-hospital cardiac arrest. JAMA 2005; 293:299–304.
10. Berg RA, Hemphill R, Abella BS, et al. Part 5: Adult basic life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2010; 122 (suppl 3):S685–S705.
11. Aufderheide TP, Lurie KG. Death by hyperventilation: A common and life-threatening problem during cardiopulmonary resuscitation. Crit Care Med 2004; 32(Suppl):S345–S351.
12. Abella BS, Alvarado JP, Mykelbust H, et al. Quality of cardiopulmonary resuscitation during in-hospital cardiac arrest. JAMA 2005; 293:305–310.Advanced Life Support
13. Larsen MP, Eisenberg M, Cummins RO, Hallstrom AP. Predicting survival from out of hospital cardiac arrest: a graphic model. Ann Emerg Med 1993; 22:1652–1658.
14. Koster RW, Walker RG, Chapman FW. Recurrent ventricular fibrillation during advanced life support care of patients with prehospital cardiac arrest. Resuscitation 2008; 78:252–257.
15. Sakai T, Iwami T, Tasaki O, et al. Incidence and outcomes of out-of-hospital cardiac arrest with shock-resistant ventricular fibrillation: Data from a large population based cohort. Resuscitation 2010; 81:956–961.
16. Bartos JA, Carlson K, Carlson C, et al. Surviving refractory out-of-hospital ventricular fibrillation cardiac arrest: critical care and extracorporeal membrane oxygenation management. Resuscitation 2018; 132:47–55.
17. Herlitz J, Ekstrom L, Wennerblom B, et al. Adrenaline in out-of-hospital ventricular fibrillation. Does it make any difference? Resuscitation 1995; 29:195–201.
18. Jacobs IG, Finn JC, Jelineck GA, et al. Effect of adrenaline on survival in out-of-hospital cardiac arrest: A randomized double-blind placebo-controlled trial. Resuscitation 2011; 82:1138–1143.
19. Perkins GD, Ji C, Deakin CD, et al; and the PARAMEDIC2 Collaborators. A randomized trial of epinephrine in out-ofhospital cardiac arrest. N Engl J Med 2018; 379:711–721.
20. Sun S, Tang W, Song F, et al. The effects of epinephrine on outcomes of normothermic and therapeutic hypothermic cardiopulmonary resuscitation. Crit Care Med 2010; 38:2175–2180. Resuscitation Monitoring
21. Rolston DM. Time is running out for manual pulse checks, as ultrasound races past. Resuscitation 2022; 179:59–60.
22. Ochoa FJ, Ramalle-Gomara E, Carpintero JM, et al. Competence of health professionals to check the carotid pulse. Resuscitation 1998; 37:173–175.
23. Kang SY, Jo IJ, Park JE, et al. Point-of-care ultrasound compression of the carotid artery for pulse determination in cardiopulmonary resuscitation. Resuscitation 2022; 179:208–213.
24. Sheak KR, Wiebe DJ, Leary M, et al. Quantitative relationship between end-tidal carbon dioxide and CPR quality during both in-hospital and out-of-hospital cardiac arrest. Resuscitation 2015; 89:149–154.
25. Kolar M, Krizmaric M, Klemen P, Grmec S. Partial pressure of end-tidal carbon dioxide predicts successful cardiopulmonary resuscitation in the field: a prospective observational study. Crit Care 2008; 12:R115.
26. Sanders AB, Kern KB, Otto CW, et al. End tidal carbon dioxide monitoring during cardio- pulmonary resuscitation. JAMA 1989; 262:1347–1351.
27. Wayne MA, Levine RL, Miller CC. Use of end tidal carbon dioxide to predict outcome in prehospital cardiac arrest. Ann Emerg Med 1995;25:762–767.
28. White RD, Goodman BW, Svoboda MA. Neurologic recovery following prolonged out-of- hospital cardiac arrest with resuscitation guided by continuous capnography. Mayo Clin Proc 2011; 86:544–548.
29. Gottlieb M, Alerhand S. Managing cardiac arrest using ultrasound. Ann Emerg Med 2023; 81:532–542.
30. Stritch School of Medicine, medical education curriculum in radiology, at www.stritch.luc.edu, accessed 11/18/2023.
31. Lalande E, Burwash-Brennan T, Burns K, et al. Is point-of-care ultrasound a reliable predictor of outcome during traumatic cardiac arrest? Resuscitation 2021; 167:128–136.
32. Hu K, Gupta N, Teran F, et al. Variability in interpretation of cardiac standstill among physician sonographers. Ann Emerg Med 2018; 71:193–198. Post-Resuscitation Period
33. Nolan JP, Neumar RW, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, and prognostication. A scientific statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke. Resuscitation 2008; 79:350–379.
34. Huet O, Dupic L, Batteux F, et al. Post-resuscitation syndrome: potential role of hydroxyl radical-induced endothelial cell damage. Crit Care Med 2011; 39:1712–1720.
35. Zeiner A, Holzer M, Sterz F, et al. Hyperthermia after cardiac arrest is associated with an unfavorable neurologic outcome. Arch Intern Med 2001; 161:2007–2012.
36. Williams GR, Spencer FC. The clinical use of hypothermia after cardiac arrest. Am Surg 1959; 148: 462–468.
37. The Hypothermia After Cardiac Arrest Study group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002; 346:549–556.
38. Bernard SA, Gray TW, Buist MD, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 2002; 346:557–563.
39. Nielsen N, Wettersley J, Cronberg T, et al; for the TTM Trial Investigators. Targeted temperature management at 33° C versus 36° C after cardiac arrest. N Engl J Med 2013; 369:2197.
40. Bro-Jeppesen J, Annborn M, Hassager C, et al; for the TTM Investigators. Hemodynamics and vasopressor support during targeted temperature management at 33° C versus 36° C after out-of-hospital cardiac arrest: a post hoc study of the target temperature management trial. Crit Care Med 2015; 43:318–327.
41. Dankiewicz J, Cronberg T, Lilja G, et al; for the TTM2 Investigators. Hypothermia versus normothermia after out-of-hospital cardiac arrest. N Engl J Med 2021; 384:2283–2294.
42. Roberts BW, Kilgannon JH, Hunter BR, et al. Association between early hyperoxia exposure after resuscitation from cardiac arrest and neurologic disability: prospective multicenter protocol-directed cohort study. Circulation 2018; 137:2114–2124.
43. Müllner M, Sterz F, Binder M, et al. Arterial blood pressure after human cardiac arrest and neurologic recovery. Stroke 1996; 27:59–62.
44. Kilgannon JH, Roberts BW, Jones AE, et al. Arterial blood pressure and neurologic outcome after resuscitation from cardiac arrest. Crit Care Med 2014; 42:2083–2091.
45. Bougouin W, Slimani K, Renaudier M, et al; for the Sudden Death Expertise Center Investigators. Epinephrine versus norepinephrine in cardiac arrest patients with post- resuscitation shock. Intensive Care Med. 2022; 48(3):300–310.
46. Calle PA, Buylaert WA, Vanhaute OA. Glycemia in the post-resuscitation period. The Cerebral Resuscitation Study Group. Resuscitation 1989; 17(suppl):S181–S188.
47. Marik PE, Preiser J-C. Towards understanding tight glycemic control in the ICU. A systematic review and meta-analysis. Chest 2010; 137:544–551.
48. Peberdy MA, Callaway CW, Neumar RW, et al. Part 9: post-cardiac arrest care. 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2010; 122(suppl 3):S768–S786.
49. Levy DE, Caronna JJ, Singer BH, et al. Predicting outcome from hypoxic ischemic coma. JAMA 1985; 253:1420–1426.
50. Lybeck A, Cronberg T, Aneman A, et al. Time to awakening after cardiac arrest and the association of targeted temperature management. Resuscitation 2018; 126:166–171.
51. Sandroni CD, Arrigo S, Cacciola S, et al. Prediction of poor neurologic outcome in comatose survivors of cardiac arrest: a systematic review. Intensive Care Med 2020; 46:1803–1851. A Final Word
52. Jones GK, Brewer KL, Garrison HG. Public expectations of survival following cardiopulmonary resuscitation. Acad Emerg Med 2000; 7:48–53.
53. Marco CA, Larkin GL. Cardiopulmonary resuscitation: knowledge and opinions among the U.S. general public. State of the science-fiction. Resuscitation 2008; 79:490–498.
54. Diem SJ, Lantos JD, Tulsky JA. Cardiopulmonary resuscitation on television. Miracles and misinformation. N Engl J Med 1996; 334:1578–1582.

