Ảnh hưởng của kiểu gen lên dược động học của thuốc trên cơ thể người

Trungtamthuoc.com - Khi một thuốc được đưa vào cơ thể, nó sẽ trải qua các quá trình hấp thu, phân bố, chuyển hóa, thải trừ. Mỗi quá trình đó đều có sự tham gia của các protein khác nhau và do đó những sự thay đổi về cấu trúc, chức năng hay về cơ chế điều hòa hoạt động của các gen mã hóa những protein đó đều có ảnh hưởng đến đáp ứng thuốc với mức độ khác nhau.
Trường Đại học Dược Hà Nội, Bộ môn Hóa Sinh - Khoa Công Nghệ Sinh Học
CHƯƠNG 5, Trang 64-90, Giáo trình GEN DƯỢC HỌC - ẢNH HƯỞNG CỦA GEN ĐẾN ĐÁP ỨNG THUỐC, Tải PDF sách TẠI ĐÂY
CHỦ BIÊN
PGS.TS. Phùng Thanh Hương
PGS.TS. Đỗ Hồng Quảng
CÁC TÁC GIẢ THAM GIA BIÊN SOẠN
PGS.TS. Phùng Thanh Hương
PGS.TS. Đỗ Hồng Quảng
PGS.TS. Nguyễn Văn Rư
PGS.TS. Nguyễn Thị Lập
TS. Nguyễn Quốc Bình
Phân tích được ảnh hưởng của kiểu gen đối với quá trình được động học của thuốc thông qua các protein tham gia vào quá trình hấp thu, phân bố, chuyển hóa, thải trừ thuốc.
1 Ảnh hưởng của kiểu gen lên sự hấp thu, phân bố, vận chuyển và thải trừ thuốc
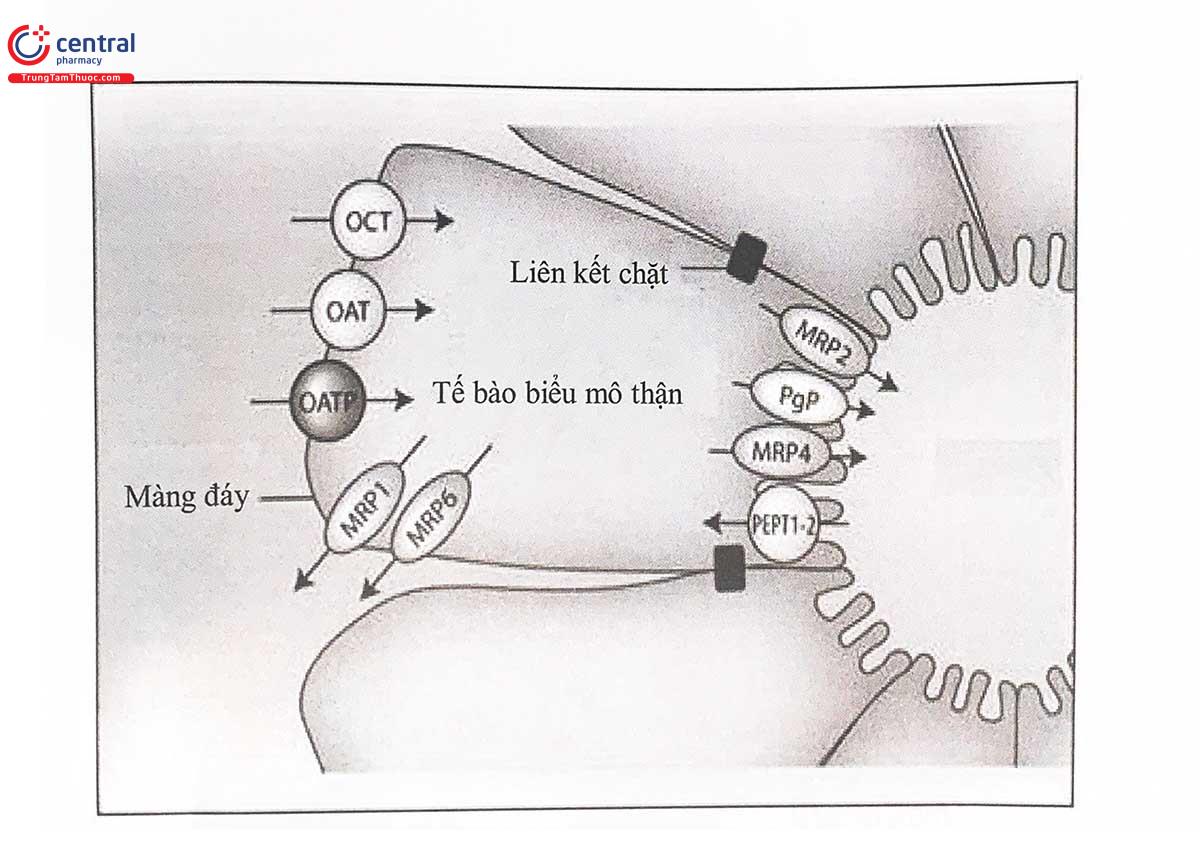
Các protein vận chuyển chịu trách nhiệm đưa thuốc đi qua màng tế bào và các màng sinh học khác có vai trò quan trọng đối với sự hấp thu, phân bố và thải trừ thuốc. Hiện nay, người ta đã phát hiện nhiều protein vận chuyển liên quan đến dược động học của thuốc, đồng thời cũng phát hiện hiện tượng đa hình của nhiều gen mã hóa các protein này. Trong số các loại protein vận chuyển đó, những thay đổi về cấu trúc hoặc chức năng của các bơm tống thuốc (efflux pump) sẽ dẫn đến những khác biệt lớn về đáp ứng thuốc liên quan. Đặc biệt, sự giảm số lượng và hoặc chức năng của các bơm này có thể dẫn đến tăng độc tính thuốc do:
- Giảm hoạt động của bơm tống thuốc ra khỏi cơ thể, dẫn đến tăng sinh khả dụng, giảm khả năng thải trừ qua thận và mật, tăng nồng độ thuốc trong huyết tương, từ đó kéo theo tăng độc tính của thuốc.
Giam hoạt động của bơm tống thuốc ở trên màng tế bào làm tăng nồng độ thuốc nội bảo, tích lũy thuốc dẫn đến tăng độc tính.
Các thuốc bị ảnh hưởng nhiều nhất bởi những bất thường này là các thuốc có phạm vi điều trị hẹp và độc tính cao. Những bất thường liên quan đến các bơm đưa thuốc vào sẽ tạo ra những tác động theo xu hướng ngược lại với các bơm tống thuốc.
Một trong những loại bơm tống thuốc được nghiên cứu nhiều nhất là P-glycoprotein (P-gp), một loại protein vận chuyển thuộc nhóm liên kết ATP. P-gp là nhóm các protein gắn màng có trọng lượng phân tử khoảng 170 kDa. Do P-gp được phát hiện khi người ta quan sát thấy một nhóm glycoprotein có liên quan đến tính thấm qua màng tế bào của một số thuốc ung thư nên các glycoprotein này được đặt tên là P- glycoprotein (P chỉ độ thẩm - Permeability).
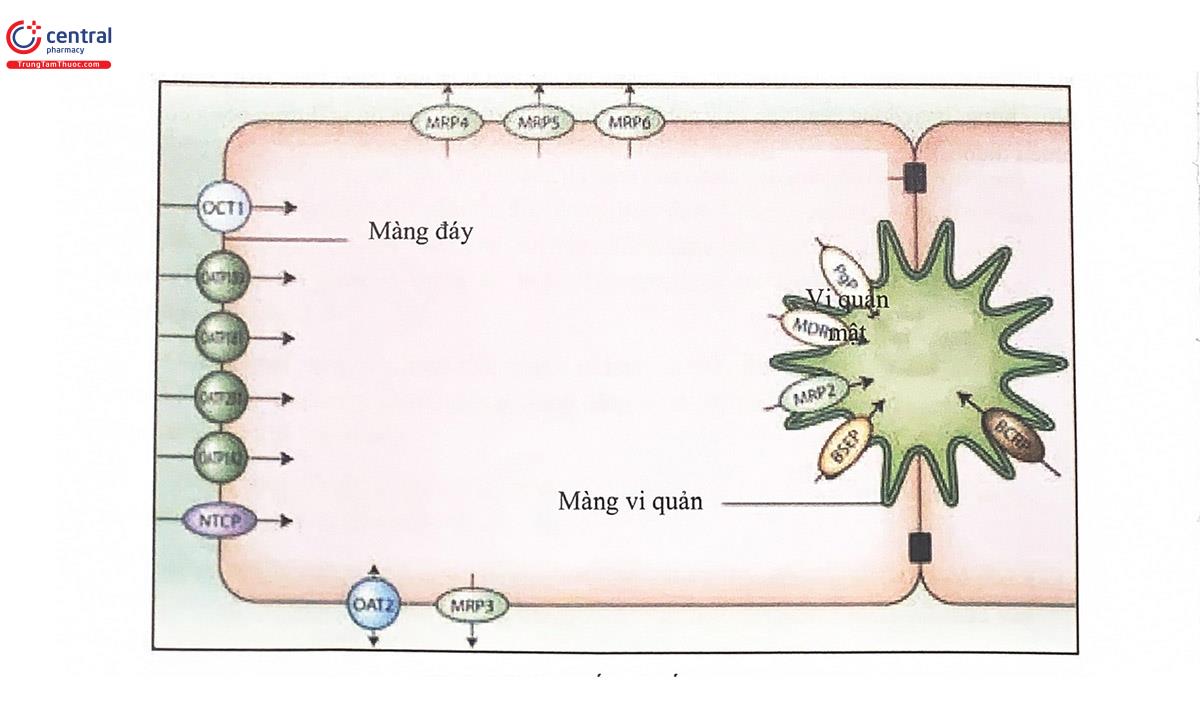
P-gp phân bố ở tất cả các loại mô của người, bao gồm gan, não, tuyến thượng thận, thận, mật, hệ sinh dục, ruột và nhiều tổ chức khác nhưng tập trung nhiều nhất ở rìa bàn chải trên bề mặt tế bào ruột non và trên bề mặt tế bào gan. Ở tá tràng, P-gp thể hiện vai trò của một bơm tống thuốc bằng cách bơm các chất ngoại sinh từ bên trong các tế bào thành ruột trở lại lỏng ống tiêu hóa (chức năng vận chuyển ngược - countertransport) (Hình 5.1). Ở gan, P-gp vận chuyển thuốc từ trong tế bào gan vào ống dẫn mật (Hình 5.2). Ở nhiều loại tế bảo khác, P-gp đóng vai trò của bơm tổng thuốc từ trong tế bảo ra ngoài. Ở hàng rào máu não, P-gp phân bố ở đám rối vi mạch, có tác dụng hạn chế sự tích lũy thuốc ở não. Các thuốc là cơ chất của P-gp bao gồm các thuốc chống ung thư, glycosid tim, thuốc ức chế miễn dịch, glucocorticoid, các thuốc kháng virus... Sự biểu hiện của P- gp ở nhiều mô khác nhau cho thấy vai trò quan trọng của protein vận chuyển này trong sự bài xuất các chất ngoại sinh và các sản phẩm chuyển hóa vào nước tiểu, mật, ruột... Nói chung, hoạt động của P-gp có ý nghĩa đặc biệt đối với Sinh khả dụng đường uống của nhiều thuốc.
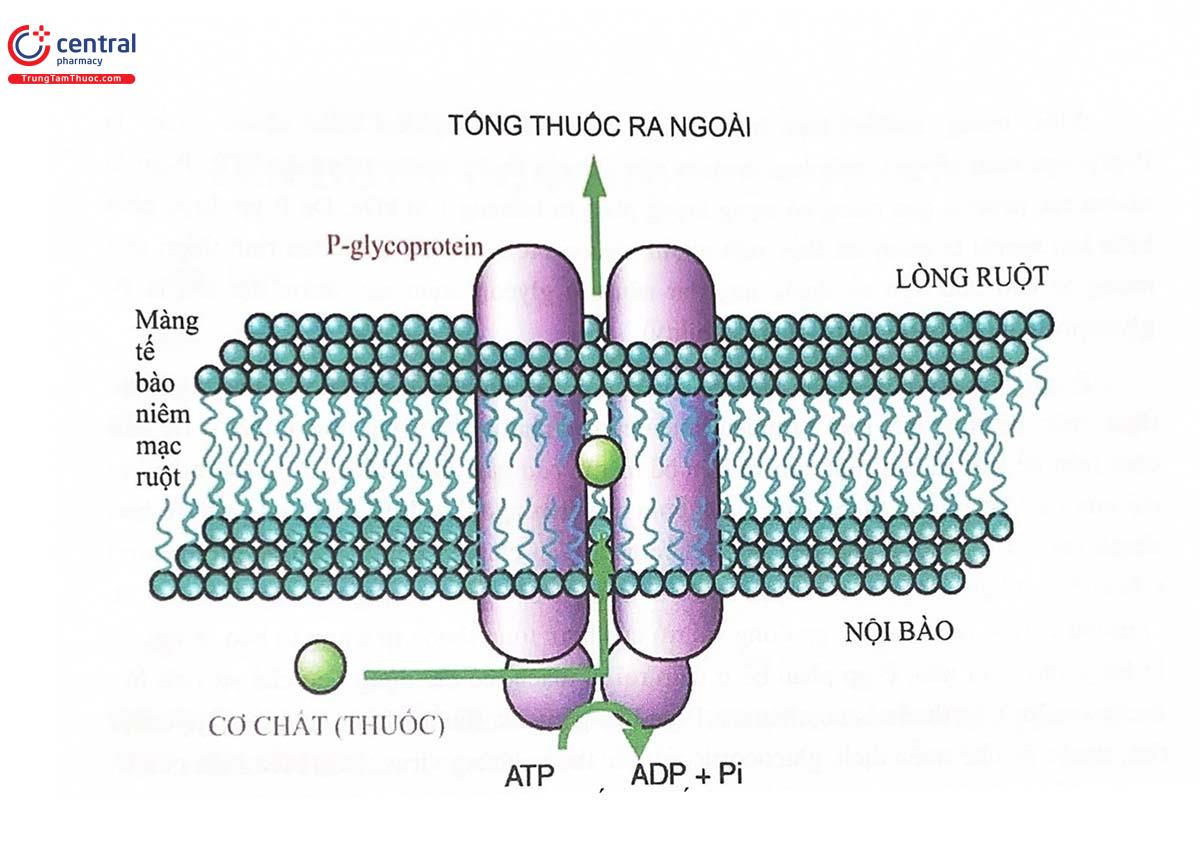
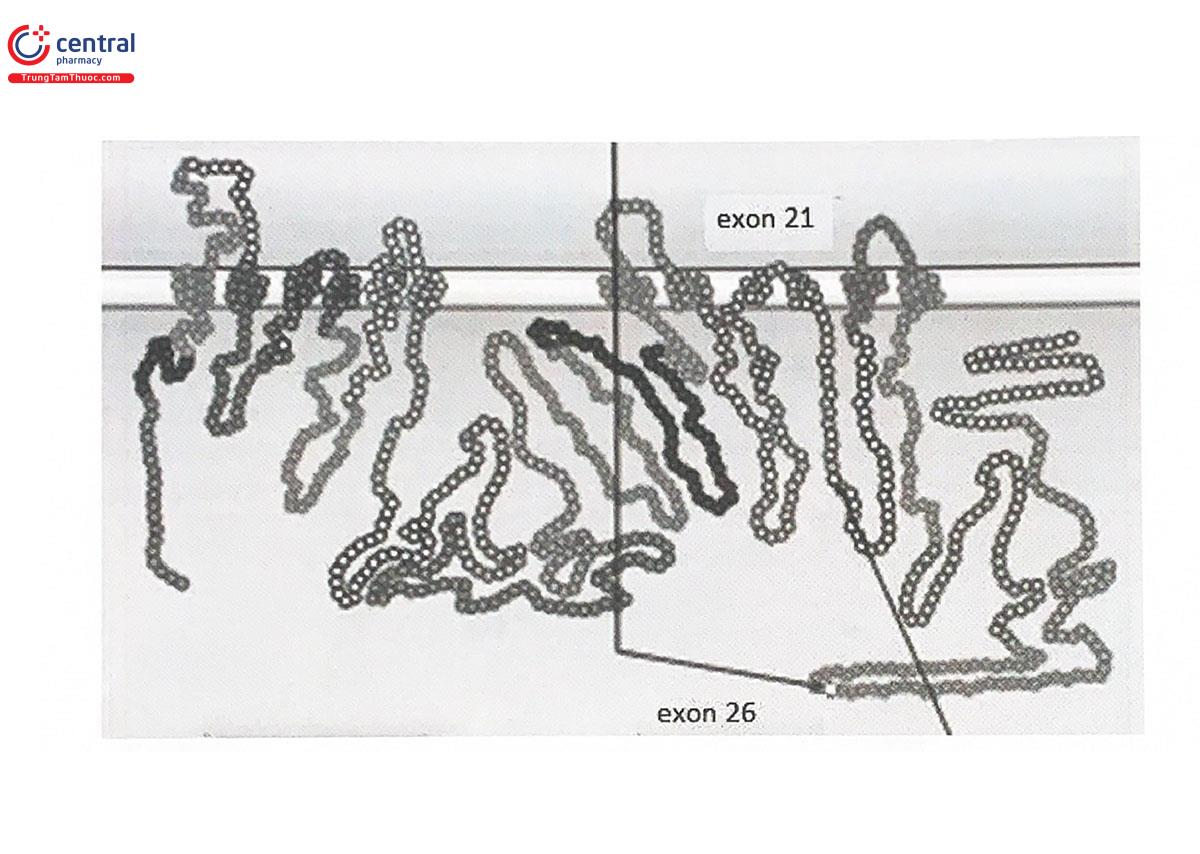
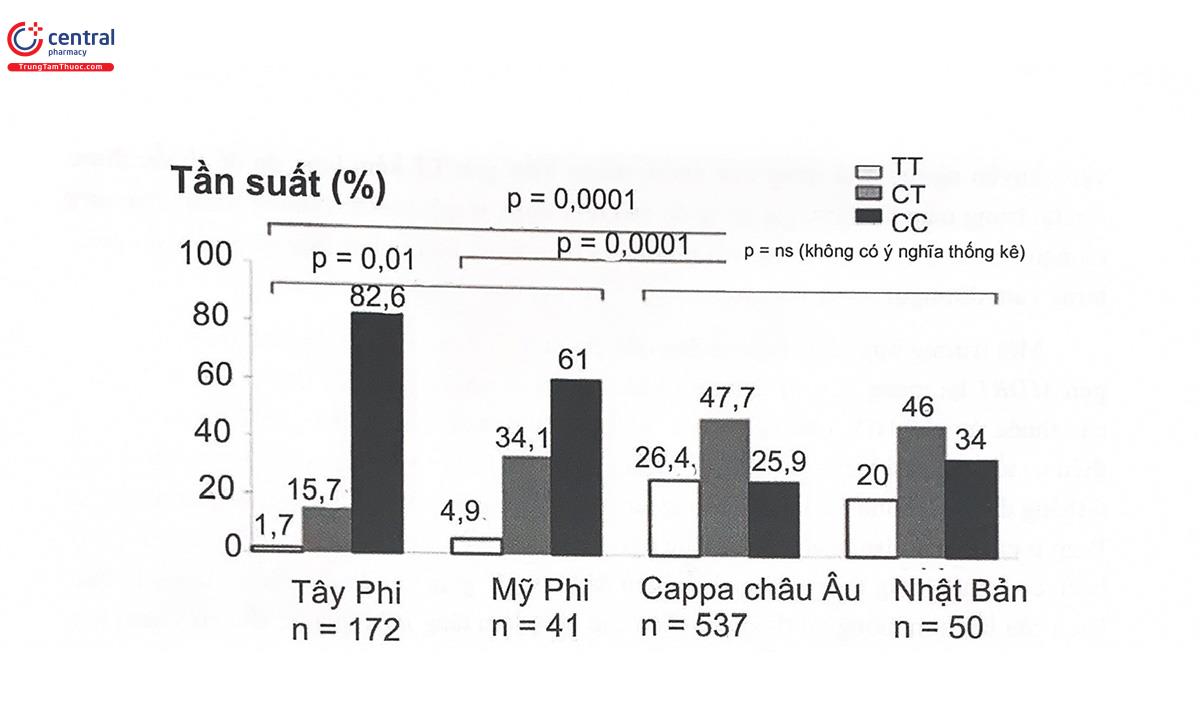
P-glycoprotein được mã hóa bởi gen MDR1 (multiple drug resistance type I) (còn gọi là gen ABCB1 - ATP binding cassette subfamily B member 1) nằm trên nhiễm sắc thể số 7, vùng q21.1. Cho đến nay, người ta đã phát hiện ra hơn 100 biến thể của gen MDRI ở người. Trong số đó, biển thể c.C3435T ở exon 26 được chú ý nhiều nhất, liên quan với nhiều tác dụng không mong muốn của thuốc (Hình 5.4) và xuất hiện với tần suất khác nhau ở các chủng tộc khác nhau (Hinh 5.7). Biển thể này tuy không làm thay đổi trình tự acid amin nhưng dẫn đến sự thay đổi mức độ biểu hiện của P-gp, Kiểu gen thưởng gặp CC có mức độ biểu hiện cao nhất, sau đó đến kiểu gen TC và kiểu gen đa hình đồng hợp tử TT có mức độ biểu hiện thấp nhất. Tuy nhiên, ảnh hưởng trên lâm sàng của sự đa hình gen MDRI khác nhau tùy từng loại thuốc với đặc điểm khác biệt về vị trí hấp thu, phân bố, thải trừ và đích tác dụng.
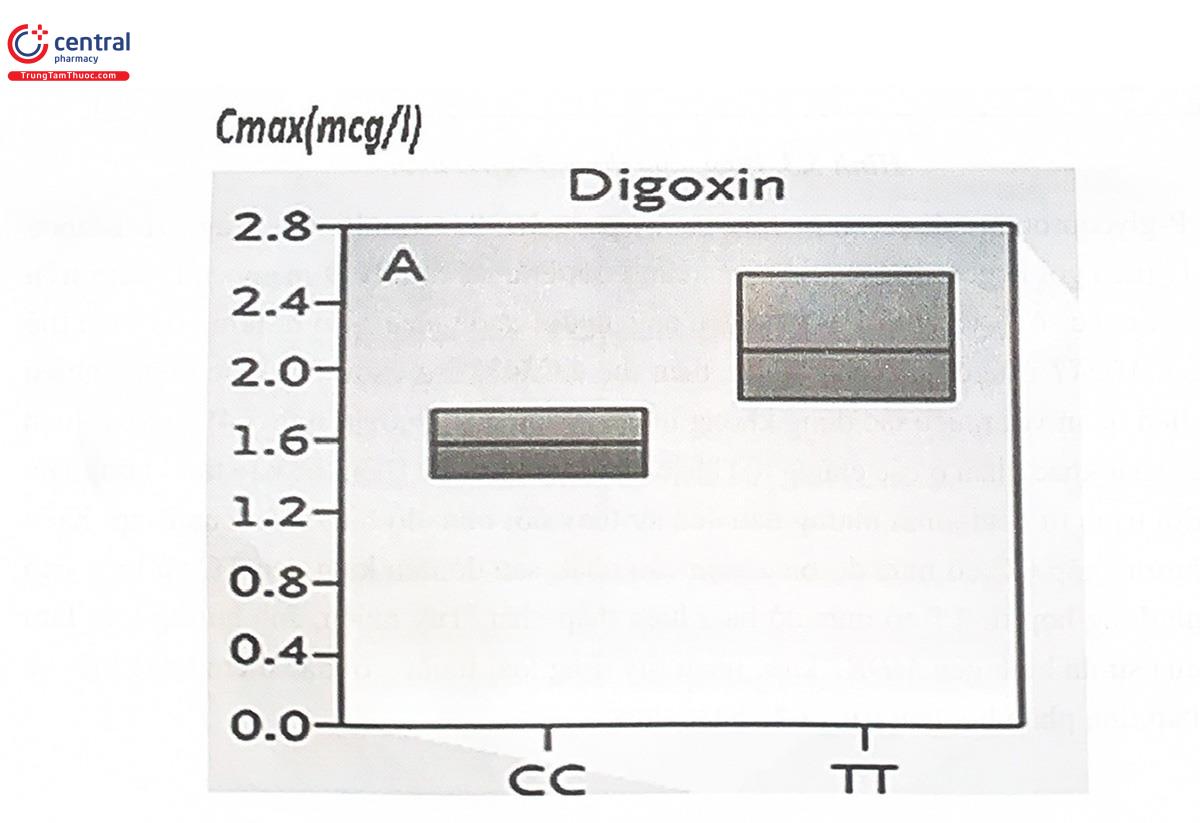
Một nghiên cứu về sự khác biệt trong đáp ứng điều trị với digoxin ở những bệnh nhân có kiểu gen MDRI khác nhau cho thấy những người mang kiểu gen TT có Cmax cao hơn rõ rệt so với kiểu gen CC (Hình 5.5). Điều này được giải thích là do chức năng vận chuyển ngược ở tả trùng của người mang kiểu gen TT kém hơn, do đó thuốc được tồn tại trong máu lâu hơn, đạt nồng độ cao hơn trong huyết tương. Những bệnh nhân này có nguy cơ bị quá liều digoxin với những tại biển nguy hiểm như: loạn nhịp tim, ảo giác, hưng cảm đột ngột...
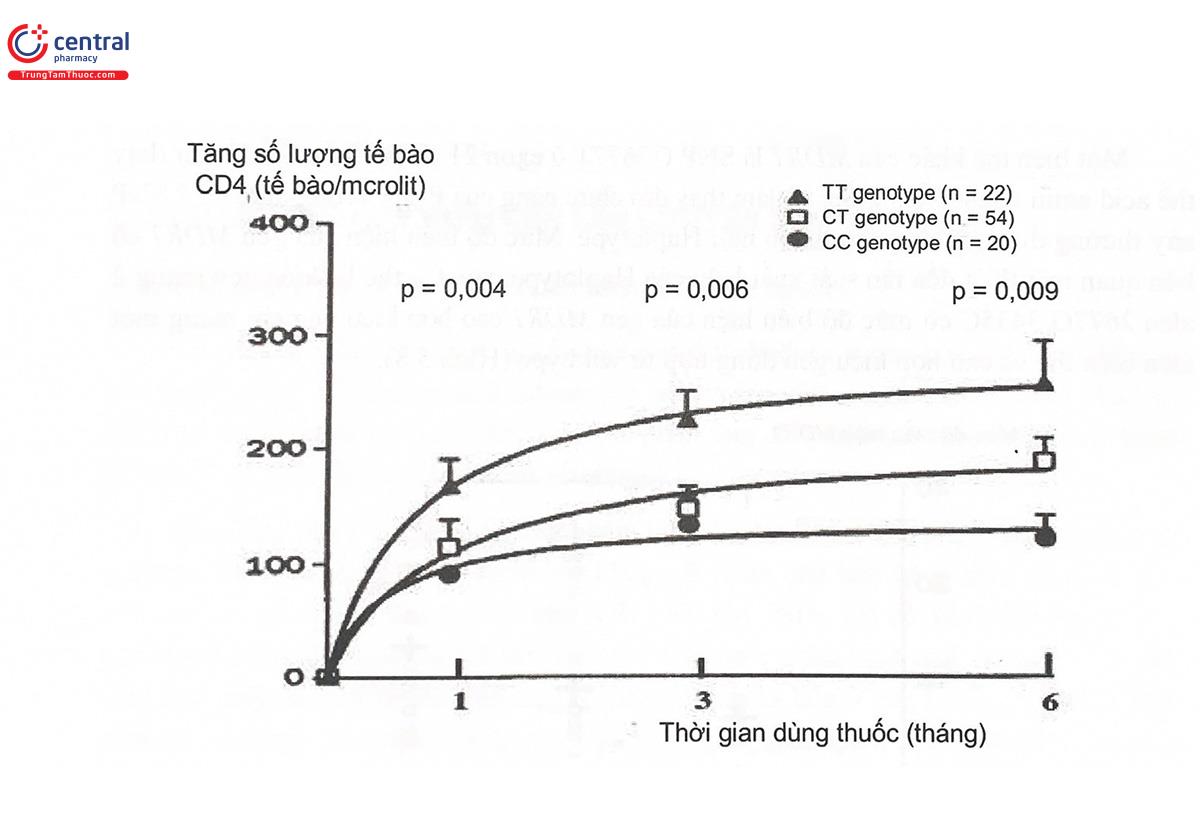
Một trường hợp khác biệt về đáp ứng thuốc liên quan đến sự đa hình ở exon 26 của gen MDR1 lại mang đến sự thay đổi khác về hiệu quả điều trị của thuốc. Đó là đối với các thuốc ức chế HIV như nelfinavir, những bệnh nhân mang kiểu gen TT có đáp ứng điều trị tốt hơn, thể hiện ở sự tăng số lượng bạch cầu CD4÷ và sự giảm số lượng virus sau 6 tháng điều trị (Hình 5.6). Hiện tượng này được ghi nhận cùng với sự giảm biểu hiện của P-gp ở các tế bào bạch cầu trong máu ngoại vi. Như vậy, sự giảm hoạt động của P-gp ở bạch cầu của những người mang kiểu gen đa hình TT giúp cho thuốc tồn tại trong tế bào bạch cầu lâu hơn, nồng độ thuốc nội bào cao hơn, làm tăng hiệu quả ức chế HIV như kết quả ghi nhận trên lâm sàng.
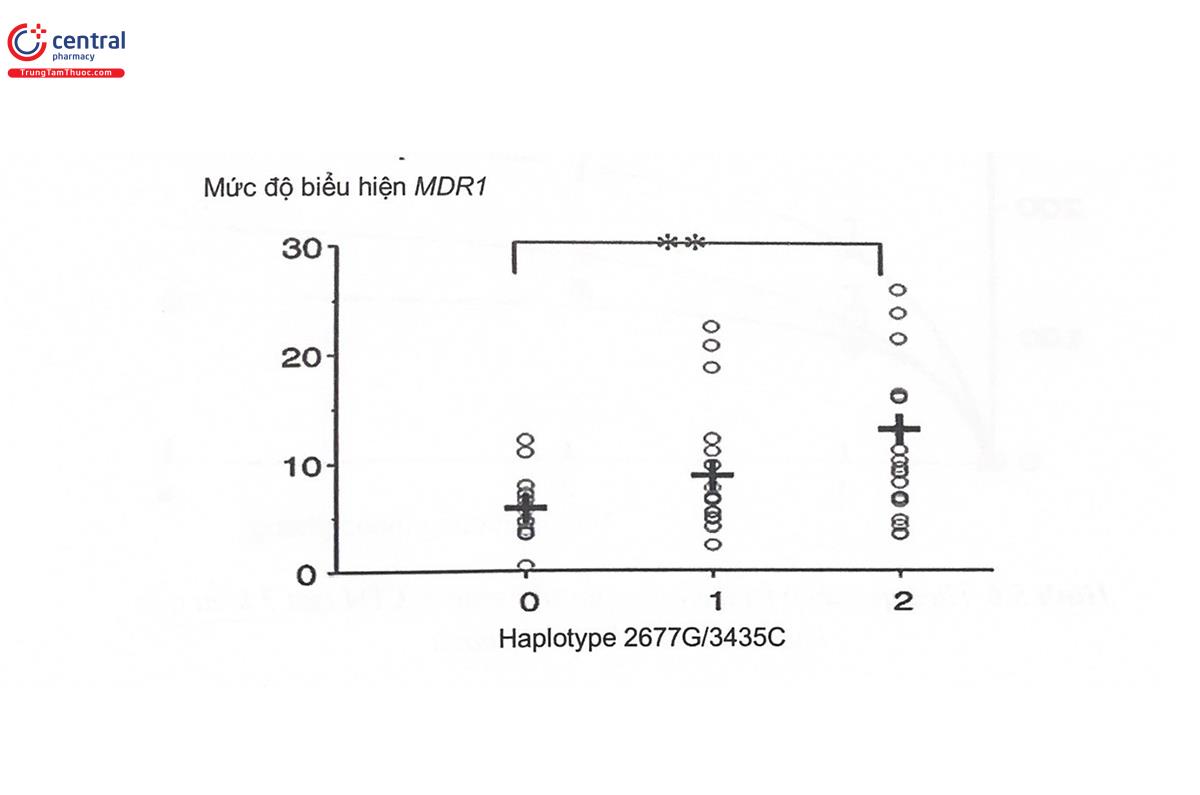
Một biến thể khác của MDR1 là SNP G2677T ở exon 21 (Hình 5,4) dẫn đến sự thay thế acid amin Ala803 bằng Ser và làm thay đổi chức năng của P-gp. Trong thực tế, 2 SNP này thường đi cùng nhau tạo thành một Haplotype. Mức độ biểu hiện của gen MDR1 có liên quan mật thiết đến tần suất xuất hiện của Haplotype này. Cụ thể là, kiểu gen mang 2 alen 2677G/3435C có mức độ biểu hiện của gen MDR1 cao hơn kiểu gen chỉ mang một alen biến thể và cao hơn kiểu gen đồng hợp từ wildtype (Hình 5.8).
Ngoài các ví dụ nêu trên, đa hình gen MDRI còn có thể ảnh hưởng tới đáp ứng của nhiều thuốc khác, đặc biệt là làm tăng tác dụng không mong muốn (Bảng 5.1).
| Bảng 5.1. Một số ví dụ về các thuốc có đáp ứng thay đổi do sự đa hình gen MDRI | |
| Thuốc | Thay đổi đáp ứng với thuốc |
| Nortriptylin | Tăng huyết áp |
| Tacrolimus | Độc tính thần kinh |
| Cyclosporin | Tăng độc tính |
| Ivermectin | Độc tính thần kinh |
| Digoxin | Tăng độc tính |
| Phenytoin | Tăng độc tính |
| Indinavir | Kháng insulin |
2 Ảnh hưởng của kiểu gen lên chuyển hóa thuốc
2.1 Các giai đoạn của quá trình chuyển hóa thuốc
Chuyển hóa thuốc hay còn gọi là sinh chuyển hóa đối với thuốc là quá trình biến đổi của thuốc trong cơ thể dưới ảnh hưởng của enzym tạo nên những chất ít nhiều khác với chất mẹ, được gọi là chất chuyển hóa. Các phản ứng chuyển hóa thuốc được chia thành hai pha (pha I và pha II) xảy ra chủ yếu ở gan.
Phản ứng pha I là các phản ứng nhằm biến đổi thuốc mẹ thành các sản phẩm phân cực hơn (hỏa tan trong nước nhiều hơn) hoặc dễ phản ứng hơn bằng cách để lộ ra hoặc gắn vào các gốc chức năng có cực như -OH, -SH hay -NH2. Do đó, tùy từng trường hợp, các thuốc sau khi chuyển hóa ở pha I có thể tăng hoặc giảm hoạt tính và/ hoặc độc tính. Đặc biệt, một số tiền thuốc (prodrug) phải sau chuyển hóa ở pha I mới trở thành được chất có tác dụng chữa bệnh, ví dụ như các thuốc giảm đau opiat. Pha I bao gồm các phản ứng không liên hợp (còn được gọi là các phản ứng giảng hóa) như phản ứng oxy hóa, phản ứng khử hóa, phản ứng thủy phân, phản ứng hydrat hóa. Số lượng các enzym pha I được biết đến ít hơn các enzym pha II. Hầu hết sự chuyển hóa pha I chủ yếu được thực hiện thông qua các enzym CYP. Các phản ứng pha I bao gồm:
a. Phản ứng oxy hóa
Phản ứng oxy hóa là phản ứng quan trọng và phổ biến nhất không những đối với các chất ngoại sinh mà cả đối với một số chất nội sinh của cơ thể như Estradiol, testosteron, progesteron, cortison... được xúc tác bởi hệ thống enzym oxy hóa đa chức năng (mixed function oxydase enzym system), trong đó chủ yếu là hệ enzym cytochrom P450.
- Oxy hóa sử dụng một nguyên tử oxy: Là những phản ứng được thực hiện chủ yếu microsom nằm trên lưới nội bảo nhẵn, bao gồm:
+ Hydroxyl hóa nhân thơm: Đây là phản ứng rất phổ biến của các hợp chất chứa nhân thơm như lidocain, propanolol, Phenobarbital, acetanilid..
+ Hydroxyl hóa mạch thẳng: Cũng là con đường chuyển hóa thường gặp của nhiều
chất. Ví dụ: Pentobarbiton được cộng hợp nhóm OH ở mạch nhánh 5 carbon.
+Oxy hóa chuỗi thẳng:
RCH3------------------------------------->RCH₂OH
Cơ chất thường thấy của phản ứng này là: Toluen, hexobarbital, pentobarbital, tolbutamid, imipramin...
+ Hydroxyl hóa nhân steroid: Đa số các thuốc cũng như các chất nội, ngoại sinh có bản chất steroid được chuyển hóa theo con đường này.
+ Epoxy hóa; Epoxy thường là trung gian không bền nhưng có thể đủ ổn định để được phân lập từ các hợp chất đa vòng (polycyclic). Carbamazepin, protriplin... là cơ chất của phản ứng này.
+ Khir alkyl:
Phản ứng này xảy ra rất dễ dàng với các thuốc có chứa một amin bậc hai hoặc bậc ba, một nhóm alkoxy hoặc một thiol thay thế alkyl. Các phản ứng này thường được gọi là N-, O- hoặc S-dealkyl, tùy thuộc vào loại nguyên tử chứa nhóm alkyl. Clopromazin, imipramin, Erythromycin, Diazepam, morphin, Griseofulvin, Papaverin, codein... được chuyển hóa theo cách này.
+ Khử amin oxy hóa: Các amin chứa cấu trúc -CH(CH3)-NH2, được chuyển hóa bởi hệ thống enzym oxy hóa đa chức năng của microsom (the microsomal mixed-function oxidase system) để giải phóng ion amoni và tạo ra thể ceton tương ứng.
Ngoài các phản ứng kể trên, các thuốc còn có thể chuyển hóa bằng các loại phân ứng sau: N-oxy hóa, S-oxy hóa (ví dụ đối với chlorpromazin), phosphothion oxy hóa (vi du đối với parathion), khử halogen (ví dụ: halothan bị khử gốc CI và Br thành OH tạo alcohol và acid tương ứng).
- Các phản ứng oxy hóa khác: Là các phản ứng không chịu xúc tác bởi cytochrom P450, không xảy ra ở microsom, bao gồm: Oxy hóa alcol và aldehyd (ví dụ Ethanol, acetaldehyd bị oxy hóa bởi enzym dehydrogenase), oxy hóa xanthin (các cơ chất chứa nhãn xanthin như Cafein và các base purin tương ứng bị oxy hóa tạo dẫn xuất acid uric tương ứng), oxy hóa alkylhydrazin (ví dụ Carbidopa).
b. Phản ứng khử
Gồm các phản ứng: Khử ở nhân thơm (ví dụ nicotin bị khử thành conitin), khi azo (ví dụ prontosil, tartrazin), khử các dẫn xuất nitro (ví dụ clorazepam, Cloramphenicol, methadon), khi các aldehyd (ví dụ cloral hydrat bị khử thành tricloethanol), khử loại halogen (vi du carbon tetraclorid).
c. Phản ứng thủy phân
Các liên kết ester và amid trong các hợp chất ester, amid, hydrazid, carbamat bị thủy phân dưới tác dụng của các enzym esterase và amidase có trong huyết tương, gan, thành ruột và các mô khác. Các phản ứng thủy phân bao gồm phản ứng thủy phân liên kết ester (procain, succinylcholin, Aspirin, clofibrat...), thủy phân liên kết amid (procainamid, lidocain, Indomethacin), thủy phân các liên kết hydrazid và carbamat (isoniazid).
d. Phản ứng hydrat hóa
Hydrat hóa có thể được coi là một hình thức đặc biệt của thủy phân khi cộng hợp nước vào hợp chất mà không gãy phân tách hợp chất. Các epoxid rất dễ bị hydrat hóa tạo dihydrodiol.
Ngoài ra, còn có các phản ứng pha I khác ít gặp hơn như phản ứng đóng vòng thơm, phản ứng dime hóa, phản ứng isome hóa, phản ứng N-carboxyl hóa...
Các phản ứng chuyển hóa pha II đều là các phản ứng liên hợp: Một phân tử nội sinh (acid glucuronic, glutathion, sulfat, glycin, acetyl) sẽ ghép với một nhóm hóa học của thuốc để tạo thành các phức hợp tan trong nước nhằm dễ đào thải ra khỏi cơ thể. Do đó, các enzym pha II còn được gọi là các enzym liên hợp hay các enzym khử độc. Thông thường, các phản ứng ở pha I sẽ tạo ra các nhóm chức cần thiết cho các phản ứng ở pha II, đó là nhóm -OH, -COOH, -NH2, -SH... Các phản ứng liên hợp đòi hỏi năng lượng và cơ chất nội sinh. Các enzym tham gia chuyển hóa thuốc ở pha II chủ yếu là các enzym vận chuyển (transferase) xúc tác cho các phản ứng liên hợp. Phản ứng liên hợp được thực hiện nhờ các transferase nằm trong microsome hay trong dịch bảo tương (Bảng 5.2).
| Loại phản ứng | Cơ chất nội sinh | Enzym chuyển vị trí | Loại cơ chất | Ví dụ các thuốc liên quan |
| Liên hợp với acid glucuronic | Acid UDP glucuronic | UDP glucuronosyl transferase (microsom) | Phenol, alcol, acid carboxylic, sulfonamide | Morphin, diazepam, digitoxin, Acetaminophen, sulfathiazol |
| Liên hợp với các chất mang nhóm thiol (- SH) | Glutathion | GSH-S- transferase (dịch bào tương. microsom) | Epoxid, nhóm nitro hydroxylamin | Acid ethacrynic bromobenzen |
| Liên hợp với glycin | Glycin | Acyl-CoA transferase (ty thể) | Dẫn xuất acyl- CoA của acid carboxylic | Acid salicylic, Acid benzoic, acid nicotinic, acid cholic |
| Liên hợp với acid sulfuric | Phosphoadenosyl phosphosulfat | Sulfotransferase (dịch bào tương) | Phenol, alcol, các amin vòng thơm | Estron, anilin, Methyldopa, 3-OH cumarin, acetaminophen |
| Methyl hóa | S-adenosyl methionin | Transmethylase (dịch bào tương) | Catecholamin, phenol amin, histamin | Dopamin, adrenalin, pyridin, histamin |
| Acetyl hóa (liên hợp với acid acetic) | Acetyl-CoA | N- acetyltransferase (dịch bào tương) | Các amin | Sulfonamid, isoniazid, clonazepam, dapson |
Sau khi chuyển hóa qua pha II, thuốc thường trở thành chất có khối lượng phân tử lớn hơn đáng kể so với chất ban đầu và còn ít tác dụng. Các enzym chuyển hóa pha II quan trọng tập trung chủ yếu ở gan và ruột non, bao gồm các loại sau: Uridine diphosphate-glucuronosyltransferase, sulfotransferases, acetyltrans-terases, catechol-O- methyltransferase và Glutathione S-transferase.
2.2 Ảnh hưởng của kiểu gen lên sự chuyển hóa thuốc pha I
2.2.1 Ảnh hưởng của kiểu gen mã hóa CYP
Trong số các enzym chuyển hóa thuốc pha I, các enzym cytochrom P450 (CYP) có vai trò quan trọng nhất, xúc tác phản ứng chuyển hóa pha I của đa số thuốc và cũng là những enzym chuyển hóa thuốc được nghiên cứu nhiều nhất. Trong toàn bộ hệ gen người, có 57 gen mã hóa CYP. Các isozym được sắp xếp thành họ và mỗi họ lại được chia nhỏ thành các phân họ dựa theo sự tương đồng của chuỗi acid amin trong phân tử, trình tự này trong các họ có ít nhất 40% giống nhau và trong các phân họ có ít nhất 55% giống nhau. Mỗi họ được ký hiệu bởi một số (ví dụ CYP3), mỗi phân họ được ký hiệu bởi một chữ cái viết hoa (ví dụ CYP3A) và gen đơn hoặc isozym được biểu thị bởi số thứ hai (như CYP3A4). Ngoài ra, người ta còn dùng chữ số thứ ba (được ngăn cách với chữ số hiển thị isozym cụ thể bởi một dấu hoa thị (*) để thể hiện số thứ tự alen (dạng biến đổi của gen) (Hình 5.9).
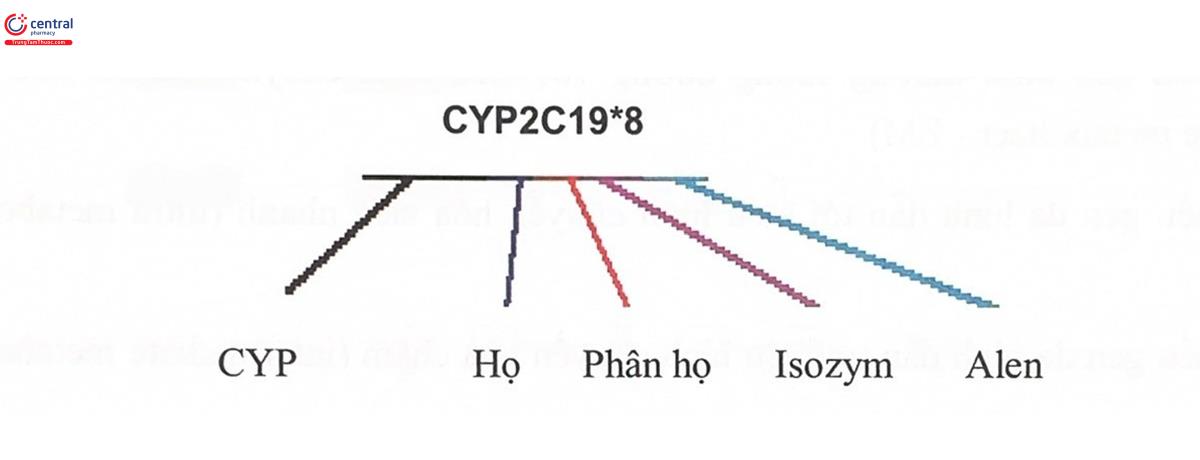
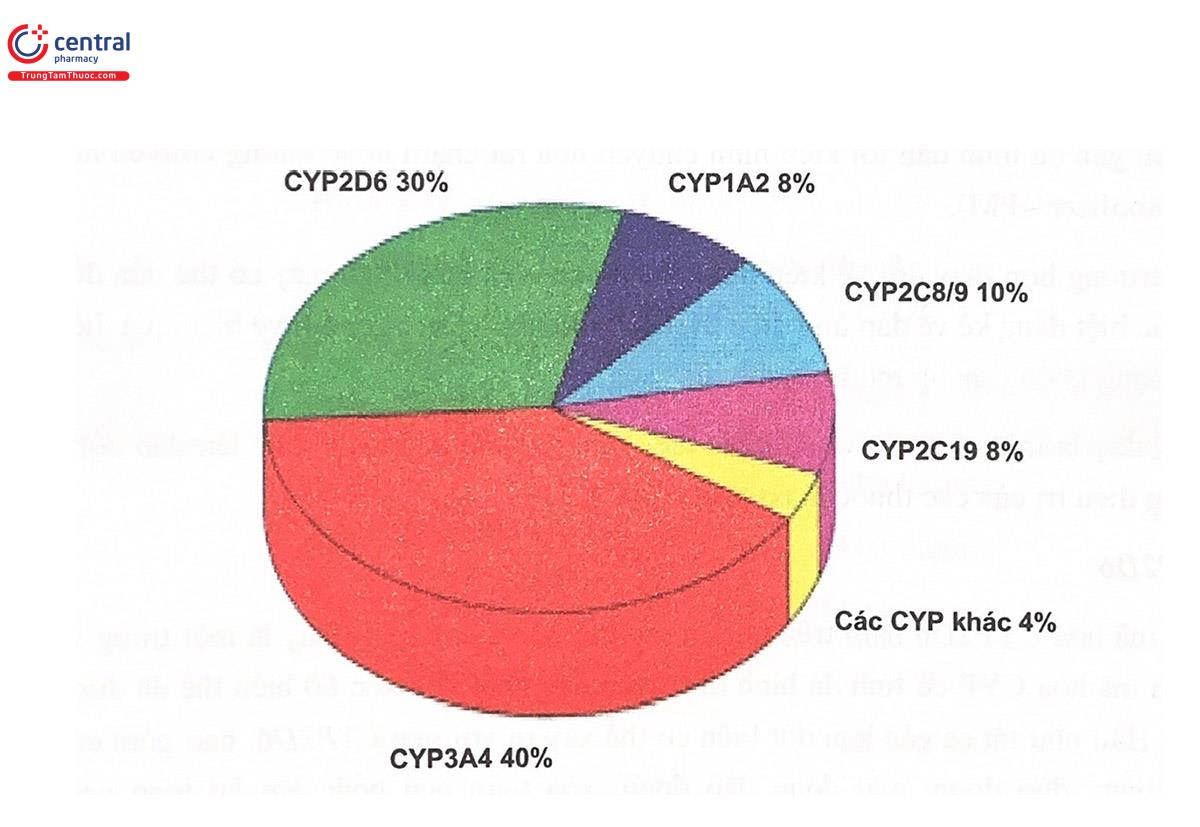
Trong các họ CYP được phân loại, chỉ có 3 họ CYP là CYP1, CYP2, CYP3 đảm nhiệm chuyển hóa phần lớn các thuốc, trong đó chỉ có 6 enzym chịu trách nhiệm hơn 90% quá trình oxy hóa thuốc ở người là LA2, 344, 2C9, 2C19, 2D6 và 2E1 (Hình 5,10). Các isozym CYP khác lại đóng vai trò quan trọng với chuyển hóa một hoặc vải thuốc đặc biệt. Ví dụ, CYP2B6 chịu trách nhiệm xúc tác chuyển hóa methadon và một số thuốc kháng retrovirus. Trong số enzym họ CYP, các enzym thực hiện những chức năng nội sinh quan trọng thưởng có tính bảo thủ cao (ít thay đổi về mặt di truyền). Ngược lại, những enzym tham gia chuyển hóa các chất ngoại sinh (trong đó có enzym chuyển hóa thuốc) thường có tính đa hình cao, trong số đó, những kiểu gen đa hình có ý nghĩa lâm sàng nhiều nhất là các kiểu gen của CYP2D6, CYP2C9 và CYP2C19.
Gen mã hóa CYP2D6, CYP2C9 và CYP2C19 là những gen có tính đa hình cao giữa các quần thể người, dẫn đến sự đa dạng về kiểu hình tương ứng. Đối với các gen mã hóa CYP, các trường hợp đa hình về kiểu gen có thể dẫn tới 4 loại kiểu hình tương ứng:
- Kiểu gen bình thường tương đương với kiểu hình enzym chuyển hóa nhanh (extensive metabolizer - EM).
- Kiểu gen đa hình dẫn tới kiểu hình chuyển hóa siêu nhanh (ultra metabolizer - UM).
- Kiểu gen đa hình dẫn tới kiểu hình chuyển hóa chậm (intermediate metabolizer - IM).
- Kiểu gen đa hình dẫn tới kiểu hình chuyển hóa rất chậm hoặc không chuyển hóa (poor metabolizer - PM).
Các trường hợp thay đổi về kiểu hình enzym chuyển hóa thuốc này có thể dẫn đến những khác biệt đáng kể về đáp ứng điều trị, bao gồm những sự thay đổi về hiệu quả điều trị và tác dụng không mong muốn của thuốc.
Dưới đây là một số ví dụ về sự khác biệt kiểu gen mã hóa CYP dẫn đến dao động về đáp ứng điều trị của các thuốc là cơ chất của CYP.
CYP2D6
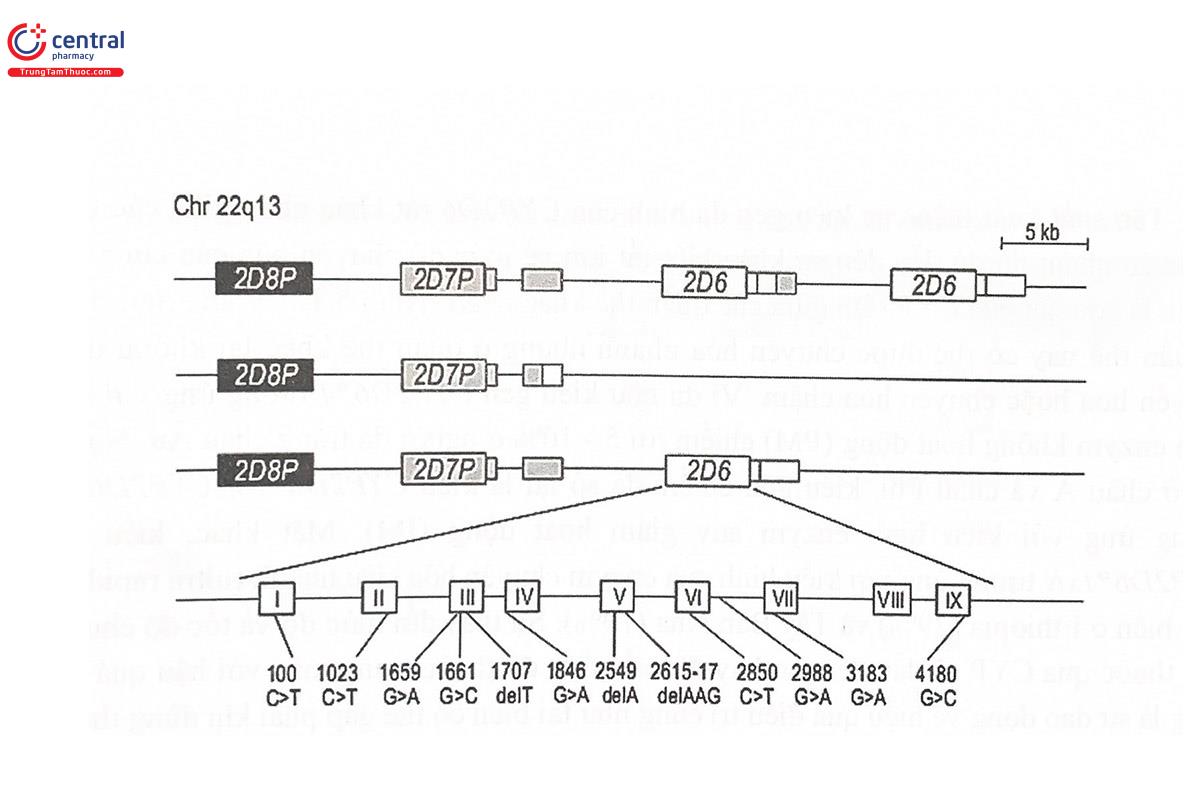
Gen mã hóa CYP2D6 nằm trên nhiễm sắc thể 22 vùng q13.1. Đây là một trong số những gen mã hóa CYP có tính đa hình di truyền cao nhất với trên 60 biến thể đã được phát hiện. Hầu như tất cả các loại đột biến có thể xảy ra với gen CYP2D6, bao gồm các đột biến điểm, đảo đoạn, mất đoạn, lặp đoạn, xóa toàn gen hoặc lặp lại toàn gen, Haplotype... (Hình 5.11). Mỗi loại biến đổi về kiểu gen lại tương ứng với một kiểu hình khác nhau về hoạt tính enzym chuyển hóa (Bảng 5.3).
| Bảng 5.3. Các trường hợp đa hình về kiểu gen và kiểu hình tương ứng của CYP2D6 | |||
| Alen | Loại đột biến | Hoạt tính CYP2D6 | Phân loại kiểu hình |
| *1 | Bình thường | EM | |
| *2 | 2850C>T,4180G>C | Bình thường | EM |
| *3 | 2549delA | Mất hoạt tính | PM |
| *4 | 1846G>A | Mất hoạt tính | PM |
| *5 | Hủy toàn gen | Mất hoạt tính | PM |
| *6 | 1707delT | Mất hoạt tính | PM |
| *9 | 2615-2617delAAG | Giảm hoạt tính | IM |
| *10 | 100C>T | Giảm hoạt tính | IM |
| *39 | 1661G>C, 4180G>C | Bình thường | EM |
| *1xN | Nhân đội toàn gen | Tăng hoạt tính | UM |
| *2xN | Nhân đội toàn gen (+2850C>T, 4180G>C) | Tăng hoạt tính | UM |
| *4xN | Nhân đội toàn gen (+1846G>A) | Mất hoạt tính | PM |
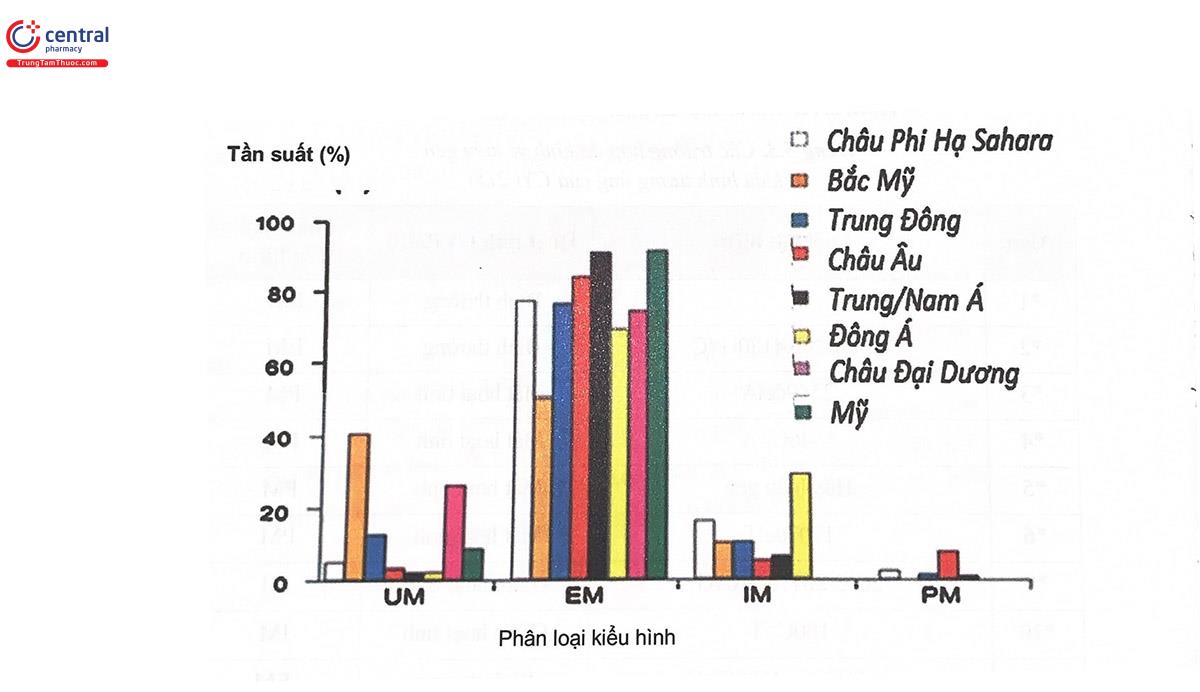
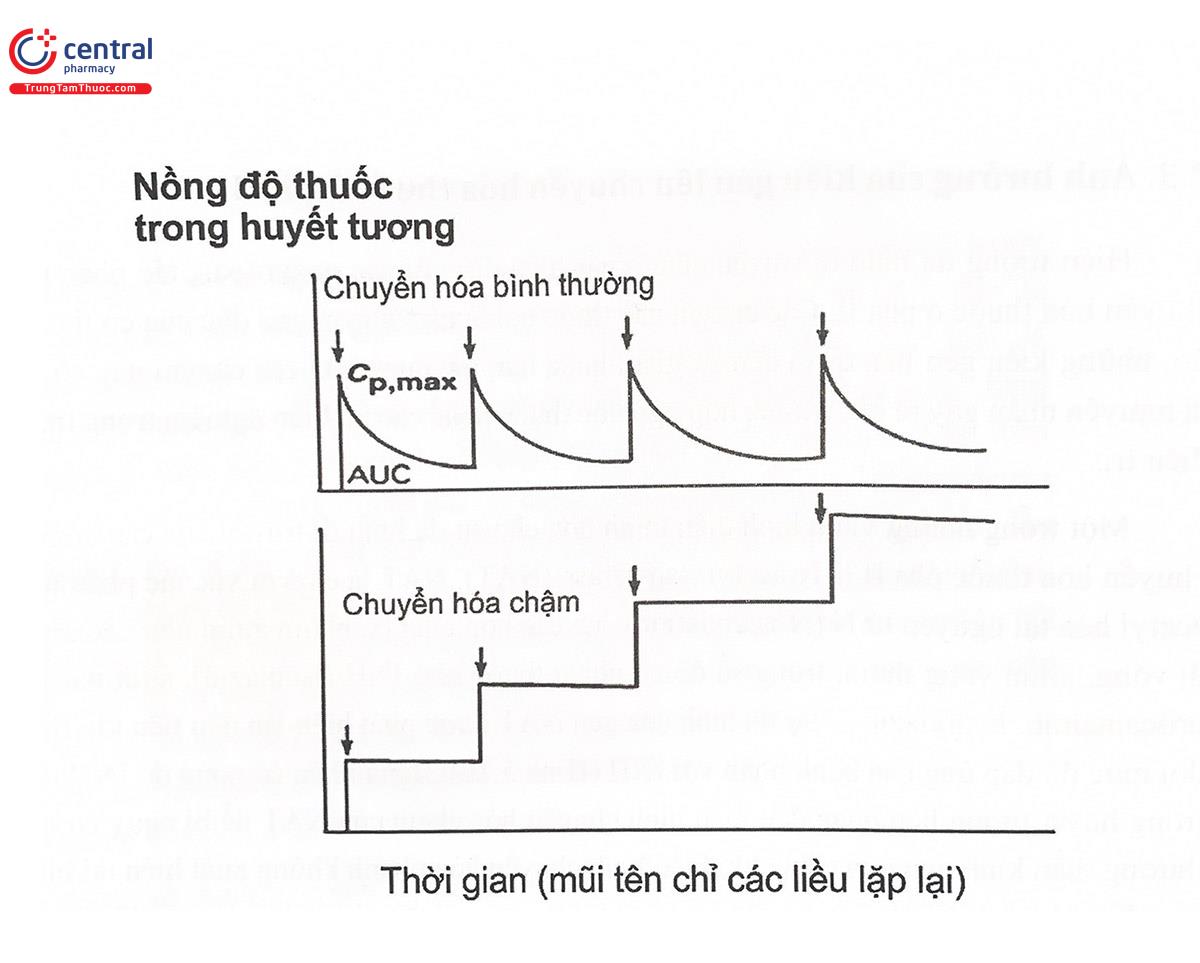
Tần suất xuất hiện các kiểu gen đa hình của CYP2D6 rất khác nhau giữa các quần thể khác nhau, do đó dẫn đến sự khác biệt rất lớn về mức độ chuyển hóa của cùng một thuốc là cơ chất của CYP2D6 giữa các quần thể khác nhau (Hình 5.12). Cùng một thuốc ở quần thể này có thể được chuyển hóa nhanh nhưng ở quần thể khác lại không được chuyển hóa hoặc chuyển hóa chậm. Ví dụ như kiểu gen CYP2D6*4 tương ứng với kiểu hình enzym không hoạt động (PM) chiếm tới 5 - 10% ở người da trắng châu Âu, Ngược lại, ở châu Á và châu Phi, kiểu gen chiếm đa số lại là kiểu CYP2D6*10. CYP2D6*17 tương ứng với kiểu hình enzym suy giảm hoạt động (IM). Mặt khác, kiểu gen CYP2D6*1xN tương ứng với kiểu hình của enzym chuyển hóa siêu nhanh (ultra rapid) lại phổ biến ở Ethiopia (29%) và Tây Ban Nha (10%). Sự thay đổi mức độ và tốc độ chuyển hóa thuốc qua CYP sẽ dẫn đến sự thay đổi về nồng độ thuốc trong máu với hậu quả lâm sàng là sự dao động về hiệu quả điều trị cũng như tại biến có thể gặp phải khi dùng thuốc.
| Bảng 5.4. Một số nhóm thuốc chịu ảnh hưởng của sự đa hình gen CYP2D6 | |
| Tên nhóm điều trị | Tên thuốc |
| Chống loạn nhịp | Encainid Flecainid S-mexiletin Lidocain |
| Chống loạn thần | Perphenazin Thioridazin Haloperidol Risperidon Venlafaxin Fluvoxamin |
| Chống trầm cảm | Fluoxetin Amitryptilin Despiramin Clomipramin Imipramin |
| Giảm đau/ giảm ho | Dextromethorphan Codein Tramadol |
| Chẹn beta | S-metoprolol Propanolol Tinolol Alprenolol Bufuralol Carvedilol |
| Các thuốc khác | Debrisoquin Amphetamin Dexfenfluramin Quanoxan Ondansetron |
Dưới đây là một số ví dụ về ảnh hưởng của kiểu gen CYP2D6 đến đáp ứng điều trị của một số nhóm thuốc.
CYP2D6 và đáp ứng với codein
Codein là một thuốc giảm đau họ opioid. Thực chất codein là một tiền thuốc, tác dụng giảm đau là nhờ chuyển thành dạng có hoạt tính (morphin) thông qua phản ứng khử o-methyl dưới sự xúc tác của enzym CYP2D6. Chỉ khoảng 5 - 10% codein được chuyển hóa theo con đường này, số còn lại chuyển thành dạng không có hoạt tính đảo thái ra ngoài. Tuy nhiên, ở những người mang kiểu gen đa hình CYP2D6 dẫn đến tăng hoạt tính chuyển hóa, lượng codein tạo thành có thể tăng lên đáng kể. Ngược lại, những người có hoạt tính CYP2D6 giảm sẽ có thể không đạt được hiệu quả điều trị với codein do giảm sự tạo thành morphin. Theo khuyến cáo của FDA, trên nhãn thuốc chứa codein phải có khuyến cáo: “đã xảy ra trường hợp tử vong ở người có kiểu hình siêu chuyển hóa CYP2D6 dùng codein. Trẻ em mang kiểu hình này dùng codein sau cắt amydan/ VA có thể bị ức chế hô hấp và thậm chí tử vong". Ủy ban thực hành gen được trong lâm sàng (CPIC) đã đưa ra khuyến cáo sử dụng codein ở các kiểu hình CYP2D6 khác nhau (Bảng 5.5).
| Kiểu hình | Hoạt tính enzym CYP2D6 | Kiểu gen | Khuyến cáo dùng codein |
| UM (1-2% bệnh nhân) | Tăng hoạt tính enzym, tăng tạo thành Morphin sau khi dùng codein, dẫn đến tăng độc tính | Có nhiều hơn 2 bản copy của alen tương ứng với kiểu hình hoạt tính bình thường *1/*1xN *1/*2xN | Tránh dùng codein Cần chọn một thuốc giảm đau khác không bị ảnh hưởng bởi CYP2D6 |
| EM (77 - 92% bệnh nhân) | Hoạt tính enzym bình thường | 2 alen tương ứng với kiểu hình hoạt tính bình thường hoặc 2 alen tương ứng kiểu hình giảm hoạt tính hoặc 1 alen tương ứng với kiểu hình hoạt tính bình thường và 1 alen tương ứng kiểu hình giảm hoạt tính (*1/*1, *1/*2, *2/*2, *1/*41, *1/*4,*2/*5, *1/*10) | Sử dụng theo khuyến cáo trên nhãn thuốc, liều dùng căn cứ theo tuổi cân nặng |
| IM (2-11% bệnh nhân) | Giảm hoạt tính enzym, giảm tạo thành morphin | 1 alen tương ứng kiểu hình giảm hoạt tính và 1 alen tương ứng kiểu hình mất hoạt tính (*4/*10, *5/*41) | Sử dụng theo khuyến cáo trên nhãn thuốc, liều dùng căn cứ theo tuổi/ cân nặng. Nếu không đáp ứng, cần thay thuốc khác không chịu ảnh hưởng của CYP2D6 |
| PM (5-10% bệnh nhân) | Hoạt tính thấp hoặc mất hoàn toàn, lượng morphin tạo thành không đủ để cho tác dụng giảm đau | 2 alen tương ứng kiểu hình giảm hoạt tính (*4/*4, *4/*5, *5/*5, 4/*6) | Cần thay thuốc khác không chịu ảnh hưởng của CYP2D6 |
CYP2D6 và đáp ứng điều trị ung thư
Sự đa hình di truyền của gen mã hóa CYP2D6 có ảnh hưởng đáng kể đến sự đáp ứng điều trị với thuốc chữa ung thư. Tamoxifen là thuốc được sử dụng rộng rãi để điều trị ung thư vú thể đáp ứng với receptor của estrogen. Thực chất, tamoxifen là tiền thuốc, dưới tác dụng của CYP2D6, nó được chuyển hóa thành các dược chất endoxifen và 4- hydroxytamoxifen. Những bệnh nhân mang kiểu gen tương ứng với kiểu hình CYP2D6 hoạt động kém có nguy cơ tái phát ung thư vú cao hơn, sớm hơn và tỷ lệ sống sót thấp hơn so với các bệnh nhân có kiểu hình enzym hoạt động bình thường. Ứng dụng của xét nghiệm gen CYP2D6 trong điều trị ung thư vú sẽ được phân tích sâu hơn trong Chương 14.
Việc tầm soát tỉnh đa hình của gen CYP2D6 cũng có ý nghĩa quan trọng đối với việc điều trị triệu chứng buồn nôn, nôn nghiêm trọng ở các bệnh nhân ung thư phải dùng hóa trị liệu. Các thuốc chống nôn thường dùng là các thuốc đối kháng receptor serotonin typ 3 (tropisetron, Ondansetron), các thuốc này chuyển hóa chủ yếu qua CYP2D6. Những bệnh nhân có kiểu gen tương ứng với kiểu hình CYP2D6 chuyển hóa siêu nhanh (UM) sẽ phải dùng tăng liều hoặc thay thuốc.
CYP2D6 và đáp ứng với các thuốc hướng thần
Các bệnh lý về tâm thần, thần kinh như trầm cảm hoặc tâm thần phân liệt là một trong những nguyên nhân hàng đầu gây tử vong hoặc mất khả năng hoạt động. Mặc dù hiện nay đã có nhiều loại thuốc chống trầm cảm và chống loạn thần được đưa ra thị trường, nhưng vẫn còn một tỷ lệ lớn bệnh nhân không đáp ứng tốt với việc điều trị. Người ta đã xác định được sự đa hình di truyền đóng vai trò quan trọng trong sự dao động về đáp ứng thuốc. Một nghiên cứu phân tích meta (2004) đối với 36 loại thuốc chống trầm cảm và 38 thuốc chống loạn thần thông thường cho thấy hiện tượng đa hình di truyền của CYP2D6 và CYP2C19 có ảnh hưởng đến dược động học của 1/3 số thuốc nói trên. Các thuốc chống trầm cảm 3 vòng (TCA) đã được sử dụng để điều trị trong vòng hơn 40 năm. Trong số đó, amitriptylin, một trong những dẫn chất kinh điển nhất vẫn đang được dùng rộng rãi với những ưu điểm như: Hiệu quả cao, chi phi điều trị thấp nhưng đồng thời cũng là một thuốc có phạm vi điều trị hẹp, rất dễ xảy ra ngộ độc thuốc khi dùng quá liều với nhiều tác dụng không mong muốn nghiêm trọng. Amitriptylin được chuyển hóa chủ yếu ở gan thông qua phản ứng khử methyl để trở thành dẫn chất có hoạt tính nortriptylin với xúc tác của CYP2C19 và phản ứng hydroxyl hóa bởi CYP2D6. Do đó, sự đa hình của hai CYP này có liên quan chặt chẽ đến nồng độ trong huyết thanh của amitriptylin và nortriptylin, cùng với các tác dụng không mong muốn kèm theo như lẫn, ảo giác, rối loạn nhịp tim, thay đổi đường huyết... Trong một nghiên cứu năm 2000 tiến hành trên 100 bệnh nhân tâm thần, kết quả cho thấy, các bệnh nhân có kiểu hình chuyển hóa chậm của CYP2D6 (IM, PM) có nguy cơ tác dụng không mong muốn cao hơn và thời gian nằm viện lâu hơn, chi phí điều trị cho các bệnh nhân này cũng tăng thêm 4000 - 6000 USD/năm so với người có kiểu hình bình thường. Do đó, năm 2004, hướng dẫn điều chỉnh liều cho một số thuốc chống trầm cảm và chống loạn thần đối với các kiểu gen, kiểu hình CYP2D6 và CYP2C19 khác nhau đã được đưa ra lần đầu tiên. Để có thể áp dụng được hướng dẫn điều chỉnh liễu này, năm 2005, Roche Diagnostics đã cho ra đời một loại microchip để sàng lọc các đột biển của gen CYP2D6 và CYP2C19.
CYP2C9
CYP2C9 là enzym chuyển hóa của khoảng 100 thuốc đang được dùng phổ biến, tức là khoảng 15% số thuốc thường được bác sĩ kê đơn. Đây cũng là một trong số những CYP có số lượng nhiều nhất ở gan (chiếm 10% tổng số CYP được biểu hiện ở gan). Các thuốc là cơ chất của CYP2C9 bao gồm các thuốc chống viêm, chống co giật, chống đông, các thuốc điều trị đái tháo đường dùng đường uống...
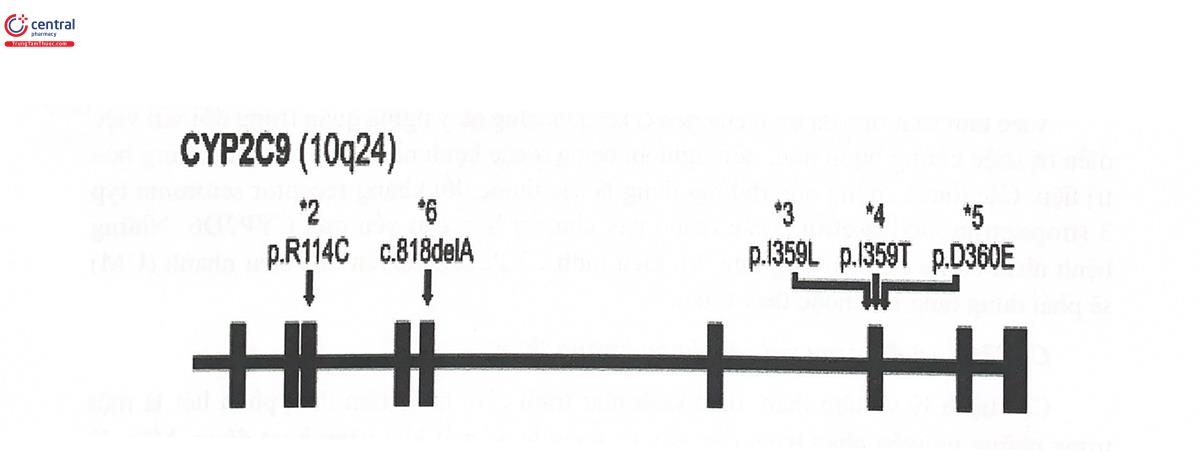
Gen mã hóa CYP2C9 nằm trên nhiễm sắc thể số 10, vùng q24. Gen này có thể xảy ra một số SNP (Hình 5.13), trong đó được quan tâm nhiều nhất là 2 alen đa hình CYP2C9*2 (430C>T), CYP2C9*3 (10754>C) tương ứng với kiểu hình giảm hoặc mất hoạt tính của enzym chuyển hóa thuốc (IM/PM). Hai alen này làm ảnh hưởng đáng kể đến đáp ứng điều trị với các thuốc là cơ chất của CYP2C9, đặc biệt là các thuốc chống đông và thuốc hướng thần.
CYP2C9 và đáp ứng với thuốc chống đông
Trong số các thuốc chống động đang được sử dụng hiện nay, warfarin là thuốc được dùng rộng rãi nhất và cũng được nghiên cứu sâu nhất về ảnh hưởng của kiểu gen tới đáp ứng thuốc. Warfarin là hỗn hợp của hai đồng phân racemic R và S, trong đó, đồng phân S có hiệu quả chống động tốt hơn hẳn và được chuyển hóa bởi CYP2C9. Cả hai alen đa hình thường gặp của CYP2C9 dẫn đến giảm hoạt động enzym là CYP2C9*2 và CYP2C9*3 đều làm thay đổi chuyển hóa của S-warfarin, dẫn đến làm giảm liều dùng cần thiết của thuốc và tăng nguy cơ quá liều, dẫn đến các tai biến xuất huyết. Trong thực tế, sự đa dạng kiểu gen CYP2C9 là nguyên nhân của 14% các trường hợp dao động đáp ứng điều trị với warfarin. Tùy từng kiểu gen cụ thể của CYP2C9, warfarin có một liều dùng thích hợp (Bảng 5.7). Nếu không có sự điều chỉnh liều hợp lý, có thể gây ra những hậu quả nghiêm trọng tử sự quá liều warfarin.
| Bảng 5.7. Liều dùng warfarin trong ứng với từng kiểu gen của CYP2C9 | |
| Kiểu gen CYP2C9 | Liều warfarin thích hợp (mg/ngày) |
| *1/*1 | 5-7 |
| *1/*2 | 5-7 |
| *1/*3 | 3-4 |
| *2/*2 | 3-4 |
| *2/*3 | 3-4 |
| *3/*3 | 0,5-2 |
CYP2C19
CYP2C19 tham gia vào chuyển hóa của nhiều nhóm thuốc quan trọng như thuốc chống trầm cảm, thuốc ức chế bơm proton và thuốc chống kết tập tiểu cầu.
Gen CYP2C19 nằm trên nhiễm sắc thể số 10, vùng 10q23.33. Hầu hết các trường hợp đa hình xảy ra với gen này đều làm giảm hoặc mất hoạt tính của enzym chuyển hóa, chỉ có alen CYP2C19*17 làm tăng hoạt tính (Bảng 5.8).
| Alen | Phân bố ở các chủng tộc | Loại biến thể | Vị trí | Phân loại kiểu hình |
| CYP2C19*1 | Thường gặp ở các chủng tộc | Wild-type; 50,720bp | 10q24.1-3 | EM |
| CYP2C19*2 | 2 – 5% người châu Âu; 18 – 23% người Nhật; 20,5% người Kinh Việt Nam | 40bp deletion (681G->A) | Exon 5 | PM |
| CYP2C19*3 | 13% đảo Vanuatu; 2,5% người Kinh Việt Nam | W212X(636G->A) | Exon 4 | PM |
| CYP2C19*4 | 0,6 – 3% người châu Âu | M1V (đột biến ở mã khởi đầu) A->G | Initiation codon | PM |
| CYP2C19*5 | Hiếm gặp ở người Nhật và Trung Quốc | R433W (1297C->T) | Exon 9 | PM |
| CYP2C19*17 | 18% người Ethiopia và Thụy sĩ 1,3% người Nhật, 0,64% người Trung Quốc, 1% ở người Kinh Việt Nam | C806T (3402C->T) | 5'-flanking region | UM |
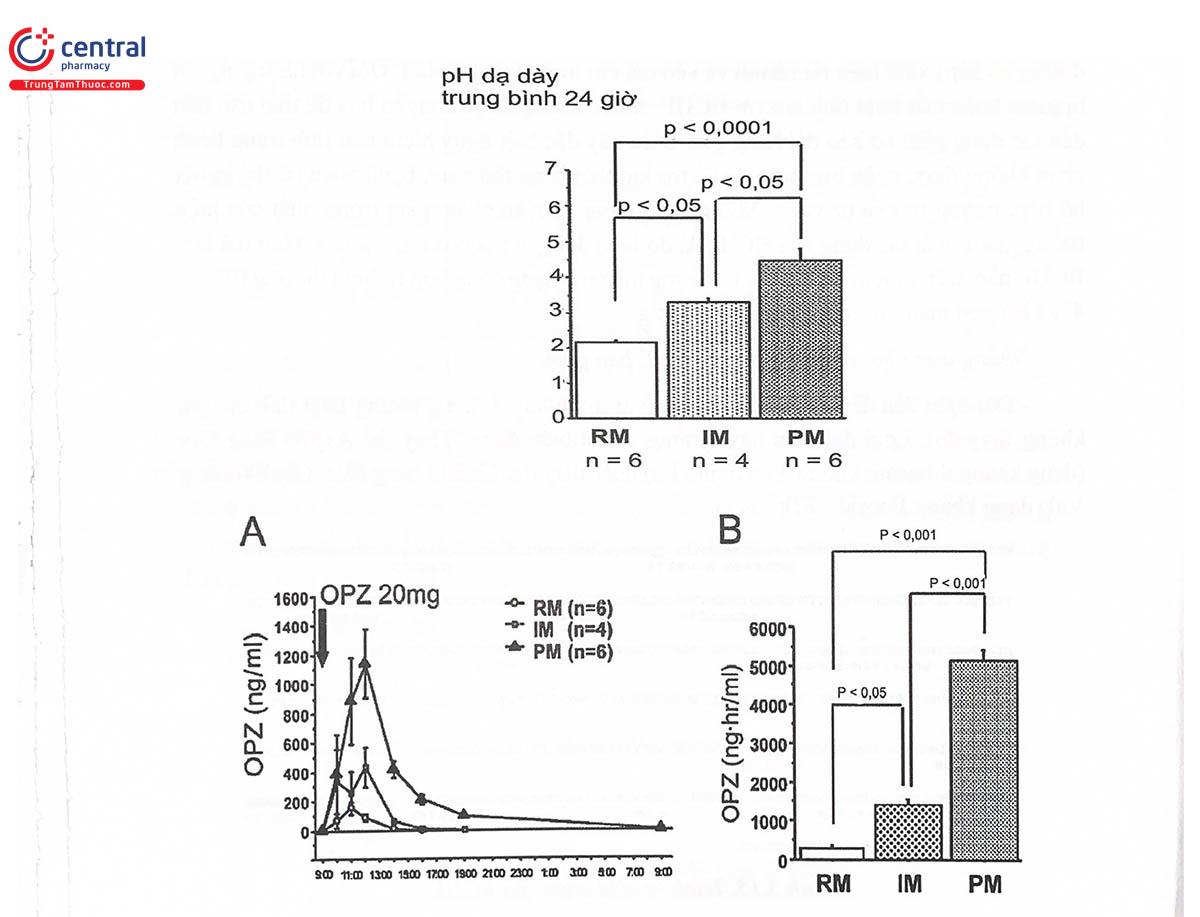
Đối với những người mang kiểu hình giảm hoặc mất hoạt tính enzym CYP2C19, sau khi uống omeprazol liều 20 mg, nồng độ thuốc trong huyết tương, AUC đều cao hơn so với người mang kiểu hình EM, trong khi đó, pH dịch vị dạ dày cao hơn rõ rệt (Hình 5.14). Điều đó đồng nghĩa với hiệu quả điều trị bằng omeprazol tăng lên ở những người có kiểu hình PM/IM. Ngược lại, với người mang kiểu gen CYP2C19*17 làm tăng hoạt tính chuyển hóa, hiệu quả điều trị giảm rõ rệt. Do vậy, Hiệp hội Gen được Hoàng gia Hà Lan đã đưa ra khuyến cáo: Với những người mang kiểu gen đồng hợp tử *17/*17, cần tăng liều omeprazol lên gấp đôi.
2.2.2 Các enzym chuyển hóa thuốc pha I ngoài họ CYP450
Bên cạnh các enzym họ CYP, các phản ứng chuyển hóa thuốc pha I còn có thể được xúc tác bởi một số enzym khác. Trong số đỏ, nhiều enzym cũng xảy ra các hiện tượng đa hình tương tự như các enzym CYP. dẫn đến thay đổi mức độ chuyển hóa của thuốc, làm tăng hoặc giảm tác dụng độc tính của thuốc.
Một trường hợp kinh điển đã được biết đến từ những năm 50 - 60 của thế kỷ trước là pseudocholinesterase (còn có tên gọi khác là butyrylcholinesterase - BCHE). Đây là enzym xúc tác phản ứng thủy phân liên kết este của nhiều thuốc, đặc biệt là succinylcholin, một thuốc giãn cơ có tác dụng nhanh. Succinylcholin thường được dùng trước phẫu thuật với mục đích giãn cơ. Tác dụng liệt cơ, giãn cơ (bao gồm cả cơ trơn đường hô hấp) xuất hiện rất nhanh và kéo dài chỉ trong vòng 5 phút. Đối với những người bị giảm hoặc mất hoạt tính enzym BCHE, thuốc không được chuyển hóa để thải trừ, dẫn đến tác dụng giãn cơ kéo dài hàng giờ. Điều này đặc biệt nguy hiểm nếu tình trạng bệnh nhân không được nhận biết sớm để hỗ trợ kịp thời bằng thở máy, bệnh nhân có thể bị liệt hô hấp, ngừng thở và tử vong. Một trong những nguyên nhân quan trọng nhất của hiện tượng giảm/ mất tác dụng của BCHE là do biến đổi gen mã hóa enzym này. Gen mã hóa BCHE nằm trên nhiễm sắc thể số 3, thường tồn tại ở dạng đồng hợp tử bình thường (96%), 4% kiểu gen mang ít nhất 1 alen bất thường.
Những dạng bất thường về gen BCHE bao gồm:
- Đột biến dẫn đến giảm nồng độ enzym trong huyết tương nhưng hoạt tính enzym không thay đổi. Loại đột biến này thường là đột biến điểm: Thay thế Asp70 bằng Gly (dạng kháng dibucain không điển hình - Ea) hoặc thay thế Thr243 bằng Met, Gly390 bằng Val (dạng kháng fluorid - Ef).

Những vị trí xảy ra đột biến tương ứng với các alen bất thường được in đậm, (*) là những vị trí xúc tác quan trọng của enzym
- Đột biến làm mất hoạt tính enzym. Loại đột biến này làm hoạt tính enzym chỉ còn khoảng 1 - 10% so với bình thường, xuất hiện với tần suất khoảng 1/100.000 (cả biệt có thể lên đến 1 - 2% ở người Eskimo). Người ta đã phát hiện ra 12 alen bất thưởng của gen BCHE loại này. Các bất thường này có thể bao gồm các đột biển điểm hoặc đột biến mất đoạn, dẫn đến làm thay đổi cấu trúc và chức năng của protein enzym tương ứng.
2.3 Ảnh hưởng của kiểu gen lên chuyển hóa thuốc ở pha II
Hiện tượng đa hình di truyền cũng xuất hiện đối với các enzym xúc tác phản ứng chuyển hóa thuốc ở pha II. Các enzym này được coi là các enzym giải độc của cơ thể, do đó, những kiểu gen liên quan đến sự giảm hoặc mất tác dụng của các enzym này có thể là nguyên nhân gây ra các trường hợp ngộ độc thuốc hoặc các tại biển nghiêm trọng trong điều trị.
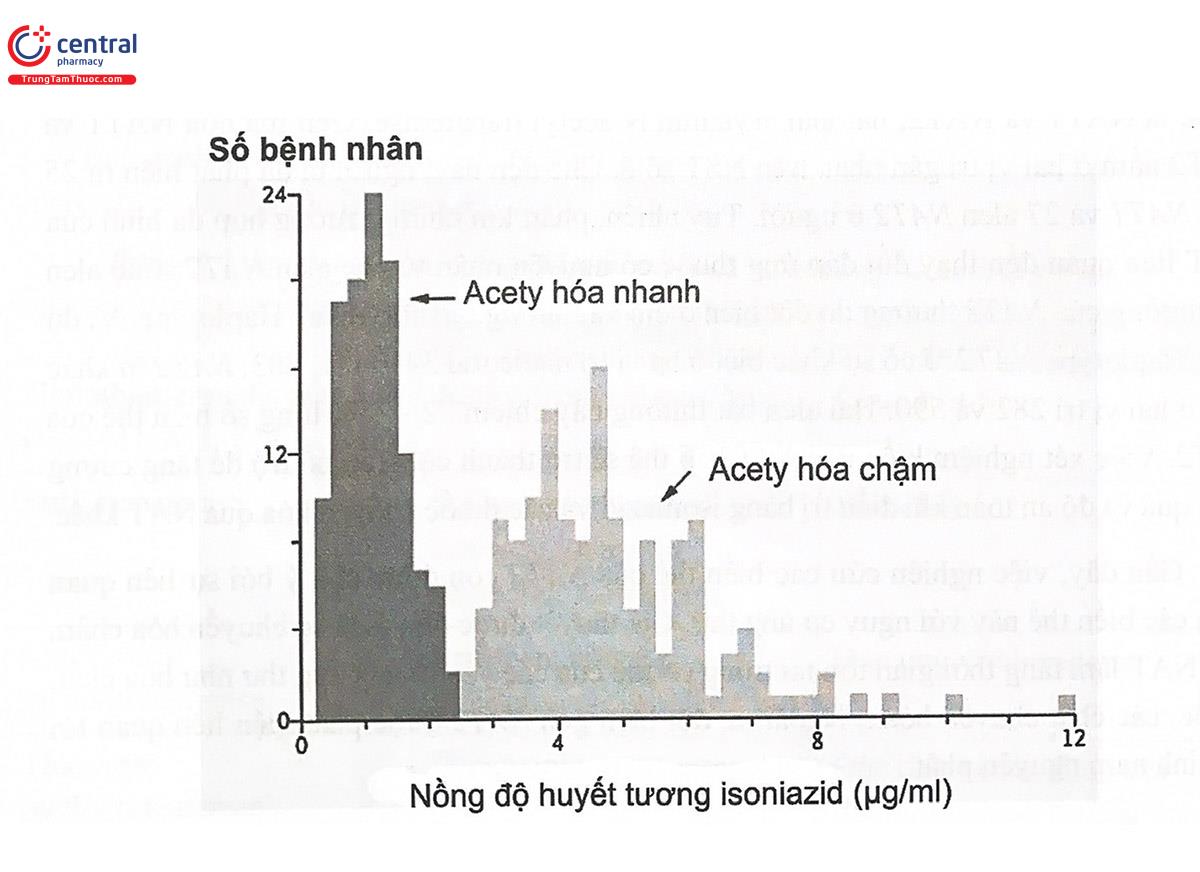
Một trong những ví dụ kinh điển minh họa cho sự đa hình di truyền của các enzym chuyển hóa thuốc pha II là N-acetyl transferase (NAT). NAT là enzym xúc tác phản ứng acetyl hóa tại nguyên tử N (N-acetylation) của các hợp chất có nhóm amin như các amin dị vòng, amin vòng thơm, trong số đó có nhiều thuốc như INH (isoniazid), sulfonamid, procainamid, hydralazin... Sự đa hình của gen NAT được phát hiện lần đầu tiên khi theo dõi mức độ đáp ứng của bệnh nhân với INH (Hình 5.16). Bệnh nhân có nồng độ INH cao trong huyết tương liên quan đến kiểu hình chuyển hóa chậm của NAT dễ bị nguy cơ tổn thương thần kinh ngoại vi trong khi kiểu hình chuyển hóa nhanh không xuất hiện tại biển này. Kiểu hình NAT chuyển hóa chậm còn có nguy cơ ngộ độc thuốc khi dùng sulfonamid và lupus ban đỏ khi dùng procainamid. Tỷ lệ người mang NAT chuyển hóa chậm khá cao giữa các quần thể: 40 - 70% người da trắng và người Mỹ gốc Phi, 10 - 20% người Nhật và Eskimo, hơn 80% người Ai Cập.
Ở người, NAT có 18 isozym, trong đó có 2 isozym liên quan nhiều đến đáp ứng của thuốc là NATI và NAT2, hai loại arylamin N-acetyl transferase. Gen mã hóa NATI và NAT2 nằm ở hai vị trí gần nhau trên NST số 8. Cho đến nay, người ta đã phát hiện ra 25 alen NATI và 27 alen NAT2 ở người. Tuy nhiên, phần lớn những trường hợp đa hình của NẠT liên quan đến thay đổi đáp ứng thuốc có nguyên nhân tử các alen NA72. Các alen bất thưởng của NA72 thường do đột biển điểm và thường tập hợp thành Haplotype. Vi dụ như: Haplotype N472*5 có sự khác biệt ở ba vị trí nucleotid 341,481, 803; NAT2*6 khác biệt ở hai vị trí 282 và 590. Hai alen bất thường này chiếm 72 - 75% tổng số biển thể của NAT2. Việc xét nghiệm kiểu gen NAT2 có thể sẽ trở thành công cụ hỗ trợ để tăng cường hiệu quả và độ an toàn khi điều trị bằng Isoniazid và các thuốc chuyển hóa qua NAT khác.
Gần đây, việc nghiên cứu các biến thể của NAT2 còn được chú ý bởi sự liên quan giữa các biến thể này với nguy cơ ung thư. Giả thuyết được đưa ra là sự chuyển hóa chậm qua NAT làm tăng thời gian tồn tại trong cơ thể của các yếu tố gây ung thư như hóa chất, thuốc, các chất chuyển hóa... Ngoài ra, đột biến gen N472 được phát hiện liên quan tới vô sinh nam nguyên phát.
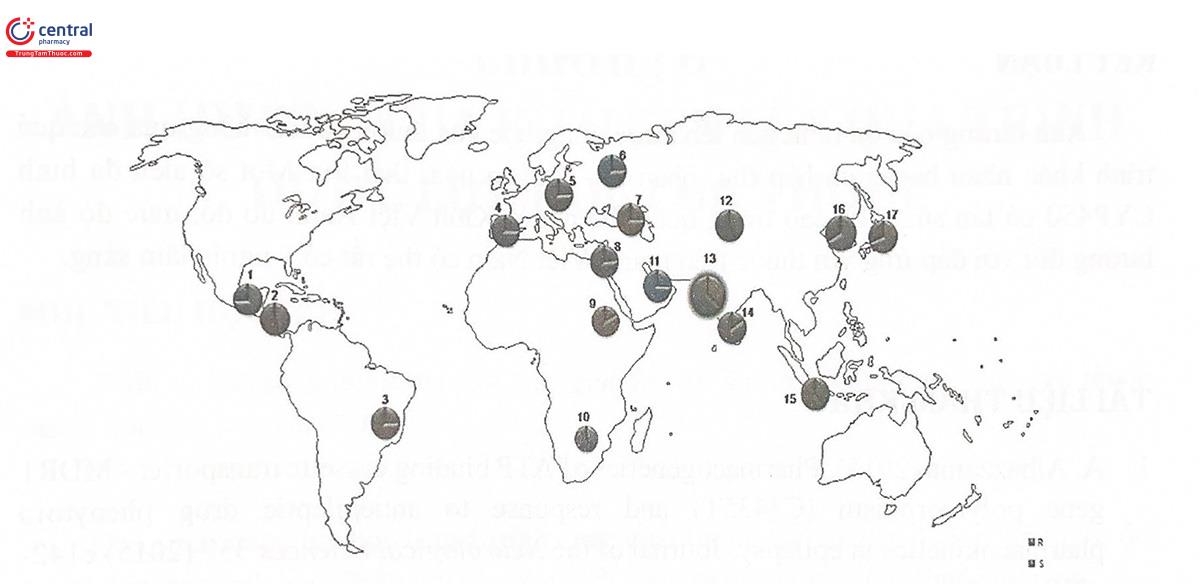
1. Nicaragua; 2. Nigawbe, 3. Rio de Janeiro; 4. Tây Ban Nha; 5, Đức; 6, Ngài 7. Da trắng châu u; 8. Thổ Nhĩ Kỳ: 9. Sudan; 10. Tswana; 11. Oman; 12. Kyrgyzistan; 13. Ấn Độ; 14. Nam Ấn Độ; 15, Indonesia; 16 Hàn Quốc; 17. Nhật
Bên cạnh NAT, hiện tượng đa hình di truyền còn được ghi nhận với một số enzym chuyển hóa pha II khác (Bảng 5.9).
| Enzym | Cơ chất | Tác động |
| Glutathion transferase (GSTM1, M3, T1) | Amiochrom, adrenochrom | Chưa biết rõ |
| Sulfotransferase | Steroid, Paracetamol, estrogen, dopamin, adrenalin, naringenin | Chưa biết rõ |
| Catechol-o-methyltransferase | Estrogen, ascorbic, levodopa | Đáp ứng với levedopa |
| Thiopurin methyltransferase | Thioguanin, mercaptopurin | Độc tính và tác dụng của thiopurin, nguy cơ ung thư thứ phát |
| UDP-glucoronosyl transferase | Androgen, morphin, ibuprofen | Chưa biết rõ |
3 Kết luận
Ảnh hưởng của đa hình gen lên được động học của thuốc có thể thông qua các quá trình khác nhau bao gồm hấp thu, phân bố, chuyển hóa, thải trừ. Một số alen đa hình CYP450 có tần suất khá cao trong quần thể người Kinh Việt Nam, do đó, mức độ ảnh hưởng đối với đáp ứng với thuốc trên người Việt Nam có thể rất có ý nghĩa lâm sàng.
4 Tài liệu tham khảo
1. A. Alhazzania (2015), Pharmacogenetics of ATP binding cassette transporter - MDRI gene polymorphism (C3435T) and response to antiepileptic drug phenytoin. pharmacokinetics in epilepsy, Journal of the Neurological Sciences 357 (2015) e142- e160.
2. Brian Thomas Hocum (2016), Cytochrome P-450 gene and drug interaction analysis in patients referred for pharmacogenetic testing. Am J Health-syst Pharm, Vol 73 (2). 2016.
3. Gilberto Jaramillo-Rangel (2018), C3435T polymorphism in the MDRI gene and breast cancer risk in northeastern Mexico, Int J Clin Exp Pathol. 2018;11(2):904-909.
4. Ida Aka, Christiana J. Bernal, (2017), Clinical Pharmacogenetics of Cytochrome P450-Associated Drugs in Children, J Pers Med. 2017 Dec; 7(4): 14.
5. Karczewski KJ, Daneshjou R, Altman RB (2012) Chapter 7: Pharmacogenomics. PLoS Comput Biol 8(12).
6. Kewal Jain. Textbook of Personalized Medicine, Humana Press, 2015.
7. Muh Akbar Bahar, Pharmacogenetics of drug-drug interaction and drug-drug-gene interaction: a systematic review on CYP2C9, CYP2C19 and CYP2D6, Pharmacogenomics. 2017.
8. Shabbir Ahmed, Zhan Zhou, Pharmacogenomics of Drug Metabolizing Enzyms and Transporters: Relevance to Precision Medicine, Genomics Proteomics Bioinformatics. 2016 Oct; 14(5): 298-313.

