6 chỉ tiêu đánh giá chất lượng không khí xung quanh

Trường Đại học Dược Hà Nội - Khoa hóa phân tích và kiểm nghiệm
Chủ biên TS. Trần Nguyên Hà
Ban biên soạn
TS. Trần Nguyên Hà
TS. Vũ Ngân Bình
Nhiều hoạt động của con người đã thay đổi thành phần, tính chất của môi trường không khí, vượt qua giới hạn của quá trình làm sạch tự nhiên, gây ô nhiễm và suy thoái môi trường không khí. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc đặc điểm của môi trường không khí, các nguyên nhân gây ô nhiễm không khí và nguyên tắc kiểm soát các chất ô nhiễm.
1 Bảng chữ cái viết tắt
| Tên viết tắt | Nghĩa Tiếng Anh | Nghĩa Tiếng Việt |
| BC | Black carbon | Carbon đen |
| BrC | Brown carbon | Carbon nâu |
| BVTV | Bảo vệ thực vật | |
| BOD | Biochemical oxygen demand | Nhu cầu oxy sinh hoá |
| CFC | Chlorofluorocarbon | Cloroflorocarbon |
| COD | Chemical oxygen demand | Nhu cầu oxy hóa học |
| CRTĐT | Chất thải rắn đô thị | |
| DO | Dissolved oxygen | Lượng oxy hòa tan trong nước |
| DS | Dissolved solid | Lượng chất rắn hòa tan trong nước |
| ĐTM | Đánh giá tác động môi trường | |
| EPA | Environment Protection Agency | Cơ quan Bảo vệ môi trường Mỹ |
| GHG | Greenhouse gas | Khí nhà kính |
| HAP | Hazardous air pollutant | Khí thải nguy hại |
| HCFC | Hydrochlorofluorocarbon | Hydrocloroflorocarbon |
| PAH | Poly aromatic hydrocarbon | Chất hữu cơ đa vòng thơm |
| PAN | Peroxyl acetyl nitrat | |
| PM | Chất dạng hạt | |
| QCVN | Quy chuẩn Việt Nam | |
| SS | Sustained solid | Lượng chất rắn có thể lắng được |
| TCVN | Tiêu chuẩn Việt Nam | |
| TDS | Total dissolved solid | Tổng chất rắn hòa tan |
| VSV | Vi sinh vật | |
| VOC | Volatile organic chemical | Chất hữu cơ dễ bay hơi |
| WHO | World Health Organization | Tổ chức Y tế thế giới |
Trái đất khi mới hình thành không có khí quyển. Lớp khí quyển đầu tiên xuất hiện từ việc giải phóng các khí bị giữ trong lòng trái đất tương tự như hoạt động của núi lửa. Dưới tác động của tia tử ngoại, hơi nước và khí carbonic phản ứng hình thành nên những phân tử oxy đầu tiên, chúng nhẹ và bay lên trên. Khi tầng bình lưu có đủ oxy, dưới tác động của tia tử ngoại, chúng hình thành nên tầng ozon bảo vệ trái đất, tạo kiện cho sự sống ở trên cạn. Khi các sinh vật có khả năng quang hợp xuất hiện, chúng tiêu thụ khí carbonic trong khí quyển, đồng thời giải phóng ra khí oxy. Sau một thời gian dài ổn định, nồng độ khí oxy trong khí quyển là khoảng 21%, phù hợp với việc duy trì sự sống. Môi trường không khí có quá trình tự làm sạch ở một mức độ nhất định để duy trì cân bằng. Tuy nhiên nhiều hoạt động của con người đã thay đổi thành phần, tính chất của môi trường không khí, vượt qua giới hạn của quá trình làm sạch tự nhiên, gây ô nhiễm và suy thoái môi trường không khí. Chương này giới thiệu về các đặc điểm của môi trường không khí, các nguyên nhân gây ô nhiễm không khí và nguyên tắc kiểm soát các chất ô nhiễm. Nguyên nhân, tác động và giải pháp khắc phục các hiện tượng nhiễm môi trường khu vực và toàn cầu. Phần sau cùng giới thiệu một số tác động đến môi trường không khí từ việc sản xuất và sử dụng dược phẩm.
2 Đặc điểm của môi trường không khí
2.1 Cấu tạo, thành phần của môi trường không khí

Môi trường không khí được chia làm hai phần: phần trong và phần ngoài. Phần trong gồm 4 tầng:
- Tầng đối lưu (Troposphere)
- Tầng bình lưu (Stratosphere)
- Tầng trung gian (Mesosphere)
- Tầng nhiệt (Thermosphere)
Mỗi tầng của môi trường không khí được đặc trưng bởi nhiệt độ và những hiện tượng hóa lý riêng biệt. Giữa các tầng được phân cách bởi những lớp mỏng gọi là lớp tạm dừng (Pause).
Phần ngoài còn có tên là tầng điện ly (Exosphere). Tầng này có độ cao hơn 800km, chứa nhiều ion như O+, He+, H+, có các dòng plasma do mặt trời phát ra và bụi vũ trụ. Giới hạn trên của khí quyển và phần chuyển tiếp vào vũ trụ khó xác định. Hiện nay người ta mới ước đoán khoảng 1000 km.
2.1.1 Tầng đối lưu
Tầng đối lưu có chiều cao khoảng 11 km, chiếm gần 70% khối lượng của khi quyển. Các hiện tượng thời tiết xảy ra trong tầng này.
Thành phần chính là nitơ (78,1%), oxy (20,9%), thành phần thứ yếu là argon, carbonic, thành phần vết là neon, heli, methan... Ngoài ra còn có các hạt bụi lơ lửng với kích thước và khối lượng rất khác nhau.
Nhiệt độ giảm mạnh với sự tăng chiều cao. Nhiệt độ khí quyển gần mặt đất lớn nhất do sự hấp thụ bức xạ từ mặt đất. Sự biến thiên nhiệt độ như vậy làm cho khí quyển vùng này có sự xáo trộn mạnh do hiện tượng đối lưu. Lớp không khí ở dưới nóng và nhẹ hơn tầng không khí bên trên nên có xu hướng đi lên, trong khi lớp không khí bên trên lạnh và nặng hơn nên đi xuống. Khi gặp một số điều kiện nhất định, sự biến thiên nhiệt độ theo chiều cao có thể thay đổi, hiện tượng này gọi là sự nghịch nhiệt.
Nghịch nhiệt có thể xảy ra khi một lớp không khí ấm được thổi vào bên trên khối không khí lạnh và giữ các khối không khí lạnh dưới nó. Điều kiện cân bằng này có thể tồn tại vài ngày. Hiện tượng này cũng xảy ra khi một khối không khí lạnh được thổi vào dưới khối không khí ấm. Hiện tượng nghịch nhiệt cũng có thể xuất hiện vào buổi tối khi mặt đất lạnh nhanh hơn khối không khí bên trên, làm mát khối không khí cạnh nó và làm cho khối không khí này lạnh hơn khối không khí trên đó.
Ngoài ra, không khí ở tầng này còn xáo trộn do chênh lệch nhiệt độ giữa xích đạo và hai cực. Chất ô nhiễm ở tầng đối lưu bị pha loãng do xáo trộn không khí và khuếch tán ở tầng này. Do mật độ khi quyển ở tầng này cao, các chất ô nhiễm có thể tương tác với các chất khác có trong tầng này.
2.1.2 Tầng bình lưu
Tầng bình lưu có độ cao từ khoảng 11 đến 50 km so với bề mặt trái đất. Nhiệt độ tăng theo chiều cao từ -56°C đến -2°C. Các máy bay thương mại thường bay ở tầng thấp trong tầng bình lưu. Khoảng 99% khối lượng của khí quyển nằm trong tầng đối lưu và bình luu.
Thành phần chủ yếu ở tầng bình lưu là ozon. Ozon hấp thụ tử ngoại năng lượng cao tạo oxy và giải phóng nhiệt.
O3 + hv→ O2+O+Q
Ở lớp trên của tầng bình lưu, lượng tia tử ngoại năng lượng cao lớn, do đó sự phân hủy ozon xảy ra nhiều hơn và nhiệt độ lớn hơn các lớp không khí phía dưới trong tầng bình lưu. Vì sự biến thiên nhiệt độ như vậy nên không khí ở trên tầng bình lưu không có sự xáo trộn do đối lưu. Các tiểu phân ở tầng này có thời gian lưu khá dài, nếu một chất ô nhiễm nào nó vào được tầng bình lưu và ảnh hưởng đến sự cân bằng ozon sẽ tạo ra một nguy cơ toàn cầu.
Tầng bình lưu khá khô, không khí ở đây không có hơi nước, do đó ít khi hình thành mây ở tầng này. Các đám mây bình lưu ở các cực (polar stratospheric clouds - PSCs) là trường hợp ngoại lệ. Chúng xuất hiện ở tầng thấp của tầng bình lưu trong khoảng chiều cao từ 15 đến 25 km vùng gần các cực của trái đất và xuất hiện vào mùa đông khi nhiệt độ xuống thấp dưới -78°C. Chính sự xuất hiện của những đám mây này đã làm tăng các phản ứng phân hủy ozon bởi các chất hóa học, dẫn tới sự suy giảm tầng ozon mạnh mẽ ở các cực. Hiện tượng này sẽ được phân tích chi tiết hơn ở phần sau
2.1.3 Tầng trung gian
Tầng trung gian có độ cao từ 50 đến 85 km so với bề mặt trái đất.
Thành phần chủ yếu là các oxy linh động O2+, O+ và các tiểu phân tích điện khác nhau như NO+, e. Khi các thiên thạch từ vũ trụ rơi vào khí quyển của trái đất đến tầng này sẽ bốc cháy.
Nhiệt độ giảm theo chiều cao từ -2°C đến -92°C. Nguyên nhân nhiệt độ giảm bắt nguồn từ khả năng hấp thụ tia tử ngoại xa của các tiểu phân.
2.1.4 Tầng nhiệt
Tầng nhiệt có độ cao từ 85 km đến khoảng 500 - 1000 km, nhiệt độ tăng theo chiều cao. Nhiệt độ của tầng này chịu tác động mạnh của bức xạ năng lượng cao của mặt trời. Hiện tượng cực quang (Aurora) xuất hiện ở tầng nhiệt.
Thành phần chính trong tầng nhiệt là các nguyên tử oxy, nitơ và heli. Các photon năng lượng cao bứt electron của phân tử và nguyên tử tạo thành các ion.
2.2 Cân bằng năng lượng trên lớp khí quyển gần bề mặt trái đất
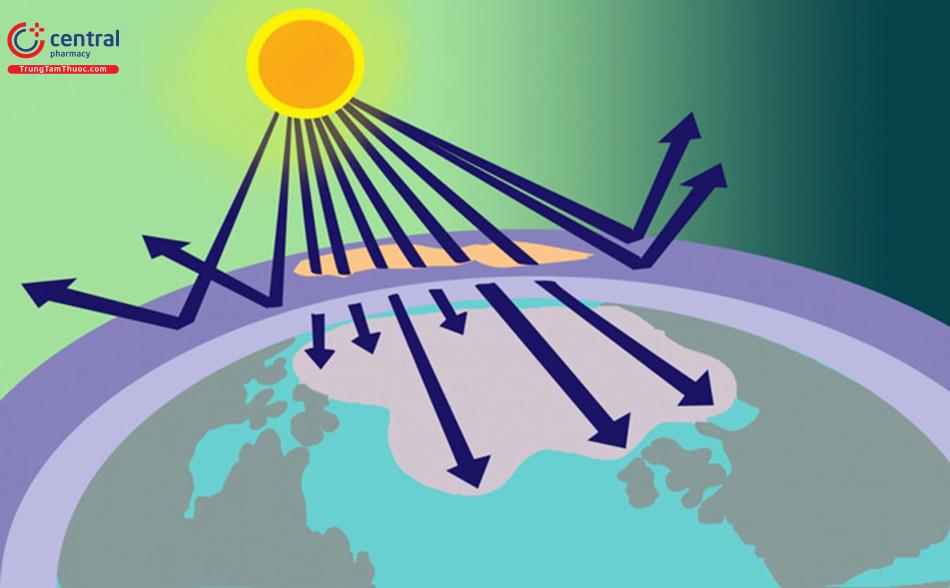
Nhiệt độ trên bề mặt trái đất được duy trì khá hằng định, dao động hẹp với trị số trung bình là 15°C. Nhiệt độ này rất phù hợp cho các sinh vật phát triển trên trái đất. Nhiệt độ trên bề mặt trái đất được duy trì ổn định là do trái đất có cơ chế cân bằng năng lượng giữa năng lượng nhận vào (năng lượng mặt trời) và năng lượng mất đi (các bức xạ từ trái đất ra vũ trụ).
Trái đất nhận năng lượng từ các bức xạ mặt trời. Mặt trời có nhiệt độ khoảng 6.000K, phát ra bức xạ tử ngoại, nhìn thấy và hồng ngoại với bước sóng cực đại 0,48 um. Khi các bức xạ tới trái đất, khoảng 30,5% bị phản xạ lại vũ trụ, phần lớn do các khí và hơi trong môi trường không khí và một phần nhỏ do đất. Phần còn lại được phân bố vào môi trường, trong đó biển, đất, mặt băng hấp thụ 45,0% và khí quyển hấp thụ 24,5%.
Trái đất cân bằng các năng lượng nhận được bằng cách phân phối lại một phần do hiện tượng đối lưu, một phần được truyền qua tương tác giữa các nguyên tử và phân tử. Ngoài ra, do là một vật thể có nhiệt độ, trái đất và khí quyển phát ra tia bức xạ vùng hồng ngoại. Phần lớn năng lượng phát ra từ trái đất không trực tiếp đi ra vũ trụ mà được hấp thụ lại bởi các khí nhà kính như methan, nitrogen oxid, ozon, carbon dioxid và hơi nước, làm ấm lớp không khí gần bề mặt trái đất.
Do lượng năng lượng mất ra ngoài vũ trụ bằng lượng năng lượng trái đất nhận về, trái đất có nhiệt độ tương đối hằng định. Khi cân bằng này bị phá vỡ do sự gia tăng nồng độ các khí nhà kính, khối không khí trên bề mặt trái đất sẽ giữ lại nhiều nhiệt hơn và gây hiện tượng ấm lên toàn cầu. Hiện tượng này sẽ được phân tích cụ thể hơn ở phần sau.
3 Ô nhiễm không khí và các nguyên nhân gây ô nhiễm không khí

Ô nhiễm không khí có thể được định nghĩa là sự có mặt của chất gây ô nhiễm trong môi trường không khí, gây ảnh hưởng xấu lên sức khỏe con người, tài sản hoặc sinh ra các tác động môi trường có hại khác. Ô nhiễm môi trường không khí có thể xảy ra ở trong không gian khép kín (indoor pollution) hoặc bên ngoài (ô nhiễm môi trường không khí xung quanh - ambient air pollution) bởi các tác nhân hóa học, vật lý, sinh học, làm thay đổi các đặc điểm tự nhiên của môi trường không khí.
Cơ quan quốc tế nghiên cứu về bệnh ung thư (IARC) thuộc Tổ chức Y tế thế giới (WHO) đã xếp ô nhiễm không khí là một trong những nguyên nhân hàng đầu gây các căn bệnh ung thư ở người. Cùng với nhiều tác nhân nguy hiểm như bụi amiăng, thuốc lá, phóng xạ, tia cực tím, ô nhiễm không khí là tác nhân gây ung thư trong môi trường nguy hiểm nhất và là nguyên nhân chính dẫn đến ung thư phổi. Chương trình quốc gia về môi trường của Liên Hợp quốc dự đoán rằng ô nhiễm không khí trong nhà và ngoài trời gây ra khoảng 5% gánh nặng bệnh tật trên toàn thế giới, gồm có sự gia tăng bệnh hen phế quản và các bệnh dị ứng đường hô hấp khác, các biến chứng sinh nở (thai chết lưu, thai nhẹ cân). Người dân ở các nước đang phát triển là những đối tượng chịu ảnh hưởng chính của ô nhiễm không khí.
Các chất ô nhiễm không khí có thể có nguồn gốc tự nhiên hoặc nhân tạo. Tro, bụi sinh ra từ các hoạt động của núi lửa, hạt cát sa mạc phát tán do gió bão... là các chất ô nhiễm có nguồn gốc tự nhiên. Các chất ô nhiễm sinh ra từ các hoạt động đốt cháy trong công nghiệp, giao thông vận tải... là chất ô nhiễm có nguồn gốc nhân tạo. Các chất ô nhiễm trong không khí có thể trải qua các biến đổi thông qua phản ứng hóa học, đặc biệt là phản ứng quang hoá. Năng lượng cung cấp cho phản ứng này thường gặp là các bức xạ tử ngoại hoặc nhìn thấy. Các nguyên tử và phân tử hấp thụ photon sẽ chuyển sang trạng thái kích thích và dễ dàng tham gia các phản ứng hóa học. Các quá trình này thường sẽ có sự tham gia của các gốc hoạt động như H, O, HO, HOO. Các chất ô nhiễm không khí gây tác động đến hệ sinh thái, đến hoạt động của con người và đặc biệt là đến sức khoẻ con người.

Các chất ô nhiễm không khí được phân loại thành các chất ô nhiễm nguy hại (hazardous air pollutants) và chất ô nhiễm không khí tiêu chuẩn (criteria pollutants). Sự phân chia này không rõ ràng do tất cả các chất ô nhiễm khí quyển đều nguy hại tức là đều có khả năng gây hại. Sự khác biệt là các chất ô nhiễm không khí nguy hại có khả năng gây ung thư hoặc gây các bệnh mạn tính do ảnh hưởng lên hệ sinh sản, sinh nở hoặc các tác động đáng kể lên hệ sinh thái. Trong khi đó, các chất ô nhiễm không khí tiêu chuẩn là những chất có mặt phổ biến trong không khí, gây hại cho sức khỏe và tài sản cộng đồng. Các chất ô nhiễm khí quyển tiêu chuẩn thường dùng để đánh giá chất lượng không khí xung quanh dựa trên các tiêu chuẩn chất lượng không khí. Sự có mặt của các chất ô nhiễm khí quyển tiêu chuẩn được dùng để đánh giá chất lượng không khí xung quanh (tức là không khí ở tầng thấp của khí quyển, nơi con người và các sinh vật khác sinh sống). Bộ Tài nguyên và Môi trường Việt Nam đưa ra tiêu chuẩn chất lượng không khí xung quanh về nồng độ tối đa của 6 chất ô nhiễm tiêu chuẩn sau đây:
- Khí carbon monoxid (CO)
- Khí nitrogen dioxid (NO2)
- Khí sulfur dioxid (SO2)
- Ozon (O3)
- Chất dạng hạt (particulate matter - PM)
- Chi (Pb)
Đây cũng là sáu thành phần ô nhiễm điển hình trong tiêu chuẩn chất lượng không khí xung quanh của Quốc gia ở Mỹ và Châu Âu.
Các chất ô nhiễm khí quyển nguy hại còn được gọi là các chất độc (air toxics). Các chất ô nhiễm nguy hại thường xuất hiện ở các điểm nóng ô nhiễm như khu công nghiệp và khu đô thị. Cơ quan bảo vệ môi trường của Mỹ yêu cầu kiểm soát 187 chất ô nhiễm nguy hại như: benzen (trong xăng dầu), percloroethylen (giặt khô), methylen clorid (sản xuất dược phẩm)... Phần lớn các chất độc này có nguồn gốc nhân tạo, được phát thải từ các nguồn thải cố định (ống khói công nghiệp, sản xuất nhiệt điện, từ vật liệu xây dựng, dung môi tẩy rửa trong không gian kín...) và nguồn di chuyển (phương tiện giao thông vận tải), gây ô nhiễm khí quyển xung quanh và trong nhà. Các chất này được kiểm soát nghiêm ngặt theo tiêu chuẩn xả thải được các cơ quan bảo vệ môi trường mỗi nước quy định.
4 Một sô chỉ tiêu đánh giá chất lượng không khí xung quanh

Ở Việt Nam, để đánh giá chất lượng môi trường không khí xung quanh, người ta so sánh nồng độ các chất ô nhiễm với giá trị giới hạn trong “Quy chuẩn kỹ thuật quốc gia về chất lượng không khí xung quanh” (Bảng 2.1). Trong quy định này, ngưỡng nồng độ của các chất ô nhiễm được tính theo trung bình 1 giờ, 8 giờ, 24 giờ (ngày) và năm. Đây là cơ sở dùng để đánh giá diễn biến ô nhiễm môi trường không khí theo thời gian.
Nồng độ trung bình một giờ là trung bình số học các giá trị đo được trong khoảng thời gian một giờ đối với các phép đo thực hiện hơn một lần trong một giờ, hoặc giá trị phép đo thực hiện một lần trong khoảng thời gian một giờ. Giá trị trung bình được đo nhiều lần trong 24 giờ (một ngày đêm) theo tần suất nhất định. Giá trị trung bình giờ lớn nhất trong số các giá trị đo được trong 24 giờ sẽ được lấy để so sánh với giá trị giới hạn quy định tại Bảng 2.1.
Bảng 2.1. Giá trị giới hạn các thông số cơ bản trong không khí xung quanh QCVN 05:2009/BTNMT (Đơn vị: ug/m3)
| TT | Thông số | Trung bình 1 giờ | Trung bình 3 giờ | Trung bình 24 giờ | Trung bình năm |
| 1 | SO2 | 350 | - | 125 | 50 |
| 2 | CO | 30000 | 10000 | 5000 | - |
| 3 | NOx | 200 | - | 100 | 40 |
| 4 | O3 | 180 | 120 | 80 | - |
| 5 | Bụi lơ lửng (TSP) | 300 | - | 200 | 140 |
| 6 | PM10 | - | - | 150 | 50 |
| 7 | Pb | - | - | 1,5 | 0,5 |
Ghi chú: Dấu (-) là không quy định | |||||
Trung bình 8 giờ là trung bình số học các giá trị đo được trong khoảng thời gian 8 giờ liên tục.
Trung bình 24 giờ là trung bình số học các giá trị đo được trong khoảng thời gian 24 giờ (một ngày đêm).
Trung bình năm là trung bình số học các giá trị trung bình 24 giờ đo được trong khoảng thời gian một năm.
4.1 Khí carbon monoxid
Khí carbon monoxid (CO) là chất khí không màu, không mùi, không tan trong nước. CO có khả năng gắn với hemoglobin sinh ra carboxyhemoglobin, làm giảm khả năng vận chuyển oxy của máu, giảm giải phóng oxy tới các mô, tổ chức. Khí CO được sinh ra từ các quá trình cháy không hoàn toàn các nhiên liệu có carbon có nguồn gốc tự nhiên và nhân tạo.
- Tự nhiên: do hoạt động núi lửa, phóng điện trong khí quyển, oxy hóa methan và formaldehyd.
- Nhân tạo: đóng góp phần lớn vào tổng lượng CO trong khí quyển xung quanh. CO được sinh từ nhiều hoạt động của con người như giao thông vận tải (chủ yếu), công nghiệp, quá trình thiêu đốt trong nông nghiệp...
CO được xác định bằng phương pháp đo phổ hồng ngoại hoặc sắc ký khí.
4.2 Khí nitrogen dioxid
Khí nitrogen oxyd (NO2) là khí màu nâu đỏ, được sinh ra từ phản ứng oxy hóa NO. Phơi nhiễm với NO2 trong thời gian ngắn (trong vòng 24 giờ) có thể ảnh hưởng đến hệ hô hấp. Trong môi trường, NO tham gia các phản ứng hóa học và quang hoá. Cùng với các oxid khác của nitơ (được gọi chung là NOx), NO2 tham gia phản ứng với amoniac và các hợp chất khác khi có mặt của hơi nước trong khí quyển tạo nên các hạt mịn. Đây là một nguồn sinh các hạt bụi thứ cấp trong khí quyển, sẽ được trình bày ở phần sau. Biến đổi của các nitrogen oxid trong đó có NO2 sinh ra các thành phần gây lắng đọng acid.
NO2 có nguồn gốc tự nhiên và nhân tạo.
- Tự nhiên: các vi khuẩn có khả năng cố định đạm và sinh ra các sản phẩm oxid của nitơ như N2O, NO, NO2.
- Nhân tạo: NO2 được sinh ra từ phản ứng oxy hóa của NO. Đây là sản phẩm phụ của quá trình đốt cháy, hình thành từ phản ứng của oxy và nitơ ở nhiệt độ cao và từ phản ứng oxy hóa của các hợp chất hữu cơ chứa nitơ trong than và dầu đốt. Do các phản ứng cháy thường có nhiệt độ cao, việc đốt cháy bất cứ một nhiên liệu nào đều sinh ra NO. Sau đó NO phản ứng nhanh với O2 trong không khí sinh ra NO2
*NO + 1⁄2 O2 → *NO2
Giao thông vận tải và công nghiệp là hai nguồn lớn sinh ra NOx.
Khi ra ngoài không khí, các nitrogen oxid có thể tham gia các phản ứng quang hóa phân hủy ozon và các phản ứng sinh ra acid.
*'N2O+ hv→ N2+ O*
*N2O + O* → 2 *NO
*NO + O3 → *NO2 + O2
*NO2 + *OH → HNO3
*NO + *OH → HNO2
Nồng độ NO2 có mặt trong mẫu khí được xác định bằng phương pháp quang phổ UV - Vis sau phản ứng tạo phẩm màu azo.
4.3 Khí sulfur dioxid
Sulfur dioxid (SO2) là khí không màu, nặng hơn không khí. SO2 thường ở gần mặt đất ngang tầm hoạt động của con người, dễ tan trong nước nên dễ phản ứng với cơ quan hô hấp của con người và động vật. Khí SO2 gây tác hại lên mùa màng và các vật liệu do các aerosol có tính acid. Ngoài ra, khí SO2 là một trong các khí gây ra hiện tượng lắng đọng acid.
SO2 có nguồn gốc tự nhiên và nhân tạo.
- Tự nhiên: SO2 được sinh ra từ hoạt động của núi lửa. Các sinh vật ở đại dương như tảo lam, tảo lục nước ngọt sinh ra dimethylsulfid (DMS), sau đó DMS bị oxy hóa thành SO2.
- Nhân tạo: SO2 được hình thành từ quá trình oxy hóa các nguyên liệu chứa Lưu Huỳnh như than đá hoặc từ các quá trình trong công nghiệp sử dụng các hợp chất chứa lưu huỳnh. Than đá thường chứa pyrit và các hợp chất lưu huỳnh hữu cơ như thiophen, sulfid và thiol. Trong quá trình cháy giàu oxy, sản phẩm sinh ra là SO2 và SO3. Nhiệt độ càng tăng, tốc độ sinh SO3 sẽ càng chậm. Ở nhiệt độ dưới 900 K, SO3 là sản phẩm chính. Phản ứng này còn được xúc tác bởi các kim loại như vanadi.
SO2 + 1⁄2 O2 → SO3
Khi được làm lạnh và gặp hơi nước SO3 phản ứng tạo H2SO4 tạo ra các aerosol mịn là các sol khí.
SO3 + H2O → H2SO4
nH2SO4 → (H2SO4)n (sol khí)
O2 tham gia các phản ứng quang hóa sinh acid sulfuric
SO2 + HOO* → SO3 + HO*
SO2 + HO* + M → HOSO2* + M
HOSO2* + O2 → HOSO2O2*
HOSO2O2* + *NO → HOSO2O* + *NO2
HOSO2O* + H* → H2SO4
Lượng SO2 được xác định bằng phương pháp quang phổ UV - Vis hoặc quang phổ huỳnh quang.
4.4 Khí ozon
Sự có mặt của ozon ở tầng đối lưu gây tác hại cho con người, thực vật và động vật. Ozon có tính oxy hóa mạnh, gây tổn thương niêm mạc. Sự gia tăng nồng độ của ozon gây các biểu hiện độc cấp tính như khó thở, họ và đau khi hít thở sâu. Các biểu hiện mạn tính là viêm, tổn thương đường thở, phổi, gây hen, viêm phế quản và các bệnh phổi mạn tính khác. Tăng nồng độ ozon trong khí quyển có thể làm tăng số cơn hen và tăng khả năng nhiễm khuẩn.
Nồng độ ozon thường cao vào những ngày ấm, nắng và hay xuất hiện trong khói đô thị (urban smog). Ngoài ra, nó có thể được vận chuyển theo dòng khí đến các vùng lạnh hơn.
Ở tầng đối lưu, ozon được hình thành do các phản ứng phức tạp của các nitrogen oxid và VOC như alkan, alken, hydrocarbon thơm, aldehyd dưới tác động của ánh sáng mặt trời.
Ozon được xác định bằng phương pháp quang phổ UV - Vis hoặc phát quang hóa học.
4.5 Chất dạng hạt
Chất dạng hạt là khối vật chất rắn hoặc lỏng không thấy rõ như sol khí (aerosol), bụi, hơi, mù, khói, hạt phun có mặt trong khí quyển, có kích thước từ cỡ phân tử 0,001km đến hạt bụi cỡ 100 um.
Hai đặc tính quan trọng của hạt là kích thước và thành phần của hạt.
Kích thước của hạt được quyết định bởi cách hạt đó được tạo thành.
- Kiểu hạt nhân (nucleation mode): hạt được tạo thành từ những quá trình ngưng tụ hơi nóng hoặc được tạo thành trong khí quyển thông qua chuyển đổi khí thành hạt. Hạt hình thành theo cách này thường có đường kính nhỏ hơn 0,2 um. Các hạt loại này chiếm phần lớn số lượng của các hạt trong khí quyển nhưng chỉ chiếm một phần khối lượng rất nhỏ.
- Kiểu tích tụ (accumulation mode): hạt lớn lên từ các hạt hình thành kiểu hạt nhân qua quá trình tích tụ hoặc ngưng tụ các hơi, thường có đường kính từ 0,2 đến 2 μm. Các hạt kiểu này đóng góp một phần lớn diện tích bề mặt và khối lượng của aerosol.
- Kiểu thô (coarse mode): được hình thành từ các quá trình cơ học như các hạt bụi đất, nước biển và hạt bụi công nghiệp, thường có đường kính lớn hơn 2 μm
Các hạt có kích thước nhỏ dưới 10 km có khối lượng đủ nhẹ để tồn tại lâu trong khí quyển. Các hạt có đường kính động học lớn hơn 2,5 km và nhỏ hơn 10 pm (PM10) được gọi là các hạt thô. Các hạt có đường kính động học nhỏ hơn 2,5 um (PM2,5) là các hạt mịn. Các hạt có đường kính động học nhỏ hơn 1 um (PM1) là các hạt siêu mịn.
Thành phần hóa học của các hạt thô và mịn cũng khác nhau. Các hạt mịn thường có thành phần hóa học là muối sulfat, muối nitrat, chỉ, hạt carbon và các chất hữu cơ.
Các hạt thô chủ yếu là vật liệu kết tinh (hợp chất carbonat, hợp chất kiềm và các nguyên tố đất hiếm). Thành phần hạt cho biết nguồn gốc và cách hạt tạo thành.
Các hạt trong khí quyển có tác động rất lớn tới sức khoẻ con người, lên hệ sinh thái, lên vật liệu và khí hậu.

- Ảnh hưởng lên sức khoẻ: các hạt có thể thâm nhập vào đường hô hấp. Hệ hô hấp có nhiều cơ chế đẩy các aerosol lắng đọng như lớp niêm mạc nhày giúp giữ lại các hạt, các phản ứng như hắt hơi, sổ mũi, ho, nuốt sẽ giúp loại các hạt ở đường hô hấp trên. Tuỳ kích thước, hình dạng, mật độ hạt mà hạt có thể thâm nhập vào các vùng khác nhau của hệ hô hấp và hệ tuần hoàn. Các hạt PM2s và PM, có thể thâm nhập sâu vào hệ hô hấp, do đó có khả năng ảnh hưởng tới sức khoẻ, có thể gây ra các bệnh hoặc gia tăng tần suất mắc các bệnh hô hấp, tim mạch, thậm chí có khả năng gây ung thư. Thành phần hóa học của các hạt cũng quyết định tác hại của chúng với cơ thể người phơi nhiễm. Ví dụ, các chất hữu cơ đa vòng thơm (PAH), các kim loại như As, Cd... có khả năng gây ung thư. Tuy nhiên không loại trừ việc các hạt mịn tự thân cũng có khả năng gây ung thư. IARC đã xếp hạt vào nhóm các chất gây ung thư (nhóm I). Đối tượng nhạy cảm là người bị bệnh tim mạch, phổi, người già, trẻ em.
- Ảnh hưởng lên khí hậu: các hạt trong khí quyển phản xạ, tán xạ ánh sáng làm tăng hoặc giảm hiệu ứng nhà kính. Các hạt làm giảm tầm nhìn, thay đổi hình thành mây, mưa, tuyết... Ngoài ra, hạt tham gia phản ứng hóa học, quang hoá, xúc tác trong khí quyển làm thay đổi cân bằng, đóng góp vào tác động chung của chất ô nhiễm tới môi trường.
- Tác động lên vật liệu: các hạt có thể gây ăn mòn kim loại, công trình công cộng, nhà cửa.
Hạt có nguồn gốc tự nhiên và nhân tạo. Ngoài ra hạt còn được chia thành hạt sơ cấp và hạt thứ cấp.
- Tự nhiên: ví dụ hạt từ núi lửa phun trào, hạt nước biển, phấn hoa, nấm, mốc, tảo, vi khuẩn, rác và sản phẩn phân hủy xác động thực vật, hạt do gió thổi vào đất, cát, đá làm bay và phát tán hạt và các hạt thâm nhập vào tầng đối lưu từ vũ trụ...
- Nhân tạo: hạt được phát thải từ một số nguồn nhân tạo như nhà máy sản xuất điện, quá trình cháy mở, các phương tiện giao thông (từ quá trình đốt cháy ở động cơ đốt trong, từ sự di chuyển phát tán bụi). Ngoài ra, các hoạt động xây dựng, hoạt động nông nghiệp như cày, bừa, đào mỏ, cháy rừng... cũng sinh ra và phát tán hạt vào khí quyển.
Xét trên phạm vi toàn cầu, các hạt có nguồn gốc tự nhiên chiếm tỷ lệ lớn do có những nguồn phát thải rất lớn như biển và đại dương. Tuy nhiên khi xét trên một khu vực diện tích nhỏ như ở các thành phố thì các hạt có nguồn gốc nhân tạo có thể nhiều hơn các hạt có nguồn gốc tự nhiên.
- Hạt sơ cấp (primary particles): hạt được phát thải trực tiếp từ nguồn thải vào khi quyển như hạt từ các nhà máy sản xuất điện, phương tiện giao thông...

- Hạt thứ cấp (secondary particles): hạt được hình thành trong khí quyển, từ quá trình ngưng tụ các hơi hoặc các phản ứng hóa học. Ví dụ, các hợp chất hữu cơ dễ bay hơi từ các nguồn khác nhau (đốt cháy, tự nhiên), trải qua quá trình oxy hóa tạo thành những hợp chất có khả năng bay hơi khác nhau, chúng ngưng tụ tạo thành các hạt. Các khí như SO2, NO2 bị oxy hóa thành acid sulfuric và nitric, ngưng tụ trên bề mặt các hạt hoặc hình thành hạt mới. Các hạt thứ cấp thường là những hạt mịn.
Sau khi các hạt được đưa vào trong khí quyển, kích thước, số lượng và thành phần
hóa học của chúng thay đổi theo nhiều cơ chế khác nhau cho đến khi chúng được loại bỏ nhờ các quá trình tự nhiên như kết tụ, sa lắng, mưa, tuyết, sương, bám dính vào lá cây, công trình xây dựng...
Nếu một hạt có kích thước và khối lượng đủ nhỏ, nó có thể tồn tại lơ lửng trong khí quyển trong một thời gian dài. Các hạt này cũng có thể được phát tán xa, trở thành phương tiện cho sự vận chuyển và biến đổi của các chất ô nhiễm khác. Ví dụ hạt mang acid có thể được loại khỏi khí quyển ở trạng thái khô hoặc ướt và gây ra hiện tượng mưa acid. Các chất hữu cơ, đặc biệt là các hợp chất có độc tính cao như dioxin, thuốc trừ sâu hữu cơ và kim loại nặng như thủy ngân có thể bám vào bề mặt hạt và phát tán đi xa. Các hạt tích điện cũng có thể liên kết và vận chuyển các chất ô nhiễm đi xa.
Lượng hạt được xác định bằng phương pháp khối lượng hoặc hấp thụ tia beta.
5 Chì
Tuỳ vào mức độ phơi nhiễm, chì có thể gây ảnh hưởng xấu lên hệ thần kinh, chức năng thận, hệ miễn dịch, hệ sinh trưởng, sinh sản và tim mạch. Các tác động của chì thường gặp là tác động thần kinh trên trẻ em và tác động trên hệ tim mạch của người lớn (huyết áp cao và các bệnh về tim). Hệ sinh thái gần các nguồn thải chì có nhiều tác động xấu như giảm đa dạng sinh học, giảm sinh trưởng và tốc độ sinh sản ở thực vật, ở động vật và các tác động thần kinh ở động vật có xương sống.
Trước đây nguồn phát thải chính của chì ra không khí là các phương tiện giao thông do sử dụng các nhiên liệu có chì. Sau khi thay thế bằng các nhiên liệu không có chì, hiện nay các nguồn chính thải chì ra khí quyển là khai thác quặng và chế biến kim loại, máy bay động cơ piston sử dụng nhiên liệu chứa chì. Nồng độ cao nhất của chì ở gần nơi nung chảy chì, làng nghề xử lý acqui. Các nguồn thải khác là buồng đốt khí thải, nhà máy sản xuất pin chì acid. Các nguồn phơi nhiễm khác có thể là sử dụng nước và thực phẩm có chì, hít hoặc nuốt phải đất, bụi có chì. Các bức tranh sơn có chì là một nguồn sinh ra chì trong nhà. Chì bền vững trong môi trường và tích tụ trong đất từ việc lắng đọng trong không khí, phát thải trực tiếp của nước thải ra các nguồn nước.
Lý do được đưa ra đầu tiên để loại chì ra khỏi xăng là do sử dụng chì trong xăng gây tác động đến bộ chuyển đổi xúc tác, làm tăng thải CO, NOx và các chất hữu cơ dễ bay hơi (VOC). Sau khi sử dụng xăng không pha chì, nồng độ chì trong không khí xung quanh đã giảm đáng kể.
Lượng chì trong không khí được xác định bằng phương pháp quang phổ hấp thụ nguyên tử.
6 Một số chỉ tiêu đánh giá ô nhiễm trong không gian kín
Trong cuộc sống hiện đại, con người dành một lượng lớn thời gian trong các không gian kín như nhà, ô tô, văn phòng. Ví dụ người Đức dành 80 - 90% thời gian trong không gian kín, người Mỹ dành 87% thời gian trong nhà và 6% thời gian trong phương tiện giao thông khép kín. Ở các nước đang phát triển con người ở đô thị dành 79% thời gian trong nhà và ở khu nông thông khoảng 65%. Hơn nữa để tăng cường hiệu quả năng lượng, thiết kế các ngôi nhà thường kín hơn so với trước đây. Một trong những hội chứng hay gặp do ở tiếp xúc với môi trường không khí trong nhà ô nhiễm là hội chứng nhà nhiễm bệnh (Sick building syndrome). Các biểu hiện hay gặp là đau đầu, chóng mặt, đau tức ngực, mắt, họng, sốt, đau cơ, da khô, có thể có trường hợp bị ngất. Những biểu hiện này được cải thiện khi ra khỏi toà nhà. Ô nhiễm trong nhà gây ra khoảng 1,6 triệu người chết hàng năm (chưa tính những trường hợp do hút thuốc) và được coi là một trong những nguyên nhân hàng đầu gây tử vong trên thế giới. Do đó mối quan tâm dành cho ảnh hưởng của ô nhiễm trong nhà lên sức khoẻ ngày càng được quan tâm.
Các nguyên nhân gây ô nhiễm trong không gian kín thường do các đồ vật trong nhà như đồ nội thất, vật liệu xây dựng, đồ dùng văn phòng và các hoạt động của con người như hút thuốc lá, nấu ăn, lau dọn, sửa nhà, phun thuốc diệt côn trùng trong nhà (diệt côn trùng, diệt mối, bảo vệ gỗ...) đặc biệt là các hoạt động đốt nhiên liệu sinh học. Ngoài ra, một số chất ô nhiễm ở bên ngoài nhà có thể xâm nhập vào trong nhà qua nhiều cách như qua cửa, ống khói, các hệ thống thông gió...
Các chất ô nhiễm chính thường thấy trong nhà là các khí sinh ra từ các phản ứng cháy, các hợp chất hữu cơ dễ bay hơi, chất có tính phóng xạ. Ngoài ra còn có các hạt bụi có kích thước nhỏ với thành phần hóa học và kích thước khác nhau. Nhìn chung thành phần hóa học rất phong phú, đa dạng. WHO đã đưa ra các tiêu chí để chọn lựa các hợp chất vào danh mục các chất cần có hướng dẫn. Các tiêu chí đó là:
- Được sinh ra từ các nguồn trong không gian kín.
- Có các dữ liệu về độc tính và dịch tễ.
- Nồng độ trong không gian kín vượt quá nồng độ gây nguy cơ về sức khỏe.
Từ đó WHO đã đưa ra bộ hướng dẫn cho 10 chất/nhóm chất cần quan tâm trong ô nhiễm trong không gian kín kèm theo một số ngưỡng an toàn khuyến cáo, tuy nhiên hiện nay chưa có bộ tiêu chuẩn các nồng độ cho phép của các chất ô nhiễm trong không khí trong không gian kín. Đáng chú ý là các khuyến cáo về ngưỡng an toàn được đưa ra dựa trên giả thuyết không có khói thuốc lá trong không gian này (Bảng 2.2).
Bảng 2.2. Một số chất ô nhiễm trong không gian kín theo khuyến cáo của WHO (2010)
| TT | Chất/nhóm chất | Độc tính | Nguồn gốc | Ngưỡng an toàn khuyến cáo | Cách hạn chế |
| 1 | Benzen | Gây ung thư | Khói thuốc lá, dung môi tẩy rửa, các vật liệu xây dựng | Không có ngưỡng an toàn | |
| 2 | Carbon monoxid | Các phản ứng đốt cháy trong nhà như từ lò sưởi, bếp, hút thuốc lá và từ ống khí thải của các phương tiện giao thông để trong nhà. | 15 phút: 100 mg/m3 | ||
| 3 | Formaldehyd | Kích ứng | 30 phút: 0,1 mg/m3 | Sử dụng các vật liệu xây dựng và sản phẩm không sinh HCHO, hạn chế khói thuốc lá và các nguồn đốt cháy khác, thông thoáng khí | |
| 4 | Naphthalen | Tổn thương hệ hô hấp, gây viêm, xuất hiện khối u | Các thuốc diệt côn trùng chứa Naphthalen | 1 năm: 0,01 mg/m3 | Hạn chế/ cấm sử dụng các thuốc diệt côn trùng chứa naphthalen |
| 5 | Nitrogen dioxid | Kích ứng hệ hô hấp, giảm đề kháng | Ống xả của phương tiện giao thông trong nhà, máy sưởi, lò sưởi, khói thuốc lá. | Trung bình 1 giờ: 200 μg/m3 | |
| 6 | Hợp chất hữu cơ đa vòng thơm (PAH) | Gây ung thư phổi, thường gắn với chất dạng hạt | Hít phải các hạt chứa PAH Là hỗn hợp nhiều chất, bản chất và nồng độ khác nhau | Đánh giá nguy cơ thông qua nồng độ của B[a]P Không có ngưỡng an toàn | |
| 7 | Radon | Gây ung thư phổi và các loại ung thư khác | được sinh ra tự nhiên trong đất, là sản phẩm trong chuỗi phân hủy của khoáng uranium - 238 | Không có ngưỡng an toàn | |
| 8 | Tricloroethylen | Gây ung thư | Không có ngưỡng an toàn | ||
| 9 | Tetracloroethylen | Ảnh hưởng lên thận | 1 năm: 0,25 mg/m3 | ||
| 10 | Các chất dạng hat (PM1; PM2,5; PM10) | - Gây dị ứng (phấn hoa, lông động vật, phân bụi ve, mèo, chó, chuột, gián, nấm), gây hắt hơi, ngứa, mẩn, khởi phát cơn hen... | - Nấu ăn, hút thuốc, đốt lửa, chất dập lửa, chất cách âm, cách nhiệt hoặc cách điện, vật liệu xây dựng, nội thất, đồ chăm sóc cá nhân... | Lau dọn thường xuyên |
Để giảm thiểu các chất ô nhiễm trong không gian kín, cần quản lý nguồn thải, hạn chế sử dụng các sản phẩm không cần thiết, đặc biệt là các sản phẩm có chứa VOC, hạn chế hút thuốc, sử dụng đồ trong không gian kín theo hướng dẫn của nhà sản xuất, thường xuyên lau dọn và thiết kế không gian hợp lý, thông thoáng.
7 Một số phương pháp kiểm soát các chất ô nhiễm môi trường không khí
Để kiểm soát được các chất ô nhiễm không khí, đầu tiên cần tìm ra nguyên nhân, nguồn gốc phát sinh chất ô nhiễm, sau đó áp dụng các biện pháp thích hợp để giảm thải Về mặt kỹ thuật, có thể áp dụng các biện pháp thay thế nguyên liệu, công nghệ để ngăn cản sự tạo thành các chất ô nhiễm. Tuy nhiên đối với phần lớn các trường hợp, thay đổi công nghệ, nhiên liệu là điều ít khả thi. Đồng thời dù có thay đổi công nghệ và nhiên liệu vẫn sinh ra một lượng chất ô nhiễm nhất định. Do đó biện pháp hay được sử dụng nhất và luôn dùng để phối hợp với các biện pháp về thay đổi khoa học công nghệ là loại bỏ, thu hồi các chất ô nhiễm. Một số phương pháp để loại bỏ, thu hồi các chất ô nhiễm hay được sử dụng là: hấp thụ, hấp phụ, ngưng tụ, phản ứng hóa học, đốt cháy và khuếch tán qua màng chọn lọc.
7.1 Phương pháp hấp thụ
Phương pháp này sử dụng dung môi và thiết bị thích hợp hoà tan phần hơi, Cơ chế hấp thụ xảy ra theo 3 bước:
- Các phân tử chất ô nhiễm khuếch tán từ khí đến bề mặt của chất lỏng.
- Các phân tử khí hoà tan vào dung môi lỏng ở bề mặt tiếp xúc.
- Các chất tan khuếch tán từ bề mặt tiếp xúc vào trong lòng dung môi.
Sự hấp thụ các chất khí vào dung môi lỏng có thể có kèm theo các phản ứng hóa học. Các dung môi hay dùng là nước để hấp thụ acid và base tan trong nước như HCI, HF, NH3; dung dịch kiềm như NaOH loãng để hấp thụ các khí SO2, Cl2, H2S; thêm chất oxy hóa khử để phản ứng với chất ô nhiễm; dung môi hữu cơ ít bay hơi như dimethylanilin và amin để hấp thụ các chất không tan trong nước như hydrocarbon.
Để tăng diện tích tiếp xúc có thể chia nhỏ dung môi thành các hạt nhỏ hoặc lớp mỏng. Cho luồng khí và dung môi di chuyển ngược chiều nhau sẽ làm tăng hiệu suất.
Trong công nghiệp sử dụng nhiều loại tháp hấp thụ khác nhau để loại bỏ khí ô nhiễm ra khỏi dòng khí như tháp rửa rỗng, tháp đệm, tháp đĩa lưới, tháp phun tia... Các tháp này có đường ống dẫn các khí thải vào, sau đó khí thải tiếp xúc với dung môi hấp thụ. Chất khi nào có tương tác với chất hấp thụ sẽ bị giữ lại. Các khí không tương tác sẽ đi theo dòng khí đi ra ngoài tháp. Nếu khí này đạt tiêu chuẩn xả thải thì sẽ được thải trực tiếp ra môi trường. Nếu khí chưa đạt tiêu chuẩn thì sẽ được cho đi qua các bước xử lý khác. Các chất hấp thụ khi đã bão hòa thì sẽ được hoàn nguyên hoặc loại bỏ. Các chất hấp thụ không được hoàn nguyên cần được xử lý như nước thải. Các chất hấp thụ mới hoặc đã được hoàn nguyên được đưa vào thay thế. Các sản phẩm sinh ra từ quá trình hấp thụ cần được thu hồi để xử lý.
7.2 Phương pháp hấp phụ
Phương pháp sử dụng các bề mặt rắn xốp để giữ lại các khí. Các chất rắn dùng để hấp phụ cần phải có diện tích bề mặt lớn, tỷ lệ diện tích/thể tích lớn và xốp. Phương pháp này được dùng để loại những chất ô nhiễm có nồng độ thấp.
Các nhóm chất hấp phụ chính:
- Đối với các chất rắn không phân cực, ví dụ than hoạt tính, quá trình hấp phụ chủ yếu là vật lý. Than hoạt tính hấp phụ tất cả các chất khí và thường độ hấp phụ tỷ lệ với nồng độ của chất khí. Cách này thường được áp dụng với khí thải có thể tích lớn và có nồng độ chất ô nhiễm thấp, hoặc để giảm nồng độ các chất khí đến nồng độ vết. Trên thực tế có thể sử dụng để xử lý mùi và loại các dung môi dễ bay hơi như benzen, Ethanol và tricloroethylen trong dòng khí thải.
- Đối với các chất rắn phân cực, ví dụ nhôm hoạt tính, silica gel, rây phân tử... quá trình hấp phụ là hóa học và không có sự thay đổi trong cấu trúc hóa học của các phân tử hoặc bề mặt. Các chất này có độ chọn lọc cao với các khí phân cực. Do đó chúng thường được dùng để hấp phụ các chất phân cực như hơi nước, NH3, H2S, SO2... Các chất này có khả năng hấp phụ nước mạnh, do đó trong điều kiện có nhiều hơi nước, khả năng hấp phụ chất ô nhiễm giảm.
Trong công nghiệp sử dụng tháp hấp phụ. Các khí thải được đưa vào tháp hấp phụ, ở đó xảy ra sự hấp phụ, khí sạch được dẫn ra ngoài. Có thể thiết kế hai tháp hấp phụ để tiến hành xen kẽ nhau: thực hiện quá trình hấp phụ trên một tháp và tiến hành hoàn nguyên vật liệu trên tháp thứ hai. Quá trình hoàn nguyên được thực hiện bằng cách cho hơi nước đi qua lớp chất hấp phụ, cuốn các chất ô nhiễm ra ngoài đến thiết bị ngưng tụ. Ở thiết bị này, nước được tách ra khỏi chất ô nhiễm, chất ô nhiễm được tách ra và tiếp tục xử lý.
7.3 Phương pháp ngưng tụ
Phương pháp này được thực hiện trong thiết bị thích hợp có bộ phận làm lạnh để ngưng tụ hơi và bộ phận loại bỏ phần chất lỏng. Phương pháp này được dùng để loại các khí có áp suất riêng phần tương đối thấp.
7.4 Phương pháp đốt cháy
Phương pháp này sử dụng buồng đốt có thể đốt ở nhiệt độ cao để phản ứng cháy xảy ra hoàn toàn, sinh ra các sản phẩm không độc như CO2, H2O. Phương pháp này thường được áp dụng với các chất thải nguy hại.
7.5 Phương pháp dùng màng chọn lọc
Phương pháp này ít được sử dụng hơn. Các màng chọn lọc thường là polyme có hoặc không có lỗ xốp, tương tác với các chất ô nhiễm (khí, hơi, lỏng) và giữ chúng lại trên màng lọc. Các chất ô nhiễm này được loại ra khỏi dòng khí thải và được thu hồi, tái sử dụng nếu phù hợp. Ví dụ, màng chọn lọc CO2, H2S, H2 được sử dụng khi lọc khí thiên nhiên.
7.6 Một số kỹ thuật kiểm soát chất ô nhiễm không khí
Phần sau đây sẽ trình bày về cách kiểm soát các chất khí tiêu chuẩn trong đánh giá chất lượng môi trường không khí xung quanh.
7.6.1 Kiểm soát CO
Giao thông vận tải thải ra một lượng lớn CO. Vì vậy kiểm soát ô nhiễm CO trước hết phải tính đến hạn chế khí thải ở lĩnh vực này. Để giảm thiểu lượng khí thải từ động cơ đốt trong, người ta đã đi theo những hướng nghiên cứu khác nhau:
- Cải tiến động cơ đốt trong nhằm tăng hiệu suất đốt cháy, giảm chất ô nhiễm trong quá trình đốt nhiên liệu.
- Thay thế nhiên liệu truyền thống bằng các nhiên liệu mới.
- Nghiên cứu các loại động cơ khác nhau cho động cơ đốt trong.
- Biến đổi chất ô nhiễm trong quá trình đốt, để sinh ra các sản phẩm ít độc hơn như lắp đặt hệ thống chuyển đổi xúc tác hai chiều (dùng các kim loại quý để làm xúc tác như platinum, paladium, rhodi): oxy hóa CO thành CO2 và khử NOx thành N2. Để quá trình xúc tác đạt hiệu suất cao, các động cơ này cần sử dụng nhiên liệu không có chì, do chì bao phủ bề mặt xúc tác, làm giảm hiệu suất. Hệ thống chuyển đổi xúc tác làm giảm lượng khí thải CO tới 80%.
7.6.2 Kiểm soát NO2
Vì hai nguồn chính sinh ra NO2 là đốt cháy trong giao thông vận tải và công nghiệp nên việc kiểm soát NO2 cần tập trung vào hai lĩnh vực này.
- Đối với phương tiện giao thông: dùng xúc tác chuyển đổi hai chiều NO → N2 cùng với chuyển CO → CO2 (xem phần kiểm soát CO).
- Đối với công nghiệp: kiểm soát tỷ lệ không khí/nhiên liệu để làm giảm nhiệt, giảm lượng không khí tiếp xúc với nhiệt, tăng thời gian cháy ở giai đoạn làm giàu nhiên liệu... sẽ làm tăng sự chuyển N trong nhiên liệu thành N. NOx trong khi sau khi đốt có thể được xử lý bằng cách thêm vào hỗn hợp phản ứng một lượng các chất khi như NH3 (hay dùng nhất), Urea, acid isocyanic (HOCN)3 ở nhiệt độ thích hợp để chuyển NO thành N2.
Hai kỹ thuật được dùng trong việc dùng NH3 loại NOx ra khỏi dòng khí là kỹ thuật khử chọn lọc không xúc tác và khử xúc tác chọn lọc.
- Khử không xúc tác: bơm NH3 vào dòng khí, khử NO thành N2 và H2O trong sự có mặt của khí oxy
4 NO + 4 NH3 + O2 → 4 N2 + 6 H2O
Phản ứng này xảy ra mạnh mẽ ở nhiệt độ từ 1070 K đến 1270 K. Nhưng ở nhiệt độ trên 1370 K xảy ra phản ứng sau tạo thành sản phẩm NO không mong muốn, do đó cần khống chế nhiệt độ ở dưới 1300 K.
4 NH3 + 5 O2 → 4 NO + 6 H2O
- Khử xúc tác chọn lọc: sử dụng chất xúc tác như nhôm oxid (Al2O3), titan dioxid (TiO2), vanadi oxid (V2O5) để NH3 phản ứng chọn lọc với NO với nhiệt độ tối ưu từ 570-720 K.
7.6.3 Kiểm soát SO2
Các nguyên tắc kiểm soát giảm thải SO2:
- Loại lưu huỳnh trong nhiên liệu trước khi đốt cháy: các dạng lưu huỳnh khác nhau có thể được loại ra khỏi nhiên liệu qua các bước làm sạch như rửa bằng dung môi thích hợp, sấy...
- Loại khí SO2 trong dòng khí thải: hấp phụ bằng chất rắn như than hoạt tính sau đó giải hấp, thu hồi SO2 để sản xuất acid sulfuric hoặc hấp thụ khí thải bằng dung dịch thích hợp. Sản phẩm tạo thành có thể được loại bỏ hoặc thu hồi để sản xuất acid sulfuric.
+ Dùng tác nhân phản ứng với khí SO2 sinh ra sản phẩm, sản phẩm này sẽ bị loại bỏ sau đó.
Hay sử dụng tác nhân mang tính kiềm như đá vôi (CaCO3) và vôi (CaO), sinh ra CaSO3/CaSO4 sau đó các chất này được loại ra và chôn ở bãi chôn. Phương pháp này có thể giảm tới 90% lượng khí thải SO2. Các tác nhân này có thể được phun vào dòng khí nóng, dưới nhiệt độ cao của dòng khí nước bay hơi và các sản phẩm tạo thành được thu lại hoặc được đưa trực tiếp vào lò, sau đó loại sản phẩm sulfat tạo thành bằng nước.
Phản ứng loại SO2 bằng CaCO3:
CaCO3 + SO2 + 2H2O → CaSO3.2H2O + CO2
Phản ứng loại SO2 bằng CaO:
CaO+ SO2 + 2H2O → CaSO3.2H2O
Ngoài ra, CaSO3 có thể chuyển thành CaSO4, là một dạng kết tủa khó loại bỏ hơn. Do đó thường tiến hành phản ứng ở pH cao hơn 8 để giảm việc tạo CaSO4 và giảm độ tan của CaSO3 để dễ loại bỏ hơn.
+ Sử dụng tác nhân mang tính kiềm tách SO2 ra khỏi dòng khí bằng phản ứng hóa học sau đó thu hồi lưu huỳnh (thường ở dạng SO2 lỏng hoặc acid sulfuric) và sử dụng cho mục đích khác. Một số tác nhân hay dùng là Na2O, MgO, Na2SO3, carbonat kim loại.
Phản ứng khi dùng Na2SO3:
Na2SO3 + SO2 + H2O → 2NaHSO3
Na2SO3 + 1⁄2 O2 → Na2SO4
NazSO4 có độ tan thấp hơn Na2SO3 do đó được loại bỏ bằng cách cho kết tủa. Dung dịch còn lại được đun nóng sinh ra SO2
2NaHSO3 → Na2SO3 + SO2 + H2O
Khí SO2 tạo thành có nồng độ khá đậm đặc (85% SO2 và 15% H2O), có thể được khử về S và oxy hóa thành acid sulfuric.
Thông thường trong khí đốt có cả NOx và SOx. Hai phương pháp hay được sử dụng phổ biến để loại cả SOx và NOx ra khỏi dòng khí là phương pháp khô và phương pháp dùng dòng electron:
- Phương pháp khô: dòng khí nóng ở nhiệt độ 673 K được đưa vào buồng phản ứng chứa đồng oxid (CuO) trên nhôm oxid (Al2O3), khi đó SO2 phản ứng với CuO tạo ra Đồng Sulfat (CuSO4)
CuO +1/2 O2 + SO2 → CuSO4
CuSO4 và CuO đóng vai trò là chất xúc tác để NO phản ứng với NH3
4NO + 4NH3 + O2 → 4N2 + 6H2O
Khi buồng phản ứng bão hoà CuSO4, dòng khí được chuyển sang buồng phản ứng khác. CuSO4 được khử về Cu nhờ khí hydro:
CuSO4+2H2 → Cu + SO2 + 2H2O
Khí SO2 sinh ra được dùng để sản xuất acid sulfuric. Cu bị oxy hóa thành CuO và đem quay vòng sử dụng.
Cu + 1⁄2 O2 → CuO
Quá trình có thể được áp dụng riêng cho xử lý NO, khi bỏ qua giai đoạn hồi sinh Cu từ CuSO4; áp dụng riêng cho xử lý so, khi bỏ qua giai đoạn thêm amoniac.
- Phương pháp dùng dòng electron: dòng electron sinh ra từ điện trường được đưa qua dòng khí thải va chạm chủ yếu với nước và khí oxy sinh ra các ion và các ion này phản ứng với các khí sinh ra các nguyên tử và gốc tự do phản ứng với các chất khí ô nhiễm sinh ra các acid và oxid, các sản phẩm này được loại ra bằng các base như Ca(OH)2. Hiệu suất loại bỏ NOx và SO, có thể lên tới 90%.
7.6.4 Kiểm soát O3
Nguyên tắc kiểm soát O3 là giảm thải các NOx và các VOC.
Để giảm thải VOC, nhiều biện pháp có thể được tiến hành như siết chặt hơn định về khi thải của phương tiện giao thống vận tải, thay đổi thiết kế vòi bơm xăng để thu lại phần khí khi đổ xăng, thay đổi quy trình sử dụng dung môi chứa ít VOC hơn hoặc sử dụng than hoạt tính để hấp phụ VOC ở đường ống thải. Vì VOC là một thành phần quan trọng của không khí trong không gian kín nên giảm thải VOC trong nhà được trình bày cụ thể hơn ở phần sau.
7.6.5 Kiểm soát hạt
Các hạt nhỏ thường có thời gian lưu trong không khí dài. Các quá trình phân tích hạt và các thiết bị được thiết kế để giảm thời gian lưu của các hạt.
Để làm giảm nguồn bụi nhân tạo, nhiều hệ thống kiểm soát đã được phát triển. Ngoài ra các chuẩn phát thải đã được áp đặt cho phát thải hạt thô, hạt mịn, hạt thứ cấp, tạo điều kiện hoàn thiện các hệ thống kiểm soát phù hợp, đặc biệt là ở các nước đã phát triển như Mỹ, Anh, Cộng đồng chung châu u...Tuy nhiên, ở Việt Nam hiện nay quy định này chưa cụ thể, rõ ràng. Tiêu chuẩn xả thải công nghiệp ở Việt Nam (QCVN 19:2009/BTNMT - Phụ lục 2) mới có quy định thải bụi tổng và bụi chứa silic, chưa cho quy định cụ thể cho các loại bụi theo kích thước khác nhau.
Để làm giảm các hạt sinh ra từ các nguồn di động như các phương tiện giao thông vận tải, nhiều biện pháp đã được sử dụng như giảm số lượng phương tiện, giảm tốc độ phương tiện, cải thiện chất lượng mặt đường và thêm các chất kết dính hạt trên mặt đường.
Để làm giảm các hạt sinh ra từ các nguồn cố định như nhà máy sản xuất, hộ gia đình, các hạt được loại ra khỏi dòng khí nhờ lực hỗ trợ bên ngoài hoặc vật cản. Người ta lựa chọn hệ thống thích hợp dựa trên 4 đặc điểm: nồng độ hạt trong dòng khí, phân bố kích thước của các hạt, tốc độ dòng khí và nồng độ hạt cho phép.
Một số thiết bị được sử dụng để loại hạt trong dòng khí:
- Thiết bị thu cơ học (buồng lắng): các thiết bị thu hạt bằng lực trọng trường, hoặc các tác động trơ trên các hạt. Các thiết bị hoạt động theo cơ chế này loại bỏ được các hạt nặng có kích thước lớn (khoảng 50 um), do đó thường được sử dụng đầu tiên để loại thô các hạt lớn và các hạt sắc nhọn trước khi dòng khí đi qua các thiết bị khác.
- Buồng góp xoáy (cyclone): thiết bị được sử dụng rộng rãi nhất, sử dụng lực ly tâm gia tốc để loại các hạt ra khỏi dòng khí. Buồng gặp xoáy có thể được cấu tạo từ nhiều vật liệu khác nhau như kim loại, gốm sứ có khả năng chịu nhiệt, hạt sắc nhọn, không khí ăn mòn. Bề mặt thiết bị cần trơn để các hạt rơi và trượt xuống dễ dàng. Có thể loại được hơn 90% các hạt có kích thước lớn khoảng 15 - 20 um, thậm chí có những thiết bị mới có thể loại được hơn 98% các hạt có kích thước 5 um.
- Túi lọc vải: sử dụng các sợi lọc, giữ các hạt trên cối lọc nhờ chuyển động nhiệt. Phương pháp này tin cậy, hiệu quả, rẻ với khí có ít bụi. Hiệu suất có thể lên tới trên 99%, loại được các hạt cỡ nhỏ đến kích thước 0,3 km. Bụi được tách ra khỏi vật liệu lọc định kỳ bằng cách lắc, rung hoặc thổi khí sạch ngược chiều.
- Tĩnh điện: tích điện hạt, thu các hạt vào điện cực trái dấu và loại bỏ các hạt. Thiết bị này có thể loại được áp dụng rộng rãi khi lượng khí thải lớn như khí thải nhà máy điện hoặc quy mô nhỏ như hút bụi ở hộ gia đình. Thiết bị này loại được những hạt mịn dưới 1 um và hiệu suất loại hạt có thể lên tới trên 99%.
- Các thiết bị lọc ướt: dùng một chất lỏng (thường là nước) để loại bỏ các chất ô nhiễm dạng hạt. Loại được đến 80% các hạt có kích thước từ 0,5 - 10 um
Một số hiện tượng ô nhiễm môi trường không khí

7.7 Khói quang hóa
7.7.1 Đặc điểm
Khói quang hóa là hỗn hợp các khí và hạt aerosol. Thông thường nó có màu nâu do các hạt rắn và lỏng lơ lửng làm tán xạ ánh sáng.
Khói quang hóa khác với không khí bình thường ở hai đặc điểm. Thứ nhất, nó chứa các chất hữu cơ phân tử lượng lớn, thường là các chất vòng thơm, nhiều hơn so với không khí bình thường. Do các chất phân tử lượng lớn và cồng kềnh thường bị phân hủy nhanh, nó không tồn tại đủ lâu để khuếch tán đi các vùng khác. Thứ hai, nồng độ NOx và các chất hữu cơ cao hơn không khí thông thường, sinh ra nhiều ozon hơn thông qua các phản ứng quang hóa. Ozon được dùng làm chỉ thị cho sự có mặt của các chất ô nhiễm khác. Khói quang hóa thường xảy ra vào mùa hè khi có nhiều ánh sáng mặt trời nhất.
Địa hình và thời tiết có tác động lớn đến sự hình thành và tồn tại của khói mù quang hóa. Ở thành phố, đặc biệt là các thành phố ở thung lũng, các chất khi sinh ra khó được vận chuyển đi xa, do đó có khả năng sinh ra hiện tượng khói mù quang hóa nhiều hơn các đô thị ở đồng bằng. Một số hiện tượng thời tiết nghịch đảo nhiệt giảm khả năng di chuyển của các chất ô nhiễm tới các nơi khác, do đó nó giữ các chất ô nhiễm ở gần mặt đất và làm cho hậu quả của khói mù quang hóa trầm trọng hơn
7.7.2 Nguồn gốc
Một số chất ô nhiễm trong khói quang hóa được phát thải trực tiếp từ nguồn (chất ô nhiễm sơ cấp), một số hình thành từ các quá trình hóa học, vật lý trong khí quyển biến đổi các khí hoặc hạt sơ cấp (chất ô nhiễm thứ cấp).
Hai chất ô nhiễm sơ cấp chính là nitrogen oxid và VOC, dưới tác động của ánh sáng mặt trời chúng kết hợp với nhau theo một chuỗi các phản ứng sinh ra các chất ô nhiễm thứ cấp như ozon, peroxyl acetyl nitrat (PAN).
Khói quang hóa được hình thành khi các chất hữu cơ hoạt tính được phân hủy quang học hoặc oxy hóa bởi *OH, HO2* hoặc O* hình thành nên các gốc tự do. Những gốc này biến đổi NO thành NO2, tiếp tục sinh ra O*, nguyên tử này phản ứng với O2 để tạo thành O3.
Acetaldehyd, sản phẩm sinh ra từ oxy hóa ethan là tiền chất của một chất ô nhiễm quan trọng trong khói quang hoá, đó là PAN. PAN gây kích ứng mắt nhưng không gây nguy hiễm nghiêm trọng đến sức khoẻ con người. Nó gây hại cho cây, gây bạc lá. Trong không khí không ô nhiễm PAN có nồng độ khoảng 2 đến 100 ppt. Trong không khí ô nhiễm nồng độ PAN có thể lên tới 35 ppb. PAN chỉ được sinh ra vào ban ngày, khi có ánh sáng mặt trời.
C2H6 + *OH → C2H5* + H2O
C2H5* + O2 → C2H5O2*
NO + C2H5O2* → NO2 + C2H5O*
C2H5O* + O2 → CH3CH(=O) + HO2*
CH3CH(=O) + *OH →CH3C(=O)* + H2O
CH3C(=O)* + O2 → CH3C(=O)O2* (+M)
CH3C(=O)O2* + *NO2 ⇔ CH3C(=O)O2NO2 (PAN)
Phản ứng cuối là phản ứng hai chiều, phụ thuộc vào nhiệt độ. Nhiệt độ tăng thì nồng độ PAN giảm. Khi PAN bay lên cao, nơi nhiệt độ giảm, nó tồn tại được lâu hơn và phân tán bởi gió. Sau đó, nó có thể được phân ly, sinh ra các tiền chất của ozon.
7.7.3 Tác động
Tuỳ theo tình hình thời tiết, khói quang hóa có thể tồn tại vài ngày cho đến hơn 1 tuần. Trong giai đoạn ô nhiễm, không khí thường ít di chuyển (do nghịch đảo nhiệt) dẫn đến sự gia tăng nồng độ các chất ô nhiễm ở các ngày sau đó. Khói quang hóa gây ra các tác động đến môi trường, sức khỏe con người và ảnh hưởng đến vật liệu.
- Ảnh hưởng lên thực vật
Các hóa chất như nitrogen oxid, ozon và PAN... có thể gây tác động nghiêm trọng lên thực vật, làm chậm phát triển hoặc ngừng phát triển do giảm tổng hợp quang học. Ozon và PAN là những chất đặc biệt nguy hiểm cho cây.

- Ảnh hưởng lên sức khỏe
Khỏi quang hóa có thể gây nhiều tác hại lên sức khỏe con người.
Nitrogen oxid gây ra các vấn đề tim, phổi, giảm miễn dịch. VOC gây kích ứng mắt, bệnh hô hấp, một vài chất VOCs là chất gây ung thư. Ozon kích ứng hô hấp, kích ứng mắt. PAN gây kích ứng mắt và các vấn đề liên quan đến hô hấp.
Formaldehyd là aldehyd hay gặp nhất trong khói quang hoá. Do có khả năng tan tốt trong nước, nó gây ảnh hưởng tới đường hô hấp. Tuỳ theo nồng độ, nó có thể gây kích ứng mắt, kích ứng đường thở, bệnh phổi hoặc chết người (khi nồng độ lớn hơn 100 ppm). HCHO được phân hủy và sinh ra các tiền chất của ozon.
- Ảnh hưởng lên vật liệu
Ozon có khả năng phân hủy nhiều hợp chất, gây nứt Cao Su, giảm độ bền của vải, bạc màu nhuộm. Ozon gây tác động lên các tác phẩm nghệ thuật, sách vở. Do đó, nhiều bảo tàng và thư viện đang kiểm soát lượng O3 trong môi trường để làm giảm tác động này.
7.7.4 Giải pháp
Giải pháp hiệu quả để giảm lượng chất ô nhiễm thứ cấp sinh ra trong không khí là giảm phát thải các chất ô nhiễm sơ cấp, cụ thể là NOx và VOC. Nguyên tắc và các kỹ thuật giảm thiểu đã được giới thiệu ở phần trên.
7.8 Lắng đọng acid
7.8.1 Đặc điểm
Lắng đọng acid (acid deposition) hiện đang là một trong những vấn đề ô nhiễm môi trường không khí quan trọng nhất. Sự gia tăng lắng đọng acid, đặc biệt là mưa acid là hậu quả của các hoạt động của con người. Tác động của mưa acid không dừng lại ở một địa phương, một quốc gia mà có thể ảnh hưởng đến một khu vực rộng lớn. Để giải quyết vấn đề này cần sự tham gia của nhiều quốc gia.
Lắng đọng acid xuất hiện khi một acid, thường là acid sulfuric, acid nitric, hoặc acid hydrocloric được phát thải vào không khí hoặc hình thành trong không khí và lắng đọng xuống đất, hồ, thực vật, động vật và các công trình xây dựng. Lắng đọng acid có thể là khô hoặc ướt. Lắng đọng acid khô là lắng đọng trực tiếp của các khí acid, bụi acid, sol khí acid. Lắng đọng acid ướt là các acid hoà tan trong nước mưa (mưa acid), sương mù (mù acid), hoặc hạt aerosol lỏng (khói acid). Mưa acid là mưa có pH thấp hơn pH của nước mưa tự nhiên. Năm 2011, nồng độ của khí CO2 trong không khí thông thường là khoảng 393 ppm. Một phần CO2 này hoà tan trong nước mưa, do đó nước mưa thường mang tính acid và có pH khoảng 5,6. pH của mưa acid dao động từ 2 đến 5, thậm chí có thể thấp hơn 2, pH mù sương acid có thể tới 2,2 thậm chí thấp dưới 1,7. Thành phần chính gây mưa acid là acid sulfuric, gây mù acid là acid nitric.
7.8.2 Nguồn gốc
Hiện tượng lắng đọng acid là do sự xuất hiện các khí SOx, NOx, HCI trong khí quyển. Các khí SOx, NO, tham gia các phản ứng trong khí quyển sinh ra acid nitric và acid sulfuric.
Khí SO, và NO, sau khi thải ra ngoài khí quyển tham gia các phản ứng với các tác nhân oxy hóa pha khí hoặc pha lỏng.
Oxy hóa trong pha khi đã được trình bày ở phần các khí ô nhiễm nitrogen dioxid và sulfur dioxid.
Oxy hóa trong pha lỏng:
Khí SO2 được hoà tan trong nước tạo thành H2SO3 và phân ly thành HSO3 và SO3-. HSO3 có thể được oxy hóa thành SO42- và giải phóng H*:
SO2 + H2O → H2SO3
H2SO3 → H+ + HSO3-
HSO3- → H++ SO32-
HSO3- + H2O2 + H+ → SO42- + H2O + 2 H+
Trong các giọt mưa, quá trình hoà tan và phản ứng có thể chuyển hóa 60% SO thành SO42- trong vòng 20 phút.
Acid nitric và acid sulfuric lắng đọng xuôi chiều gió ở khu vực đô thị, được gia tăng bởi mây và sương, gây ra hiện tượng lắng đọng acid mang tính khu vực.
Các khí SOx, NOx, HC1 có nguồn gốc tự nhiên và nhân tạo. Nguồn gốc sinh SOx, NOx đã được trình bày ở các phần trên. Acid phổ biến nhất trong không khí là acid sulfuric, sinh ra từ các nhà máy nhiệt điện, nấu chảy kim loại và các nguồn khác. Nhà máy thường thải ra SO2 qua các ống khói, tuy nhiên SO2 không lắng đọng ở gần các nhà máy. Nó thường được gió đưa đi xa, có thể tới hàng trăm, hàng nghìn kilomet. Do đó, lắng đọng acid thường là vấn đề khu vực, là vấn đề ô nhiễm xuyên biên giới.
7.8.3 Tác động
Trên bề mặt trái đất, acid dù lắng đọng khô hay ướt đều gây ra nhiều tác động môi trường, gây hại cho con người, động, thực vật, vi sinh vật và kiến trúc hạ tầng. Lắng đọng acid bắt đầu xuất hiện từ việc đốt than, tăng lên trong thời kì Cách mạng Công nghiệp vào thế kỷ XVIII và trở nên trầm trọng trong thế kỷ XIX do sự phát triển của ngành công nghiệp pin.
- Tác động lên hồ, sông, suối
Các acid làm giảm pH của sông, hồ. Cá và các sinh vật chỉ có thể sống sót trong một khoảng pH nhất định, sự thay đổi pH của hồ có thể tiêu diệt nhiều loài cá, động vật không xương sống và vi sinh vật. Hầu hết các loài côn trùng trong nước và tảo chỉ sống được ở pH lớn hơn 5. Khi pH của nước hồ xuống thấp hơn 5 sẽ giết chết các loài sinh vật này, gây thiếu thức ăn theo chuỗi thức ăn. Khi pH dưới 5,5 làm giảm khả năng sinh sản và gây đột biến ở cá và các loài lưỡng cư.
Hồ, sông suối bị acid hóa đã từng là một vấn đề ở các nước Bắc u. Trong những năm 1950 - 1960, pH hồ ở Thụy Điển đã xuống thấp đến 1. Cuối những năm 1970 khoảng 25.000 trong số 90.000 hồ ở Thụy Điển đã bị acid hoá, trong đó 8.000 hồ bị acid hóa tự nhiên, còn lại 17.000 hồ bị acid hóa do hoạt động của con người. Ngày nay nhiều hồ ở khu vực này đã được khôi phục. Tác động của mưa acid lên hồ trầm trọng nhất là ở thời điểm băng tan. Do acid tích trữ trong băng, băng tuyết tan chảy sẽ giải phóng một lượng lớn acid vào hồ. Trong một số trường hợp nước băng tan chảy có lượng acid lớn hơn 10 lần lượng acid trong hạt tuyết.
- Tác động lên sinh quyển
Acid gây hại cho cây, lá và rễ cây. Khi acid sulfuric lắng đọng lên lá cây, nó tạo một lớp chất lỏng với pH thấp, ăn mòn lớp sáp và làm lá cây bị khô và bị tổn thương. Khi các khí acid, hạt aerosol hoặc hạt mưa chứa acid thấm vào nước ngầm trong rừng, nó phá hoại rễ cây theo 2 cách. Đầu tiên, các dung dịch acid hoà tan và rửa trôi các chất dinh dưỡng quan trọng như calci, magnesi, Kali, natri. Ngoài ra các dung dịch acid phản ứng với các quặng chứa nhôm và Sắt như nhôm hydroxid (Al(OH)3 rắn và sắt hydroxid (Fe(OH)3 (rắn), giải phóng các ion Al3+, Fe3+. Ở nồng độ cao các ion kim loại này gây độc cho hệ thống rễ.
Do các acid lắng đọng, rất nhiều rừng đã bị phá huỷ, Ở các nước châu u như Ba Lan, Cộng hoà Séc, trong những năm 1980 và 1990 có tới 60% đến 80% cây chết do lắng đọng acid. Acid lắng đọng cũng gây hại cho mùa màng. Ngoài lắng đọng acid, các tác nhân gây ô nhiễm môi trường khác như ozon, PAN cũng phá hoại rừng và mùa màng.
- Tác động lên các công trình xây dựng
Acid ăn mòn vật liệu đá vôi, đá cuội, đồng... Nhiều công trình nổi tiếng đã bị phá hủy do mưa acid và các chất ô nhiễm như đền thờ Parthenon ở Hy Lạp
7.8.4 Giải pháp
Để xử lý các vùng nước bị acid hóa có thể dùng các tác nhân trung hoà làm tăng pH hồ. Các tác nhân thường được sử dụng là amonihydroxid (NH4OH), natri hydroxid, calci hydroxid, calci carbonat, khí amoniac.
Ngoài ra, cần áp dụng các biện pháp giảm thiểu phát thải các khí SOx, NOx, HCI tại nguồn.
7.9 Suy giảm tầng ozon
.jpg)
7.9.1 Sự hình thành và phân hủy ozon trên tầng bình lưu
Phân tử oxy bị tia tử ngoại bước sóng ngắn hơn 254 nm phá hủy tạo các nguyên tử oxy, nguyên tử oxy phản ứng với phân tử oxy sinh ra ozon.
O2 + hv → O* + O* (λ < 254 nm)
O* + O2 + M → O3 +M
Sự phá hủy ozon:
O3 + hv → O2+ O* (λ> 310 nm)
O* + O3 → 2O2
Nồng độ ozon cao nhất ở khoảng 25 đến 32 km so với mặt đất.
Ngoài ra ozon trong tầng bình lưu còn bị phân hủy tự nhiên bởi NOx và *OH
Trước năm 1980, nồng độ ozon đo được ở trạm Nam Cực luôn cao hơn mức đánh giá sự suy giảm tầng ozon (220 DUs). Sau năm 1980, khi đo nồng độ ozon vào các mùa xuân (tháng 9 đến tháng 11) đều có kết quả suy giảm, thậm chí có thể giảm tới 70%. Sự suy giảm trầm trọng này được gọi là lỗ thủng ozon Nam Cực. Thường lỗ thủng này có kích thước lớn hơn Bắc Mỹ. Ở Bắc Cực cũng ghi nhận sự suy giảm tầng ozon vào mùa xuân (tháng 3 đến tháng 5) nhưng không trầm trọng như ở Nam Cực.
Sự suy giảm tầng ozon sau những năm 1970 xuất hiện cùng với sự gia tăng nồng độ của clor và brom trên tầng bình lưu. Các hợp chất đóng vai trò quan trọng nhất trong sự suy giảm tầng ozon (được gọi chung là các chất gây suy giảm tầng ozon (ozon depleting substance - ODS) là clorflorcarbon (CFC). Đây là tên chung của các chất khí được tổng hợp trong những năm 1930 bằng việc thay thế một hay nhiều nguyên tử clor bằng flor trong carbon tetraclorid (CCL4) và được sử dụng phổ biến trong công nghiệp điện lạnh, khí hóa lỏng trong các thiết bị xịt.
Nguồn gốc và đặc điểm của một số CFC điển hình được trình bày trong bảng 2.3. Các chất này bền vững trong tầng đối lưu, sau đó lên tầng bình lưu, giải phóng nguyên tử clor và tham gia vòng phá hủy ozon Các gốc Cl*, CIO* được phản ứng sinh ra các chất lưu trữ clor (HCl và clorin nitrat CIONO2), làm ngăn cản quá trình phá hủy ozon
Mùa đông Nam Cực (tháng 6 - tháng 9) thường rất lạnh, không có ánh mặt trời, và gió xoáy cực quay xung quanh Nam Cực giữ các khối không khí lạnh trong Nam Cực, ngăn cản không khí ấm, giàu ozon bên ngoài thâm nhập vào tầng bình lưu Nam Cực, Vì nhiệt độ xuống thấp, ở tầng bình lưu của Nam Cực và đôi khi ở Bắc Cực xuất hiện những đám mây mỏng đặc biệt được gọi là mây bình lưu ở cực (polar stratospheric clouds - PSC),
Các phản ứng hóa học dị thể xảy ra trên bề mặt các PSC. Các khí được hấp thụ lên bề mặt. Phản ứng dị thể chính xảy ra trên bề mặt PSC là
CIONO2 + H2O → HOCI + HNO3
CIONO2 + HCI → Cl2 + HNO3
Các phản ứng dị thể này chuyển clor ở dạng không hoạt động ở tầng bình lưu như HCI và CIONO2 thành các dạng hoạt động như Cl2, HCIO.
Khi mặt trời xuất hiện, các chất khí có clor từ phản ứng trong PSC tham gia phản ứng quang hoá.
Một khi gốc C1 được giải phóng nó tham gia phân hủy ozon và phản ứng xảy ra mãnh liệt
Các phản ứng này khác với các phản ứng phân hủy ozon toàn cầu do trong điều kiện này nồng độ CO đủ lớn để phản ứng (*) xảy ra, phân hủy hai phân tử O3.
Nhiệt độ ở hai Cực tăng lên, làm biến mất các gió xoáy cực và làm tan chảy PSC, ozon từ bên ngoài tràn vào, đồng thời ozon cũng được hình thành từ các phản ứng hóa học và các hợp chất lưu giữ clor như HCl, CIONO2 được hình thành.
7.9.2 Tác động của sự suy giảm tầng ozon
Sự suy giảm tầng ozon làm gia tăng bức xạ tử ngoại xuống bề mặt trái đất.
- Tác động lên con người: Sự gia tăng của bức xạ tử ngoại (đặc biệt bước sóng từ 280 nm đến 315 nm, còn được gọi là UV-B) tác động lên da (gây cháy nắng, lão hóa da và ung thư da như ung thư biểu mô tế bào vảy), mắt (ảnh hưởng lên giác mạc gây mù tuyết, gây đau, rát, sợ ánh sáng, co giật, đục thủy tinh thể...) và suy giảm hệ miễn dịch của con người.
- Tác động lên động và thực vật: tác động theo nhiều cách khác nhau. Với thực vật phù du ở đáy đại dương, tia tử ngoại làm chậm phát triển, giảm sinh sản, thay đổi enzym trong quá trình quang hợp... Sự suy giảm các sinh vật bậc thấp ảnh hưởng lên các động thực vật bậc cao theo chuỗi thức ăn. Động vật nhạy cảm với tia tử ngoại tương tự như con người. Đã ghi nhận các trường hợp bị ung thư biểu mô tế bào vảy ở mèo, chó, cừu, dê, ngựa ở những vùng da không được bảo vệ như mi mắt, mũi, tai, đuôi. Tia tử ngoại phá hoại mùa màng, tác động lên DNA và tốc độ quang hợp, thay đổi vòng đời, làm cây dễ bị mắc bệnh và bị tấn công bởi côn trùng, giảm hiệu suất.
- Tác động lên khí quyển: giảm lượng tiêu thụ CO2 do giảm quang hợp, tăng tốc độ phân hủy xác động thực vật do đó tăng giải phóng CO2 vào khí quyển. Ngoài ra, UV-B còn làm tăng tốc độ tạo ozon ở tầng đối lưu.
7.9.3 Giải pháp
Các nghiên cứu về tác động của CFC lên tầng ozon đã được tiến hành vào những năm 1970. Vào tháng 9 năm 1987, hiệp ước quốc tế Montreal đã được kí bởi 27 quốc gia nhằm giảm sản xuất CFC và đặt thời gian cho sự ngừng sản xuất hoàn toàn CFC. Nghị định thư này đã được thay đổi nhiều lần nhằm đẩy nhanh việc ngừng sản xuất CFC: 1990 (London), 1991 (Nairobi), 1992 (Copenhagen), 1993 (Băng cốc), 1995 (Viên), 1997 (Montreal), 1999 (Bắc Kinh), 2007 (Montreal). Tính đến năm 2015, đã có 195 quốc gia và vùng lãnh thổ ký và thông qua nghị định thư Montreal.
Các chất thay thế cho CFC là HCFC (hydrocloroflorocarbon) và HFC (hydroflorocarbon). Tuy nhiên, HCFC cũng chứa clor và cần được hạn chế sản xuất. Đến năm 2040, chất này sẽ được ngừng sản xuất và tiêu thụ. HFC không chứa clor, tuy nhiên nó hấp thụ hồng ngoại mạnh do đó làm gia tăng hiệu ứng nhà kính.
Từ sau nghị định thư Montreal, lượng phát thải các chất ODS đã giảm đi đáng kể. Tính đến năm 2012, tổng tượng phát thải các chất ODS trong tầng đối lưu đã giảm khoảng 10% so với năm 1994. Năm 2012, tổng phát thải ODS quy đổi ra clor là 3.000 ppt (part per trillion), trong đó lượng CFC (phần lớn là CFC-11, CFC-12 và CFC-113) là khoảng 2.024 ppt.
So sánh với giai đoạn 1965 - 1980, các dữ liệu đo đạc từ mặt đất và vệ tinh cho thấy trong giai đoạn 2008 - 2013, ozon giảm 3,5% ở bán cầu Bắc, 6% ở bán cầu Nam và giữ hằng định ở vùng nhiệt đới. Nồng độ ozon trên tầng bình lưu đã được giữ tương đối hằng định từ năm 2000. Lượng ozon ở các cực được dự đoán sẽ tăng do dự giảm phát thải ODS.
Do tuổi thọ của các CFC trên tầng bình lưu toàn cầu rất lâu, tầng ozon sẽ không khôi phục bằng giá trị năm 1980 cho đến năm 2050 hoặc thậm chí muộn hơn tuỳ thuộc vào phát thải khí nhà kính. Hiệu ứng nhà kính, tuy làm ấm tầng đối lưu nhưng làm lạnh tầng bình lưu, sẽ làm quá trình khôi phục này thêm dài hơn. Như vậy, lỗ thủng ozon Nam Cực sẽ xảy ra hàng năm trong cả thế kỷ tới.
7.10 Hiệu ứng nhà kính và hiện tượng ấm lên toàn cầu
7.10.1 Đặc điểm và nguồn gốc
Hiệu ứng nhà kính tự nhiên là sự ấm lên của tầng đối lưu do sự gia tăng tự nhiên của các khí nhà kính. Các khí nhà kính (GHG) là khí hầu như không hấp thụ các bức xạ nhìn thấy từ mặt trời nhưng hấp thụ một số bức xạ hồng ngoại từ trái đất. Nó làm ấm khí quyển tương tự như nhà kính trồng rau làm ấm không khí bên trong.
Trong khí quyển tồn tại các khí nhà kính tự nhiên như H2O, CO2, CH4, O3, Nạo và CH3Cl. Các khí nhà kính tự nhiên đóng vai trò quan trọng trong cân bằng năng lượng trên trái đất, làm cho lớp không khí gần bề mặt trái đất có nhiệt độ dao động trong khoảng hẹp, đủ ấm cho các sinh vật tồn tại và phát triển.
Khí nhà kính tự nhiên quan trọng nhất là hơi nước (đóng góp 89%) và khí carbon dioxid (đóng góp khoảng 7,5%). Hơi nước hấp thụ mạnh nhiều bước sóng trong khoảng 0,7 đến 8 um và trên 12 um. Khí carbon dioxid hấp thụ mạnh ở 2,7 và 4,3 um và trên 13 um. Vùng từ 8 đến 12 um được gọi là cửa sổ khí quyển. Nếu tăng nồng độ các khí nhà kính, đặc biệt là các khí hấp thụ bức xạ trong vùng cửa sổ khí quyển thì sẽ làm nóng khí quyển.
Hiện tượng ấm lên toàn cầu là sự gia tăng nhiệt độ bề mặt trái đất do sự gia tăng các khí nhà kính có nguồn gốc nhân tạo và các hạt aerosol hấp thụ bức xạ mặt trời. Các hạt hay gặp là carbon đen (black carbon - BC) và các hợp chất hữu cơ có carbon (carbon nâu - brown carbon - BrC). BC sinh ra từ quá trình đốt cháy than đá, dầu diesel, khí thiên nhiên, nhiên liệu sinh học và sinh khối. BC hấp thụ tất cả các bước sóng bức xạ mặt trời. BrC hấp thụ UV và các bước sóng ngắn nhưng không hấp thụ bước sóng hồng ngoại. Do đó BC và BrC được gọi là các hạt làm ấm.
Ngoài các hạt BC và BrC, hầu hết các hạt khác như sulfat, nitrat, ammoni, natri, kali, calci, magnesi... không hấp thụ bức xạ mặt trời. Ngoài ra, nước trong các hạt phản xạ bức xạ mặt trời. Do đó các hạt này làm giảm nhiệt độ gần bề mặt trái đất. Những hạt này được gọi là hạt làm mát, làm giảm tác động ấm lên của các khí nhà kính và hạt làm ấm.
Nguyên nhân hàng đầu dẫn tới hiện tượng ấm lên toàn cầu là sự gia tăng nồng độ các khí nhà kính như carbon dioxyd, methan, nitrous oxid, ozon, các CFC, các HCFC, clorocarbon và hơi nước, sau đó là các hạt BC và BrC. Mặc dù hơi nước là khí nhà kính tự nhiên quan trọng nhất, đóng góp của hơi nước từ nguồn thải nhân tạo vào hiện tượng ấm lên toàn cầu là rất nhỏ. Lượng hơi nước từ nguồn nhân tạo chỉ bằng khoảng 1/8.000 hơi nước từ nguồn gốc tự nhiên.
Mặc dù khí CO2 là khí nhà kính có nguồn gốc nhân tạo phổ biến nhất và trọng nhất, rất nhiều các hóa chất khác có khả năng làm ấm không khí lớn hơn nhiều lần CO, khi so sánh khả năng làm ấm trái đất trên đơn vị 1 phân tử. Ví dụ BC trong bụi bồ hóng từ đốt cháy nhiên liệu hóa thạch có khả năng làm ấm không khí cao hơn 1.000.000 lần so với khí CO2, khí methan gấp 25 lần, N2O và CFCI gấp khoảng 270 và 4750 lần khí CO2. Khí O3, các CFC, các HCFC cũng là các khí nhà kính. Mặc dù nồng độ các khí này đều có xu hướng gia tăng từ giữa thế kỷ XIX đến đầu thế kỷ XXI (do sự gia tăng phát thải từ nguồn nhân tạo và tốc độ loại bỏ chậm), CO2 có tốc độ phát thải và nồng độ lớn hơn rất nhiều so với các khí trên, dẫn đến CO2 là nguyên nhân hàng đầu gây ra hiện tượng ấm lên toàn cầu.
Nguồn nhân tạo của CO2 còn có thêm nguồn từ phá rừng làm trang trại, nương rẫy, làm giảm tiêu thụ CO2 từ quang hợp. Nam Mỹ, Châu Phi và Indonesia là nơi có nhiều rừng nhiệt đới và có tốc độ phá rừng cao nhất thế giới.
Tác dụng ấm lên toàn cầu là do các khí nhà kính, hạt aerosol hấp thụ và bề mặt đô thị sau khi được giảm trừ hiệu ứng làm mát của các hạt phản xạ. Theo tính toán, hiện nay tác dụng làm mát của các hạt lớn hơn tác dụng làm ấm. Trên thực tế, tác dụng làm mát của các hạt đã triệt tiêu một nửa tác dụng ấm lên toàn cầu. Do các hạt aerosol là nguyên nhân hàng đầu gây tử vong trong ô nhiễm không khí, trên thực tế, để bảo vệ sức khoẻ cộng đồng cần làm giảm cả các hạt mát và hạt làm ấm. Như vậy, làm giảm đồng thời phát thải của hạt và khí nhà kính sẽ đem lại lợi ích cả về môi trường và sức khoẻ cộng đồng.
7.10.2 Tác động của hiệu ứng nhà kính
Nồng độ CO2 trong khí quyển được dự đoán sẽ tăng từ 393 ppm trong 2011 lên đến khoảng 730 ppm tới 1040 ppm trong năm 2100. Nhiệt độ bề mặt trái đất tăng thêm 1,8 K đến 4 K, tuỳ theo các kịch bản phát thải khác nhau. Các tác động của hiện tượng ấm lên toàn cầu là:
- Băng tan, nước biển dâng: nhiệt độ trái đất ấm lên làm tăng mực nước biển theo hai con đường: làm tan chảy các biển băng, dòng sông băng và làm giảm khối lượng riêng của nước, giãn nở nước. Nếu tất cả các tảng băng bị tan chảy, mực nước biển sẽ dâng thêm 70 m, nhấn chìm 7% diện tích đất liền. Trong thế kỷ thứ XX, mực nước biển đã dâng 1,8 mm/năm, từ năm 1993 đến 2009, tốc độ tăng lên 3,4 ± 0,4 mm/năm. Nếu tốc độ này được duy trì, mực nước biển sẽ dâng thêm 31 cm vào năm 2100, nhấn chìm 0,015% đất liền xuống biển. Sự suy giảm của số lượng băng làm giảm tỷ lệ sống sót của gấu Bắc Cực. Sự tăng mực nước biển sẽ làm ngập lụt các khu đất thấp ven biển.

- Thay đổi khi hậu, thời tiết cực đoan và ảnh hưởng tới nông nghiệp: ấm lên toàn cầu làm biến đổi khí hậu, số ngày cực nóng tăng, số ngày cực rét tăng. Hiện tượng ấm lên toàn cầu làm tăng sự bốc hơi nước và do đó làm tăng lượng mưa trên đất liền. m lên toàn cầu làm gia tăng hạn hán ở một số khu vực và lụt lội ở những nơi khác. Sự ấm lên ở bề mặt nước biển làm tăng cường độ của các cơn bão. Sự thay đổi thời tiết gây ảnh hưởng đến ngành nông nghiệp, dẫn đến sự dịch chuyển các khu vực làm nông nghiệp. Một số vùng có nhiệt độ tăng phù hợp sẽ thuận lợi cho phát triển nông nghiệp. Còn những khu vực có nhiệt độ cao như các vùng hoang mạc ở Châu Phi, nếu có sự gia tăng nhẹ nhiệt độ sẽ có thể dẫn tới nạn đói như đã từng xảy ra trong quá khứ.

- Thay đổi tỉnh acid của đại dương và hệ sinh thái: do CO2 trong khí quyển tăng, lượng khí CO2 hoà tan trong nước biển sẽ tăng, làm giảm pH của nước biển và gây ra tình trạng acid hóa nước biển. pH của nước biển đã giảm từ khoảng 8,25 năm 1751 xuống đến 8,14 vào năm 2004. Nếu nồng độ CO2 tiếp tục tăng, pH của nước biển có thể giảm đến 7,85 vào năm 2100. Acid hóa nước biển phá hoại rặng san hô (thành phần chủ yếu là calci carbonat), ảnh hưởng đến quá trình tạo các vỏ từ calci carbonat của các động vật dưới nước, gây nguy hiểm cho các loài cá mà quen sống trong một khoảng pH dao động hẹp. Nhiệt độ tăng nhanh, liên tục ở trên đất liền sẽ dẫn tới sự tuyệt chủng của một số loài nhạy cảm.
- Thay đổi bệnh tật: nhiều mưa hơn do hiện tượng ấm lên toàn cầu làm gia tăng muỗi và các loài vật chủ mang bệnh khác. Sự ấm lên toàn cầu sẽ làm gia tăng sự lây lan của các bệnh ở xứ nóng như sốt rét, cảm cúm. Nóng lên toàn cầu làm gia tăng các bệnh liên quan tới nhiệt như ban nhiệt, đột quỵ. Đối tượng nhạy cảm là những người quen sống ở vùng nhiệt độ thấp, người già, trẻ em...
- Thay đổi ô nhiễm khí quyển: các khí nhà kính như CO2, CH4, N2O, CFC không trực tiếp gây hại đến sức khoẻ con người ở nồng độ thông thường. Tuy nhiên O3, CO và hạt BC gây hại cho sức khoẻ con người. Sự ấm lên toàn cầu nhìn chung làm gia tăng nồng độ của các chất ô nhiễm khí quyển gây hại cho sức khoẻ như O3, hạt ở những khu vực ô nhiễm. Theo dự đoán, nhiệt độ tăng 1 K sẽ gây ra thêm khoảng 1000 cái chết trong một năm ở nước Mỹ, trong số đó 40% là do ozon, phần còn lại là do các hạt.
- Thay đổi ozon tầng bình lưu: mặc dù các khí nhà kính làm ấm tầng đối lưu, chúng làm mát tầng bình lưu do hấp thụ một số tia IR phát xạ từ trái đất, làm giảm lượng ozon trên tầng bình lưu.
7.10.3 Giải pháp
Trái đất ấm lên là vấn đề mang tính địa phương, khu vực và quốc tế. Các quốc gia phát thải CO2 nhiều nhất là Trung Quốc, Mỹ và Ấn Độ. Nếu tính theo bình quân đầu người các quốc gia sản xuất dầu mỏ lớn nhất thế giới có lượng phát thải lớn nhất, đó là Quatar, Ả Rập, Kuwait, Mỹ. Các quốc gia này (trừ Mỹ) có số lượng dân số nhỏ, do đó tổng phát thải là tương đối nhỏ, Mỹ là quốc gia vừa có tỷ lệ phát thải đầu người cao, vừa có tổng lượng phát thải lớn.
Các giải pháp mang tính khu vực và quốc tế đã được đưa ra để giải quyết vấn đề. Tuy hiện tượng ấm lên toàn cầu là vấn đề mang tính khoa học nhưng kiểm soát nó sẽ gây tác động rất lớn tới kinh tế, làm cho nó trở thành một vấn đề chính trị toàn cầu. Rất nhiều nền công nghiệp dựa vào sự đốt cháy của nhiên liệu hóa thạch do đó họ phản ứng với các điều luật có thể làm tăng chi phí của họ. Nhiều quốc gia đang phát triển mới bước vào giai đoạn công nghiệp hóa nhận thấy rằng việc tăng sử dụng các nhiên liệu hóa thạch là cách dễ nhất để phát triển kinh tế. Mặc dù vậy, sự mở rộng nền kinh tế cùng với nhiên liệu hóa thạch đưa đến ô nhiễm không khí, gánh nặng bệnh tật, khí hậu và các chi phí cho môi trường khác.
Nhiều quốc gia đã đưa ra các điều luật nhằm hạn chế phát thải các khí nhà kính và bụi vào khí quyển. Các quốc gia cũng đã có nhiều cuộc họp chung nhằm thống nhất mức độ giảm phát thải các khí nhà kính và bụi. Năm 1992 một hiệp ước quốc tế về ấm lên toàn cầu ở Rio de Janeiro đã đưa ra công ước chung về biến đổi khí hậu, kêu gọi các quốc gia ký kết kiểm soát nguồn thải khí nhà kính và đưa ra các chính sách nhằm làm giảm phát thải khí nhà kính. Vào năm 1997, các quốc gia tiếp tục gặp nhau ở Kyoto, Nhật Bản để thống nhất các chính sách. Kết quả đã ra đời Nghị định thư Kyoto, một hiệp ước quốc tế chống lại ấm lên toàn cầu thông qua quản lý nguồn thải khí nhà kính. Theo nghị định thư này các quốc gia công nghiệp hóa được yêu cầu cắt giảm thải khí nhà kính trong giai đoạn từ năm 2008 đến 2012. Các khí này gồn CO2, CH4, N2O, HFC, perflorocarbon và sulfur hexaflorid (SF6). Trong số các quốc gia thông qua Nghị định thư có một số quốc gia được phép tăng phát thải. Xét tổng tất cả các quốc gia công nghiệp hoá, mức độ giảm trung bình là 5,2% so với năm 1990.
Vào cuối tháng 4 năm 2001 đã có 191 quốc gia ký và phê chuẩn Nghị định thư Kyoto. Tuy nhiên không phải quốc gia nào cũng đạt được ngưỡng giảm thải. Tổng phát thải CO2 toàn cầu vẫn tiếp tục tăng.
Các hoạt động đa quốc gia đáng kể sau đó là cuộc gặp thượng đỉnh ở Copenhagen (Đan Mạch) năm 2009 và cuộc gặp ở Cancún (Mexico), tuy nhiên chưa có sự thống nhất đáng kể nào về sự cắt giảm khí thải nhà kính.
Để cắt giảm phát thải CO2, một trong những giải pháp kỹ thuật quan trọng đó là thay thế nhiên liệu: thay các năng lượng carbon (nhiên liệu hóa thạch, dầu mỏ, khí đốt...) bằng những năng lượng được sản xuất từ những nguồn tái tạo được. Một số dạng năng lượng đang được sử dụng hiện nay và được khuyến khích dùng trong tương lai: năng lượng gió (wind), sóng (wave), địa nhiệt (geothermal), thủy điện (hydroelectric), thủy triều (tidal), mặt trời (solar photovolaics).
Bên cạnh các giải pháp chính trị nhằm giải quyết vấn đề ấm lên toàn cầu cần cân nhắc các giải pháp giảm nhiệt độ nhanh hơn. Đó là tốc độ phát thải và khả năng thay đổi nhiệt độ trên một đơn vị phát thải, CO2 và CH4 có tốc độ phát thải cao nhất tuy nhiên khả năng thay đổi nhiệt độ của 1 đơn vị bụi bồ hóng cao hơn rất nhiều lần so với CO2. Như vậy kiểm soát các hạt bụi bồ hóng có lẽ là cách nhanh nhất để giải quyết vấn đề ấm lên toàn cầu. Ngoài ra, do hạt là thành phần gây nguy hiểm chết người nhất trong các chất ô nhiễm khí quyển chính, kiểm soát hạt còn là cách nhanh nhất có thể làm giảm tử vong do ô nhiễm khí quyển.
8 Các khí thải từ sản xuất dược phẩm
8.1 Các khí thải phát sinh từ sản xuất dược phẩm

Ngành sản xuất dược phẩm phát thải nhiều dạng chất ô nhiễm ra khí quyển, cả các chất độc hại như methylen clorid, methanol, toluen, dimethylformamid, hexan, hydroclorid.
Theo phân loại của Cục Bảo vệ Môi trường Mỹ (EPA), ngành dược phẩm được coi là một trong những nguồn thải ra các chất khí thải nguy hại (Hazard air pollutants - HAP) vào khí quyển. Ngành sản xuất dược có những nhà máy/khu nhà máy sinh ra lớn hơn 10 tấn một loại HAP hoặc lớn hơn 25 tấn nhiều loại HẠP trong một năm. Chất khi nguy hại trong nhóm này là chất có thể gây ung thư và gây nhiều hậu quả khác đối với sức khoẻ con người. Phần lớn các chất này là chất hữu cơ dễ bay hơi (HAP-VOC). Như đã giới thiệu ở phần trước, VOC và NO, là tiền chất của ozon ở tầng đối lưu.
Nhà máy sản xuất dược phẩm phát thải ra các chất độc hại ra khí quyển từ các quá trình sản xuất dược phẩm, kiểm nghiệm nguyên liệu và thành phẩm, lưu giữ dung môi, rò rỉ dung môi và bốc hơi từ nước thải.
8.1.1 Quá trình sản xuất
Sản xuất dược phẩm được thực hiện thông qua 4 quá trình chính là tổng hợp hóa dược, bào chế, lên men và chiết xuất. Những quá trình này sử dụng những thiết bị, dụng cụ có đặc thù riêng. Có một đặc điểm chung là các đơn vị vận hành được thông khí do đó chúng là các nguồn phát thải chất ô nhiễm ra không khí.
- Tổng hợp hóa dược
Phần lớn các hoạt chất được tổng hợp qua các phản ứng hóa học. Quy trình này thường sử dụng các thiết bị bể phản ứng, máy ly tâm, máy sấy, tháp chưng cất.
Trong quy trình sản xuất hóa dược, các chất ô nhiễm khí quyển nguy hại có thể được phát thải từ bất cứ thiết bị nào. Phát sinh khí ô nhiễm từ các thùng chứa, từ quá trình đun nóng, phản ứng... Theo khảo sát của EPA, tổng hợp hóa dược chiếm đến 75% phát thải HAP từ quá trình sản xuất dược phẩm. Các HẠP điển hình sinh ra từ quá trình tổng hợp hoạt chất là methylen clorid, toluen và methanol.
- Bào chế
Các hoạt chất được bào chế thành các dạng bào chế khác nhau như viên nén, thuốc nang, dung dịch, hỗn dịch... hay gặp nhất là viên nén.
Hoạt chất và các tá dược cần thiết được trộn lẫn và dập viên. Một số loại viên nén được bao bằng vật liệu phù hợp và được làm khô. Nguồn phát thải chất ô nhiễm khí quyển độc hại lớn nhất từ quy trình bào chế là bước bao viên. Vật liệu bao viên có thể có đặc tính thân nước hoặc thân dung môi hữu cơ trong đó vật liệu thân dung môi hữu cơ thường được sử dụng nhiều hơn và được pha bằng các dung môi hữu cơ chính là các VOC. Bước làm khô thường được thực hiện cùng với quá trình bao viên, do đó tăng nguy cơ phát thải HAP từ những đơn vị vận hành này. Có khoảng 13% HAP phát thải từ quy trình bào chế. HAP gồm methylen clorid, methanol, cloroform, toluen trong đó methylen clorid và methanol chiếm lượng lớn nhất. Ngày nay có nhiều vật liệu bao viên thân nước được thay thế đối với thuốc giải phóng kéo dài, giải phóng tại chỗ mà trước đây chỉ có các vật liệu bao viên tan trong dung môi hữu cơ làm được.
- Lên men
Nhiều hoạt chất như kháng sinh và các steroid được sản xuất bằng quá trình lên men. Có 3 kỹ thuật được dùng để thu sản phẩm của quá trình lên men là chiết bằng dung môi, kết tủa và trao đổi ion. Trong số các kỹ thuật này, chiết bằng dung môi là kỹ thuật sinh nhiều HAP nhất.
Thông thường quá trình chiết bằng dung môi gồm loại bỏ các hoạt chất bằng cách cho chúng bám vào chất rắn và lọc để loại bỏ phần chất lỏng. Sau đó thêm dung môi như methanol để hoà tan hoạt chất, sau đó lọc, làm khô dịch lọc để loại dung môi. Sự phát thải xảy ra khi chuyển một lượng lớn dung môi từ thùng chứa này này đến thùng khác và thu hồi sản phẩm từ dung dịch nồng độ cao bằng kết tinh, lọc và làm khô để thu sản phẩm rắn. Các dung môi hay dùng là methanol, methyl isobutyl ceton. Quá trình lên men sinh ra khoảng 14% HAP lượng thải từ các nhà máy dược ra khí quyển.
- Chiết xuất
Nhiều hoạt chất được chiết từ dược liệu. Thể tích của dược chất lấy được so với thể tích dược liệu nhiều khi nhỏ hơn rất nhiều lần. Có hai hướng sử dụng dung môi trong chiết xuất.
- Dung môi được dùng để loại bỏ chất béo và dầu bằng cách sử dụng các dung môi hoà tan được chất béo nhưng không hoà tan được sản phẩm.
- Dung môi được dùng để chiết lấy sản phẩm.
Giống như bước làm sạch trong quá trình lên men, các sản phẩm được phân lập khỏi dung môi qua chưng cất chân không, kết tinh hóa và làm khô. Một khi dung môi được đưa vào quá trình, chúng bay hơi từ các thiết bị lọc, kết tinh và làm khô ra khí quyển. Các HẠP dung môi hay sử dụng là toluen, methylen clorid, cloroform...
Quá trình kiểm nghiệm nguyên liệu, bán thành phẩm và thành phẩm sử dụng nhiều loại dung môi trong chiết xuất, xử lý mẫu, phân tích mẫu như các dung môi kém phân cực (n-hexan, chloroform, dicloromethan...), phân cực (methanol, ethanol, acetonitril...). Các hơi dung môi thường được thu gom vào xử lý qua hệ thống tủ hốt.

8.1.2 Bể lưu giữ
Các dung môi thường được lưu giữ trong các bể mái cố định. Cơ sở sản xuất lưu trữ nhiều loại dung môi hữu cơ là toluen, methylen clorid, methanol, hexan, methyl ethyl ceton, ngoài ra còn lưu trữ HCL...
8.1.3 Rò rỉ
Phát thải HAP từ đường ống như các van, đường ống mở, thiết bị xả áp suất, kết nối mẫu.
8.1.4 Bay hơi từ nước thải
Nước thải từ nhà máy dược phẩm là một nguồn phát thải một lượng lớn khí nhiễm HAP ra khí quyển. Đường ống dẫn nước thải vào khu vực xử lý thường là đường ống kín, do đó không có hiện tượng bay hơi ra khí quyển. Sự bay hơi của HAP ra khí quyển xảy ra ở bộ phận thu mở hoặc không được đậy kín. Khi có gió càng làm cho các khí này bay hơi nhanh và nhiều hơn. Ba HAP được thải ra với lượng lớn nhất là methanol, methylen clorid và n,n-dimethylformamid.
8.2 Giải pháp
- Luật pháp - chính sách: đưa ra các tiêu chuẩn phát thải và mục tiêu giảm trừ phát thải cụ thể.
- Kỹ thuật: lựa chọn tối ưu nhất cho việc giảm chất thải là giảm sử dụng (source reduction), sau đó đến tái chế (tái sử dụng các sản phẩm thải), giảm thải trừ bằng các thiết bị kiểm soát phát thải (hấp thụ, hấp phụ... đã được trình bày ở phần trước). Để giảm sử dụng, cần thay đổi sản phẩm, nguyên liệu thô, công nghệ hoặc các thực hành quy trình thao tác.
Mục đích của việc thay thế nguyên liệu là để giảm thể tích hoặc độc tính của chất thải. Tuy nhiên với ngành công nghiệp dược, thay đổi bào chế sản phẩm là điều rất khó do các sản phẩm đòi hỏi phải có khả năng điều trị, độ ổn định và độ tinh khiết. Hơn nữa để có được phê duyệt của các cơ quan có thẩm quyền như FDA ở Mỹ mất rất nhiều thời gian. Ngoài ra thay đổi một hoặc một vài thành phần trong công thức thuốc sẽ làm thay đổi một số đặc điểm của thuốc như mùi, vị, màu hoặc dạng bào chế, có thể làm cho khách hàng không sử dụng thuốc này nữa. Do rất khó khăn trong việc thay thế các nguyên liệu trong quá trình sản xuất dược phẩm, việc giảm thiểu chất thải cần được nghiên cứu từ khâu nghiên cứu phát triển sản phẩm. Đây cần là một trong những mục tiêu trọng tâm của khâu nghiên cứu và phát triển sản phẩm.
Thay đổi thiết kế nhằm giảm thiểu rò rị, mất mát nguyên liệu, lắp đặt các hệ thống tái sử dụng nước và dung môi, thay đổi xúc tác, dùng các quy trình sản xuất liên tục thay cho sản xuất theo mẻ để tái sử dụng dung môi... làm tăng hiệu suất quá trình.
Tuân thủ các thực hành vận hành tốt (Good operating practices) sẽ làm giảm các chất thải, chất thải độc hại và giảm mất mát nguyên liệu.
Do chi phí môi trường và trách nhiệm môi trường ngày càng cao, nhiều công ty đã và đang đưa ra các chương trình, ý tưởng mới, làm giảm hoặc tái chế rác thải.
8.3 Các khí thải từ sử dụng và loại bỏ dược phẩm
Việc sử dụng các sản phẩm dược phẩm và sau sử dụng cũng phát sinh một lượng chất thải nguy hại ra khí quyển. Đặc biệt là việc xử lý các sản phẩm này bằng nhiệt sẽ sinh các chất nguy hại ra khí quyển. Các chất được sinh ra, tác động và giải pháp sẽ được trình bày ở chất thải dược phẩm và chất thải rắn y tế ở chương sau.
9 Tài liệu tham khảo
- Trần Nguyên Hà, Vũ Ngân Bình (2023), "Môi trường không khí”, Môi Trường. Nhà xuất bản Y học, trang 28 - 62. Tải bản PDF tại đây.
- Lê Huy Bá, 1997. Môi trường tập I. Nhà xuất bản Khoa học và Kỹ thuật, Hà Nội.
- Đặng Đình Bạch, Nguyễn Văn Hải, 2006, Giáo trình Hóa học môi trường, Nhà xuất bản Khoa học kỹ thuật.
- Lê Thạc Cán, 1995. Cơ sở khoa học môi trường. Viện Đại học Mở Hà Nội.
- Lưu Đức Hải, 2001. Cơ sở khoa học môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội.
- Lê Văn Khoa, 2002. Khoa học môi trường. Nhà xuất bản Giáo dục, Hà Nội. 6. Trần Thị Thanh, Trần Yêm, Đồng Kim Loan, 2004. Giáo trình công nghệ môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội
- Trần Thị Thanh, Trần Yêm, Đồng Thị Kim Loan, 2004. Giáo trình công nghệ môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội.
- Lê Văn Thăng, 2007. Giáo trình Khoa học môi trường đại cương. Đại học Huế.
- Quốc hội nước Cộng hòa Xã hội Chủ nghĩa Việt Nam, Luật Bảo vệ môi trường, Hà Nội 2014.
- Lê Văn Khoa, Nguyễn Xuân Cự, Lê Đức, Trần Khắc Hiệp, Trần Cẩm Vân, 2000. Đất và môi trường. Nhà xuất bản Giáo dục.
- Kerry J. Howe, David W. Hand, John C. Crittenden, Rhodes R. Trussell, George Tchobanoglous, 2012. Principles of Water Treatment, John Wiley & Sons, Inc, USA.
- Mark Z. Jacobson, 2012. Air pollution and global warming: History, science, and solutions. 2nd ed. Cambridge University Press, USA.
- Metcalf and Eddy, 2004. Wastewater Engineering Treatment, Disposal, Reuse, 4th ed. McGraw Hill Higher Education, USA
- Ibrahim A. Mirsal, 2008. Soil pollution: Origin, monitoring and remediation, 2nd ed. Springer, Germany
- John Pichtel, 2005. Waste management practices: municipal, hazardous, and industrial. CRC Press, Taylor & Francis Group, USA.
- Petter H. Raven; Linda R.Berg; David M. Hassenzahl, 2010. Environment, 7th ed. John Wiley & Sons, Inc., USA.
- Daniel A. Vallero, 2014. Fundamentals of air pollution, 5th ed. Elsevier Inc, USA.

