4 nguyên nhân chủ yếu gây ô nhiễm môi trường nước

Trường Đại học Dược Hà Nội - Khoa hóa phân tích và kiểm nghiệm
Chủ biên TS. Trần Nguyên Hà
Ban biên soạn
TS. Trần Nguyên Hà
TS. Vũ Ngân Bình
Nước vừa là nguồn tài nguyên, vừa là yếu tố vật chất tạo thành môi trường có ý nghĩa vô cùng quan trọng với sự sống, tuy nhiên lượng nước sử dụng cho sinh hoạt, sản xuất được dự đoán ngày càng khan hiếm. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc khái niệm về môi trường nước và các nguyên nhân gây ô nhiễm môi trường nước.
1 Bảng chữ cái viết tắt
| Tên viết tắt | Nghĩa Tiếng Anh | Nghĩa Tiếng Việt |
| BC | Black carbon | Carbon đen |
| BrC | Brown carbon | Carbon nâu |
| BVTV | Bảo vệ thực vật | |
| BOD | Biochemical oxygen demand | Nhu cầu oxy sinh hoá |
| CFC | Chlorofluorocarbon | Cloroflorocarbon |
| COD | Chemical oxygen demand | Nhu cầu oxy hóa học |
| CRTĐT | Chất thải rắn đô thị | |
| DO | Dissolved oxygen | Lượng oxy hòa tan trong nước |
| DS | Dissolved solid | Lượng chất rắn hòa tan trong nước |
| ĐTM | Đánh giá tác động môi trường | |
| EPA | Environment Protection Agency | Cơ quan Bảo vệ môi trường Mỹ |
| GHG | Greenhouse gas | Khí nhà kính |
| HAP | Hazardous air pollutant | Khí thải nguy hại |
| HCFC | Hydrochlorofluorocarbon | Hydrocloroflorocarbon |
| PAH | Poly aromatic hydrocarbon | Chất hữu cơ đa vòng thơm |
| PAN | Peroxyl acetyl nitrat | |
| PM | Chất dạng hạt | |
| QCVN | Quy chuẩn Việt Nam | |
| SS | Sustained solid | Lượng chất rắn có thể lắng được |
| TCVN | Tiêu chuẩn Việt Nam | |
| TDS | Total dissolved solid | Tổng chất rắn hòa tan |
| VSV | Vi sinh vật | |
| VOC | Volatile organic chemical | Chất hữu cơ dễ bay hơi |
| WHO | World Health Organization | Tổ chức Y tế thế giới |
2 Đặc điểm của môi trường nước

Nước vừa là nguồn tài nguyên, vừa là yếu tố vật chất tạo thành môi trường. Nước là một trong các thành phần cơ bản của môi trường tự nhiên. Các dạng chứa nước trên trái đất như đại dương, biển, sông, hồ, suối, băng, nước ngầm... tạo nên môi trường nước. Nước che phủ 3% diện tích trên trái đất nhưng nước ngọt chỉ chiếm 3% tổng lượng lượng nước trên thế giới, trong đó lượng nước ngầm và bề mặt sông hồ chiếm 30,1% còn nước dạng đóng băng chiếm tới 68,7%. Năng lượng từ mặt trời làm lượng nước bay hơi hàng năm trên trái đất khoảng hơn 500.000km, 86% lượng này sẽ trở lại biển và đại dương dưới dạng mưa và tuyết. Phần còn lại di chuyển và ngưng tụ thành mưa rơi trên đất liền, trong đó một phần thấm vào đất, phần khác chảy trên mặt đất vào dòng sông suối, ao hồ... Tất cả nước từ lục địa sẽ quay về biển và đại dương. Mặc dù nước có vòng tuần hoàn khép kín (hình 4.1): 70% lượng nước bay hơi tự nhiên, 30% đi vào dòng chảy nhưng lượng nước sử dụng cho sinh hoạt, sản xuất được dự đoán ngày càng khan hiếm.
2.1 Phân loại và vai trò của nước
Dựa vào đặc điểm của nước mà có nhiều cách phân loại:
- Phân loại theo sự phân bố: nước bề mặt, nước ngầm, nước biển và đại dương.
- Phân loại theo độ cứng.
- Phân loại theo độ khoáng hóa.
- Phân loại theo thành phần hóa học.
- Phân loại theo nhiệt độ:
- Nước lạnh<30°C.
- Nước ấm 30 - 35°C.
- Nước nóng 35 - 50°C.
- Nước rất nóng 50 - 70°C.
- Nước quá nóng 70 - 100°C.
- Nước sôi>100°C.
- Phân loại theo pH:
- Nước trung tính pH 6,5 - 8,5.
- Nước tính acid pH < 6,5.
- Nước có tính kiềm pH > 8,5.
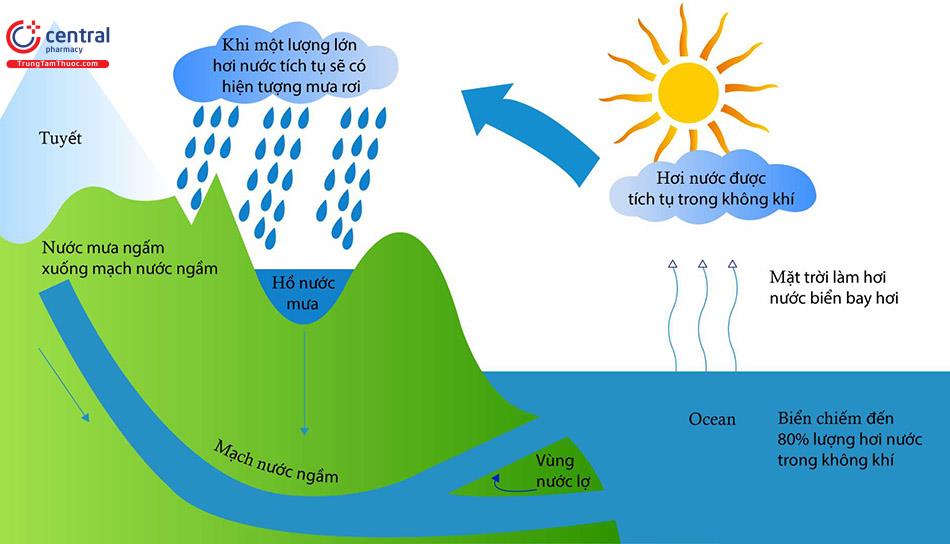
Nước tham gia vào các quá trình xảy ra trên trái đất như địa hóa, xói mòn... góp phần hình thành các dòng sông, suối... và điều hòa khí hậu do khả năng lưu giữ nhiệt ổn định hơn mặt đất và không khí.
Nước rất quan trọng đối với việc tồn tại và phát triển sự sống trên hành tinh vì nó là thành phần chính trong các cơ thể sống. Nước chiếm tới 70% trọng lượng cơ thể con người và dao động lớn trong cơ thể sinh vật từ 50% tới 98%.
Con người sử dụng chủ yếu nước ngọt từ nguồn nước bề mặt và nước ngầm. Các hoạt động dân sinh, sản xuất nông nghiệp, công nghiệp ngày càng tiêu thụ lượng nước lớn và cũng gây ra các tác nhân làm biến đổi thành phần, tính chất nguồn nước, ảnh hưởng tiêu cực tới sự cân bằng tự nhiên, điều kiện sống của con người.
Bảng 4.1. Một số tính chất và vai trò của nước tự nhiên
| Tính chất | Đặc điểm, vai trò |
| Dung môi hòa tan tốt | Hòa tan nhiều chất rắn tạo dung dịch điện ly. Vận chuyển chất dinh dưỡng và chất thải cho các quá trình sinh học tiến hành trong môi trường nước |
| Hằng số điện môi lớn (e = 80) | Hòa tan các dạng ion và ion hóa trong dung dịch |
| Sức căng bề mặt lớn | Kiểm soát chức năng sinh lý, giúp máu lưu thông |
| Trong, không màu | Tạo điều kiện quang hóa ở tầng nước sâu hơn |
| Tỷ trọng lớn nhất ở 4°C | Dạng rắn nổi trên mặt nước |
| Nhiệt bốc hơi cao | Nhiệt lượng chuyển hóa dạng lỏng thành dạng khí lớn |
| Nhiệt dung riêng cao | Ổn định nhiệt độ sinh vật và vùng địa lý. Điều tiết sự dao động nhiệt độ của nước thấp |
2.2 Thành phần của nước
2.2.1 Muối hòa tan trong nước
Dựa vào hàm lượng muối hòa tan, nước được phân ra làm 3 loại:
- Nước ngọt: lượng muối < 0,1%
- Nước lợ: lượng muối 0,1 - 1,0%
- Nước mặn: lượng muối > 1,0%
Thành phần hóa học của nước được liệt kê trong bảng 4.2 và có thay đổi tùy thuộc vị trí địa lý.
- Nước ngọt
Nước ngọt có thành phần khác nhau theo từng vùng địa lý, địa chất và khác nhau trên cùng hệ dòng theo thời điểm.
Thành phần, tính chất nước thường thay đổi theo chiều sâu lớp nước.
Lớp bề mặt nước (50 - 500 um) tiếp xúc với không khí nên luôn có cân bằng động giữa 2 pha khí và nước.
Lớp trên của bề mặt nước (0 - 12 m): các phản ứng quang hợp và phân hủy hiếu khí diễn ra mạnh mẽ tại lớp nước này. Các động thực vật nổi cũng tồn tại ở đây.
Bảng 4.2. Thành phần hóa học chính của nước tự nhiên
| Thành phần | Nước biển, đại dương | Nước sông, hồ | ||
| Nồng độ (mg/l) | Thứ tự (theo nồng độ) | Nồng độ (mg/l) | Thứ tự (theo nồng độ) | |
| Cl- | 19340 | 1 | 8 | 4 |
| Na+ | 10770 | 2 | 6 | 5 |
| SO42- | 2712 | 3 | 1 | 3 |
| Mg2+ | 1290 | 4 | 4 | 6 |
| Ca2+ | 412 | 5 | 15 | 2 |
| K+ | 399 | 6 | 2 | 7 |
| HCO3- | 140 | 7 | 58 | 1 |
| Br- | 65 | 8 | ||
| Nguyên tố vi lượng | Nồng độ (ug/l) | Thứ tự (theo nồng độ) | Nồng độ (ug/l) | Thứ tự (theo nồng độ) |
| Si | 5000 | 1 | 13100 | 1 |
| Bo | 4500 | 2 | 10 | 6 |
| F | 1400 | 3 | 100 | 4 |
| N | 250 | 4 | 230 | 3 |
| P | 35 | 5 | 20 | 5 |
| Mo | 11 | 6 | 1 | 8 |
| Zn | 5 | 7 | 20 | 5 |
| Fe | 3 | 8 | 670 | 2 |
| Mn | 2 | 9 | 7 | 7 |
Lớp nước giữa (12 - 21 m) ít chịu tác dụng bức xạ mặt trời hơn, nhiệt độ giảm. Tại lớp nước này cũng nơi diễn ra nhiều phản ứng quang hợp, tổng hợp, hô hấp của thực vật hoặc sinh vật trong nước. Tuỳ theo chiều sâu của lớp nước mà các phản ứng này xảy ra mạnh hay yếu.
Tại lớp đáy (từ trên 21 m), các quá trình trao đổi chất hoà tan với trầm tích trong đáy, phân hủy các hợp chất hữu cơ mà chủ yếu là quá trình phân hủy yếm khí do thiếu oxy:
SO42-→ S→ S2-
NO3-→ NO2- → NH3
- Nước biển và đại dương
Biển và đại dương là môi trường tiêu tan khổng lồ vì lắng đọng các chất thải từ phản ứng tự nhiên và hoạt động của con người nhưng cũng là môi trường sống của rất nhiều loại sinh vật. Nước biển chứa lượng muối rất lớn nên nước mặn không phù hợp cho sinh hoạt và sản xuất. Hàm lượng muối thay đổi theo vị trí địa lý nhưng tỷ lệ thành phần chính thường không đổi. Nguyên tố chủ yếu là Na, Cl và Mg chiếm 90% chất tan trong biển, tiếp đó là K, Ca và S khoảng 3% nằm dưới dạng muối clorid và sulfat. Một số thành phần chính trong nước biển được liệt kê trong bảng 4.2.
Nhiệt độ trung bình của nước biển là 5°C, pH = 12,5 ± 0,2. Giá trị pH ổn định được cho là nhờ 3 cân bằng:
+ Hệ carbonat
H2O + CO2↔ H2CO3 ↔ H+ + HCO3-↔ H+ + CO32-
+ Hệ B(OH)3 - B(OH)4-
B(OH)3 + H2O ↔ B(OH)4-+ H+
+ Cân bằng trao đổi ion của các cation hòa tan trong nước với silicat trong lớp trầm tích ở đáy biển
3Al2Si2O5(OH)4+ 4SiO2 + 2K+ + Ca2+ + 9H2O ↔ 2KCaAl2Si5O16(H2O)6 + 6H+
2.2.2 Các chất hữu cơ trong nước
- Các hợp chất hữu cơ dễ bị phân hủy sinh học như chất béo, dầu mỡ động thực vật. Một số loại phức hữu cơ humic lắng đọng từ sự phân hủy của thực vật, tồn tại ở đầm lầy, trầm tích. Các hợp chất này liên kết với nhau tạo bộ khung carbon vững chắc có phân tử lượng từ vài trăm đến vài chục nghìn, chứa vòng thơm, phenol và các nhóm có carboxyl. Các nhóm này tích tụ kim loại tồn tại rất lâu và gây độc cho môi trường tự nhiên.
- Các hợp chất hữu cơ khó bị phân hủy sinh học như hợp chất clo hữu cơ, polyclorbiphenyl (PCB), naphtalen, dioxin.....
2.2.3 Các khí trong nước
Nói chung các khí có mặt trong khí quyển sẽ có mặt trong nước nhờ 2 quá trình khuếch tán và đối lưu. Độ tan của các chất trong nước (m) phụ thuộc vào nhiệt độ và áp suất riêng phần (p). Các chất khí tan trong nước tuân theo định luật Henry tại điều kiện thường (khi tiếp xúc với nước và không có phản ứng hóa học xảy ra), độ tan của chúng tăng khi áp suất riêng phần tăng và nhiệt độ giảm.
m = Kp với K là hằng số tỷ lệ
- Oxy: oxy ít tan trong nước và không tham gia phản ứng hóa học với nước. Lượng oxy hoà tan trong nước (DO) thay đổi theo nhiệt độ và là một trong các chỉ tiêu cần thiết kiểm tra chất lượng nước. Tại áp suất I atm, nhiệt độ 0°C thì DO là 14,6 mg/l; nhiệt độ 35°C thì DO là 7 mg/l. Tỷ lệ bão hoà oxy trong nước từ 97 - 105% và giảm theo chiều sâu lớp nước. Hàm lượng DO thay đổi do vị trí tiếp xúc với không khí, chiều sâu lớp nước và sinh vật trong nước. Càng xuống sâu lượng oxy khuyếch tán từ lớp trên xuống càng ít. Hơn nữa, các vi sinh vật sẽ sử dụng oxy từ các hợp chất chứa oxy trong nước như sulfat, nitrat... làm nước càng trở nên thiếu oxy thành môi trường yếm khí (DO<2mg/l).
- Khí CO2: hệ CO2 / CO32- là hệ phức tạp trong thủy quyển vì nó liên quan tới pH của nước, cấu trúc sinh học của cơ thể sống sử dụng carbon để sinh trưởng và quá trình quang hợp của thực vật trong nước.
Khi pH = 8 - 9 CO2 ở dạng HCO3- ;
pH>10 nó tồn tại dạng CO32- .
Nước tự nhiên có pH dao động 7 đến 8,5. Ở điều kiện thường, trong nước tồn tại dạng HCO3-. Tỷ lệ thành phần trên duy trì sự ổn định của nước, tránh hiện tượng xâm thực của CO2 và cặn lắng của carbonat.
Giống như oxy, CO2 phân bố trong nước phụ thuộc nhiều vào nồng độ CO2 trong khí quyển, nhiệt độ và áp suất riêng phần. Nồng độ bão hoà CO2 trong nước khoảng 5.10-2M nhưng khác biệt oxy ở chỗ nồng độ CO2 trong nước thay đổi rất khác biệt ở từng địa điểm và phụ thuộc rất nhiều vào độ khuếch tán trong nước mà hiện nay người ta cũng chưa tìm ra hàm quan hệ. Ví dụ có thời điểm hàm lượng CO2 ở Thái Bình Dương quá bão hòa trong khi ở Ấn Độ Dương lại dưới mức bão hòa.
2.2.4 Vi sinh vật trong nước
Vi sinh vật trong nước rất đa dạng và tham gia tích cực vào các quá trình phân hủy các chất hữu cơ hoặc vô cơ đồng thời tham gia vào các hoạt động sống trong nước. Các vi sinh vật dị dưỡng có thể tự thích nghi phân hủy các protein, glucid, lipid hoặc tự dưỡng từ các chất nguồn gốc carbon như CH4, CO2... Một số chất hữu cơ phức tạp (dạng chất thải hoặc xác sinh vật chết) nhờ vi khuẩn và nấm phân hủy thành dạng đơn giản hơn hoặc các chất vô cơ cuối cùng (CO2), giải phóng năng lượng sử dụng cho quá trình sinh trưởng và chuyển hóa của chúng như vi khuẩn, vi khuẩn dị dưỡng, hiếu khí, yếm khí, tảo, siêu vi trùng... Ngoài ra, chúng cũng cần nguyên tố khoáng và nguyên tố dạng vết cho sự phát triển. Nguyên tố vết kiểm soát tình trạng bên trong tế bào hoặc sự hình thành đại phân tử liên hợp với các tổ hợp enzym. Ví dụ phospho cần thiết trong quá trình dự trữ và giải phóng năng lượng, niken có mặt để các enzym kiểm soát quá trình methyl hóa thành acetat trong quá trình sản xuất methan.
- Ở lớp nước trên, các chất hữu cơ được tạo ra nhờ phản ứng quang hợp và bị phân hủy nhờ vi khuẩn. Tảo sử dụng năng lượng mặt trời tham gia phản ứng quang hợp cung cấp oxy cho nước.
- Ở lớp nước giữa, tảo chết bị phân hủy lắng xuống đáy thành trầm tích.
- Ở lớp đáy, vi sinh vật phân hủy yếm khí tiêu thụ oxy từ các chất thải có chứa oxy SO42- → S2-, NO3- → N2. Các muối sulfid kim loại lắng xuống thành trầm tích.
Một số phản ứng minh hoạ cụ thể về vi khuẩn góp phần quá trình tự làm sạch nước:
- Vi khuẩn dị dưỡng: vi khuẩn sử dụng các chất hữu cơ làm nguồn năng lượng và nguồn carbon thực hiện quá trình sinh tổng hợp (E là năng lượng sinh ra).
+ Vi khuẩn hiếu khí: {CnHmOp} + O2 → CO2 + H2O + E
+ Vi khuẩn kị khí:
{CnHmOp} + NO3- → CO2 + NO2- + H2O
{CnHmOp} +SO42- → CO2 + H2S + E
{CnHmOp} → CH4+ CO2 + E
+ Vi khuẩn tùy nghi: phát triển trong điều kiện có hoặc không có oxy. Loại vi khuẩn này thường có mặt trong hệ thống xử lý nước thải.
- Vi khuẩn tự dưỡng: có khả năng xúc tác cho quá trình oxy hóa chất vô cơ để thu năng lượng và sử dụng CO2 cho quá trình sinh tổng hợp.
+ Phản ứng cố định nitơ
+ Phản ứng chuyển hóa hợp chất nitơ nhờ vi khuẩn
- Phản ứng oxy hóa sắt và Mangan nhờ vi khuẩn góp phần tạo cặn trong nước tự nhiên cũng như trong hệ thống ống dẫn
- Một số phản ứng oxy hóa khử khác của vi khuẩn sinh năng lượng cung cấp cho quá trình tồn tại và phát triển của chúng.
3 Ô nhiễm nước và các nguyên nhân gây ô nhiễm nước

Khái niệm ô nhiễm nước được hiểu như một phần của ô nhiễm môi trường. Theo Hiến chương châu u: “ô nhiễm môi trường nước là sự biến đổi nói chung của con người đối với chất lượng nước, làm nhiễm bẩn nước và gây nguy hiểm cho con người, công nghiệp, nông nghiệp, nuôi cá, nghỉ ngơi, giải trí, động vật nuôi và các loài hoang dã”.
Theo Từ điển Bách Khoa Việt Nam “ô nhiễm môi trường nước là hiện tượng làm bẩn nguồn nước do các loại hóa chất độc hại, các loại vi khuẩn gây bệnh, virus, kí sinh trùng phát sinh từ các nguồn thải khác nhau như chất thải công nghiệp từ các nhà máy sản xuất, các loại rác thải của các bệnh viện, các loại rác thải sinh hoạt bình thường của con người hay hóa chất, thuốc trừ sâu, phân bón hữu cơ... sử dụng trong sản xuất nông nghiệp được đẩy ra các ao, hồ, sông, suối hoặc ngấm xuống nước dưới đất mà không qua xử lí hoặc với khối lượng quá lớn vượt quá khả năng tự điều chỉnh và tự làm sạch của các loại ao, hồ, sông, suối”.
Như vậy, nước bị ô nhiễm xuất phát từ nhiều nguyên nhân có thể từ tự nhiên hoặc do con người. Bất kỳ một sự thay đổi nào trong cân bằng động tự nhiên đều có thể dẫn đến sự thay đổi một hoặc nhiều đặc tính của nước. Người ta phát hiện nước ô nhiễm từ những dấu hiệu bên ngoài: màu sắc biến đổi, mùi vị kích ứng, dầu mỡ nổi trên bề mặt, số lượng hoặc hình thái thủy sinh vật biến đổi khác thường...
- Khả năng tự điều chỉnh và tự làm sạch của nước
Đây là các quá trình hóa lý sinh, thủy động học tự nhiên diễn ra trong môi trường nước nhằm loại bỏ các yếu tố ngoại lai, đưa môi trường nước trở về đặc tính vốn có. Khả năng tự làm sạch của nguồn nước phụ thuộc vào điều kiện thành phần, tính chất, đặc điểm hình thái, chế độ thủy động nguồn nước và khí hậu khu vực; quan trọng nhất là lưu lượng nguồn nước, diện tích mặt thoáng, độ sâu và nhiệt độ nguồn nước.
Quá trình vật lý: bay hơi, lắng đọng, keo tụ các hạt rắn thô, các chất ô nhiễm tách ra khỏi nước. Ví dụ như CO2 có khả năng bay hơi làm giảm hàm lượng trong nước.
Quá trình hóa học: các phản ứng oxy hóa khử, kết tủa thông thường, ví dụ thủy phân thuốc trừ sâu nhóm phospho hữu cơ thành dạng không độc, kết tủa kim loại nặng với gốc hydroxyd, sulfid.
Quá trình sinh học: các phản ứng có tác dụng của vi sinh vật: quang hợp, phân hủy hiếu khí, yếm khí, lọc sinh học thông qua hoạt động của các loài thủy sinh, quan hệ con mồi - vật ăn thịt trong nước: các hợp chất SO42- ⇔ S2-, NO3- →NH4+ ...
Khi các quá trình tự điều chỉnh và tự làm sạch không đáp ứng nổi yêu cầu trên, các chất gây ô nhiễm vẫn nằm lại trong nước thì lúc đó nước trở nên ô nhiễm. Mức độ ô nhiễm tuỳ thuộc hàm lượng các chất đó.
- Sự ô nhiễm nước nên được đặt trong sự ô nhiễm môi trường nói chung, liên quan đến các quá trình:
+ Sự phân bố các chất ô nhiễm trong nước,
+ Sự tích lũy và giải phóng của các sinh vật trong nước,
+ Tích lũy và trao đổi ở lớp đáy,
+ Luân chuyển các chất ô nhiễm từ không khí, đất vào nước.
Các chất gây ô nhiễm nước được sinh ra từ các quá trình tự nhiên và nhân tạo có thể được phân chia thành các loại nguồn thải như bảng 4.3.
Bảng 4.3. Một số thành phần cơ bản của nước thải
| Thành phần | Nguồn thải | Ảnh hưởng trong nước |
| Các chất dễ phân hủy | Hầu hết các chất hữu cơ, đặc biệt là chất cặn bã của con người | Tiêu thụ oxy |
| Các chất tẩy rửa | Chất tẩy rửa sinh hoạt | Thẩm mỹ, độc cho thủy sinh |
| Dầu mỡ | Quá trình chế biến thực phẩm, chất thải công nghiệp | Thẩm mỹ, độc cho thủy sinh |
| Muối | Chất thải của con người, công nghiệp | Tăng độ muối trong nước |
| Kim loại nặng | Chất thải công nghiệp, phòng thí nghiệm hóa chất | Độc hại trong nước |
| Các chất hữu cơ ít khả năng phân hủy sinh học | Chất thải công nghiệp, sản phẩm sinh hoạt, nghiên cứu khoa học | Độc hại cho thủy sinh |
| Aldicarb (TBVTV) | Tấn công hệ thần kinh | |
| Benzen (dung môi) | Rối loạn máu, bạch cầu | |
| CCl4 (Dung môi) | Tổn thương gan, thận, mắt | |
| CHCl3 | Có thể gây ung thư | |
| Polyclorinated biphenyl và dẫn chất (PCBs) | Tổn thương gan, thận, có thể gây ung thư | |
| Dioxin | Một số gây ung thư, tổn thương hệ sinh sản, miễn dịch, thần kinh | |
| Hợp chất càng cua | Chất tẩy rửa, chất thải công nghiệp | Vận chuyển và hòa tan các ion kim loại nặng |
| Chất thải rắn | Nhiều nguồn thải | Thẩm mỹ, độc thủy sinh |
| Virus | Chất thải | Gây bệnh |
3.1 Nguồn thải sinh hoạt

Nguồn thải này bao gồm nguồn thải từ sinh hoạt của cư dân và hoạt động dịch vụ như bệnh viện, nhà hàng, khu vui chơi, văn phòng... Lượng nước thải sinh hoạt của khu dân cư thường được tiêu chuẩn hóa bằng 80% tiêu chuẩn cấp nước (theo TCVN 33- 2006). Tuy nhiên, con số thực tế còn phụ thuộc vào điều kiện vật chất, thói quen, khí hậu. Nguồn nước thải từ các hoạt động dịch vụ như bệnh viện, khách sạn, nhà hàng, trường học rất khác nhau.
Do đó, đặc điểm nguồn thải sinh hoạt là:
- Thành phần phong phú, đa dạng: chứa nhiều các hợp chất hữu cơ dễ và khó phân hủy, các chất hoạt động bề mặt, các chất vô cơ, kim loại nặng (bảng 4.4).
- Lưu lượng thay đổi giữa các thời điểm ngày và đêm, mùa vụ trong năm. Lưu lượng liên tục hoặc gián đoạn.
Thông thường nguồn thải này không nguy hiểm, dễ xử lý và lượng không quá lớn. Kiểm soát nguồn thải đô thị là việc hết sức cần thiết dựa trên tính toán lưu lượng ngày đêm, đặc trưng nguồn thải để thiết kế hệ thống xử lý nước thải của thành phố thời điểm hiện tại và có khả năng nâng cao công suất trong tương lai.

Bảng 4.4. Đặc điểm nguồn nước thải sinh hoạt khu dân cư
| Chỉ tiêu | Đơn vị | Khoảng nồng độ | Trung bình |
| Tổng lượng rắn (TS) | mg/l | 350 - 1200 | 720 |
| Chất rắn hòa tan (DS) | mg/l | 250-850 | 500 |
| Chất rắn không tan (SS) | mg/l | 100-350 | 220 |
| BOD5 | mg/l | 110 - 400 | 220 |
| Tổng nitơ | mg/l | 20-85 | 40 |
| Tổng chất béo | mg/l | 50 - 150 | 100 |
| Tổng phospho | mg/l | 4 - 15 | 8 |
| Clorid | mg/l | 30 -100 | 50 |
3.2 Nguồn thải công nghiệp
Nước thải công nghiệp bao gồm nước thải khu vực nhà xưởng sản xuất, nước thải sinh hoạt từ khu hành chính, sinh hoạt trong phạm vi nhà máy và nước mưa chảy tràn. Trong phạm vi tài liệu này, khái niệm nước thải công nghiệp được giới hạn trong nước thải sản xuất công nghiệp. Thông thường, nguồn thải từ các ngành công nghiệp chiếm ti trọng lớn trong số các nguồn thải gây ô nhiễm nước. Một số ngành công nghiệp phát sinh một lượng lớn nước thải như công nghiệp giấy, chế biến thủy sản (bảng 4.5).
Bảng 4.5. Lượng nước thải một số ngành công nghiệp
| Ngành công nghiệp | Lượng nước thải |
| Sản xuất giấy và bột giấy | 60 - 240 m3/ tấn sản phẩm |
| Chế biến thủy sản | 20 - 100 m3/ tấn thủy sản |
| Chế biến nông sản | 6 - 60 m3/ tấn nông sản |
| Thuộc da | 65 - 100 m3/ tấn da ướt |
| Sản xuất cafe | 22 m3/ tấn sản phẩm |
| Rượu bia | 0,3 m3/ giạ lúa (tương đương 0,31 sản phẩm) |
| Luyện cán thép | 0,1 - 0,8 m3/ tấn sản phẩm |
Đặc điểm lượng thải và tính chất hóa lý của nước thải công nghiệp phụ thuộc rất lớn đến loại hình công nghiệp, có thể chứa nhiều hóa chất khó phân hủy sinh học, có tính tích lũy hoặc chất hữu cơ dễ phân hủy...
Bảng 4.6. Đặc điểm nguồn nước thải một số ngành công nghiệp
| Chỉ tiêu (mg/l) | Chế biến sữa | Sản xuất thịt hộp | Dệt sợi tổng hợp |
| Nhiệt độ (°C) | 29 | 28 | - |
| pH | 7 | 7 | 5 |
| Tổng lượng rắn TS | 1600 | 3300 | 8000 |
| Chất rắn không tan SS | 300 | 1000 | 2000 |
| BOD5 | 1000 | 1400 | 1500 |
| COD | 1900 | 2100 | 3300 |
| Tổng nitơ | 50 | 150 | 30 |
| Tổng phospho | 12 | 16 | 0 |
Một số nguồn thải công nghiệp có thể liệt kê như sau:
- Dầu mỏ và các sản phẩm từ dầu mỏ
Dầu mỏ là hỗn hợp nhiều parafin mạch thẳng và mạch vòng thơm. Dầu nhẹ có số carbon dưới 12. Parafin thẳng dễ bay hơi, dễ tan trong nước, dễ bị phân hủy bởi vi khuẩn. Parafin mạch vòng khó phân hủy hơn. Còn dầu nặng ít bị phân hủy sinh học, lắng đọng. Trữ lượng dầu mỏ thế giới được ước tính nằm trong khoảng từ 1148 - 1260 tỉ thùng (barrel, khoảng 159 thùng) và hàng năm trên thế giới tiêu thụ khoảng hơn 100 triệu thùng dầu thô/ngày (số liệu năm 2021). Lượng dầu mỏ bị thất thoát ra môi trường khoảng 10 triệu tấn/năm phát sinh từ các khâu sử dụng với hiệu suất thấp, khai thác và vận chuyển, rò rỉ, bay hơi, sự cố từ các dàn khoan, nhà máy chế biến lọc dầu trên biển và đất liền.
Các tác động của dầu mỏ đến môi trường:

+ Nếu dầu mỏ bị thất thoát ra môi trường sẽ lan tỏa trên mặt biển thành lớp màng mỏng ngăn cản sự khuếch tán oxy vào nước. Trong điều kiện tĩnh, 1 tấn dầu có thể che phủ 12 km2 mặt biển nên tác động khá lớn đến đời sống sinh vật trong nước vì ngăn cản sự khuếch tán oxy từ khí quyển. Song song với quá trình lan tỏa, dầu sẽ bốc hơi tùy thuộc vào nhiệt độ sôi và áp suất riêng phần cũng như các điều kiện bên ngoài như cường độ sóng, tốc độ gió và diện tích tiếp xúc giữa dầu với không khí. Tốc độ bay hơi giảm dần theo thời gian. Tiếp đó là quá trình khuếch tán xáo trộn với nước và hoà tan những thành phần nhẹ của dầu trong nước. Theo thời gian dầu sẽ lắng kết gây tác động xấu tới hệ sinh thái đáy, một phần lơ lửng trong nước gây ra ô nhiễm lâu dài cho vùng nước.
+ Dầu bám vào thân các loài chim làm ướt lớp lông bề mặt, không thể bay được và thay đổi thân nhiệt dẫn đến tiêu diệt chúng.
+ Dầu tích luỹ trong tế bào và mô sinh vật làm thay đổi mùi vị hoặc có thể gây ung thư. Khi nồng độ dầu 0,1 ppm, các ấu trùng không tồn tại. Khi nồng độ này trong khoảng 1 - 100 ppm, nhiều sinh vật lớn bị tiêu diệt.
Bên cạnh đó, nhiều chủng thủy vi sinh vật khác nhau có khả năng phân hủy một nhóm hydrocarbon cụ thể nào đó. Các vi sinh vật này có thể phân hủy 0,03 - 0,5 g dầu/ngày đêm/mẻ. Khi dầu rơi xuống nước, chủng vi sinh vật hoạt động mạnh phân hủy hiếu khí. Do đó, ở trên mặt nước, dầu dễ bị phân hủy sinh học, còn khi chìm xuống đáy thì khó bị phân hủy theo kiểu này.
- Sản xuất và sử dụng chất tẩy rửa
Thành phần chính trong chất tẩy rửa chủ yếu là các chất hoạt động bề mặt chiếm 20 - 30% như alkyl benzensulfonat (ABS), alkyl sulfonat (LAS)... Các chất này làm giảm sức căng bề mặt của chất lỏng, tạo nhũ dịch hoặc hỗn dịch bền vững với chất bẩn dễ dàng tách ra. Các phụ gia khác tăng cường tác dụng của chất hoạt động bề mặt, chiếm khoảng 12%. Còn lại là chất làm bóng, chất ăn mòn, chất ổn định bọt, tạo hương... Chất tẩy rửa được đưa vào môi trường trong quá trình sản xuất và sử dụng. Những ảnh hưởng đến môi trường của các chất tẩy rửa này là:
+ Tạo ra dung dịch keo hoặc huyền phù bền vững nên khó khăn khi xử lý nước thải.
+ Giảm hoạt tính khi lọc sinh học.
+ Hiện nay LAS được sử dụng nhiều hơn so với ABS vì dễ phân hủy sinh học. Hiện nay, các chất hoạt động bề mặt giải quyết được các vấn đề liên quan đến môi trường. Chỉ còn các chất phụ gia được quan tâm nhiều hơn.
- Các kim loại trong các ngành sản xuất sơn, mạ, khai thác khoáng sản... Kim loại nặng Hg, Cd, Pb, As, Sb, Cr, Cu, Zn, Mn... thường không tham gia hoặc ít tham gia vào quá trình sinh hóa mà thường tích luỹ trong cơ thể. Vì vậy, chúng là các nguyên tố độc hại với sinh vật và con người: As có thể gây ung thư, Cd có thể gây ra cao huyết áp, suy thận, phá hủy các mô và tế bào máu, chỉ rất độc đối với thận và hệ thần kinh... Tác hại cụ thể của các kim loại này được giới thiệu kỹ trong môn Độc chất học.
- Các chất tẩy trắng, nhuộm màu trong công nghiệp sản xuất giấy, dệt nhuộm, da giày: hợp chất chứa clor, thuốc nhuộm nhóm azo (-N=N-), thuốc nhuộm acid, thuốc nhuộm base... Để tẩy trắng 1 tấn bột giấy cần tới 100 kg clor và các hợp chất của nó. Đồng thời, sau khi sản xuất, lượng chất tẩy trắng sử dụng được thải bỏ mà chưa có công nghệ tái sử dụng. Clor có thể tạo ra các sản phẩm phụ không mong muốn, gây ra các vết nứt đối với thép không gỉ, phá hủy vật liệu Nhựa trao đổi ion và các màng lọc thẩm thấu ngược.
Các loại thuốc nhuộm phong phú, thay đổi theo chủng loại nguyên liệu làm thay đổi độ màu, hàm lượng chất hữu cơ trong nước.
- Các chất hữu cơ dễ phân hủy trong công nghiệp thực phẩm như sản xuất sữa, bia, cafe, dầu ăn, chế biến thủy sản... bị phân hủy sinh học tạo ra sản phẩm CH4, S2-, NH4+, ... gây màu, mùi, tăng hàm lượng chất lơ lửng cho nguồn nước.
- Hợp chất hữu cơ tổng hợp như dược phẩm, hoá chất BVTV, hóa chất công nghiệp, chất dẻo... Một số hợp chất hữu cơ tràn ra từ các bãi chôn lấp vào mặt nước và nước ngầm hoặc bị rửa trôi xuống qua hoặc thải trực tiếp vào nguồn nước. Các hợp chất hữu cơ này không phân hủy hoặc thời gian phân hủy kéo dài hoặc dễ bay hơi gây ngộ độc trường diễn cho người sử dụng.
Năm 2006, Cơ quan Điều tra địa chất Hoa Kỳ (USGS) đã tiến hành một nghiên cứu về các chất hữu cơ dễ bay hơi (VOC) trong nước ngầm. Trong số hơn 3000 mẫu nước giếng tại nhà riêng và khu vực công cộng, các nhà nghiên cứu đã tìm thấy 20% số mẫu chứa một hoặc nhiều VOC. Mười lăm loại VOC khác, bao gồm trihalomethan (cloroform và bromoform), chất làm lạnh, MTBE (phụ gia xăng) và toluen (một thành phần của xăng) cũng có mặt trong hơn 1% mẫu nước giếng khảo sát. Một nghiên cứu tương tự năm 2002 được tiến hành trên 139 dòng suối ở Hoa Kỳ cũng phát hiện ra 95 chất hữu cơ tổng hợp khác nhau như kháng sinh, Ibuprofen, Acetaminophen, chất chống côn trùng, các chất kháng khuẩn, nước hoa, caffein và steroid. Trong số các hợp chất hữu cơ trên, 82 chất có nồng độ thấp cỡ ppb có mặt trong 80% mẫu được khảo sát.
3.3 Nguồn thải nông nghiệp
Hoạt động nông nghiệp bao gồm trồng trọt và chăn nuôi. Lượng nước thải do hoạt động nông nghiệp ở các nước công nghiệp chiếm khoảng 6,6% tổng lượng nước thải. Theo EPA, nông nghiệp là nguồn gốc lớn nhất gây suy giảm chất lượng nước bề mặt (72% nước sông bị ô nhiễm do hoạt động nông nghiệp). Con người sử dụng phân bón, TBVTV trong trồng trọt. Dư lượng TBVTV trên cây trồng bay hơi vào khí quyển hoặc bị rửa trôi, xâm nhập dần vào thủy quyển, địa quyển. Do vậy, nước sử dụng trong quá trình tưới tiêu và nước thải từ khu vực chăn nuôi thường bị ô nhiễm do thuốc BVTV chứa clor, phosphor và NO3-, PO43-.
Các hoạt động nông nghiệp tạo ra một số loại chất gây ô nhiễm như: dư thừa phân bón làm cho nước làm giàu chất dinh dưỡng (hiện tượng phú dưỡng), chất thải động vật và thực vật tạo ra BOD và hàm lượng chất rắn lơ lửng SS cao.
- Phú dưỡng là hiện tượng dư thừa chất dinh dưỡng làm thực vật phát triển quá mức, động thực vật chết gây ứ đọng, giảm độ sâu, hồ ao chứa nước trở thành đầm lầy.
- Nitrat chuyển thành nitrit gây ngộ độc, ảnh hưởng đến sức khoẻ con người và sinh vật sống.
Bộ Nông nghiệp Hoa Kỳ đã đưa ra các hướng dẫn tập trung vào sáu lĩnh vực: quản lý nguồn thức ăn; lưu trữ, kiểm soát phân hữu cơ và nước thải; quản lý phân bón dinh dưỡng vô cơ; canh tác xử lý đất đai; quản lý nước thải và phân bón thay thế; lưu giữ hồ sơ.
Thuốc trừ sâu hóa học dùng trong nông nghiệp có thể rò rỉ trong đất và từ đó ngấm vào nước. Các hóa chất này rất độc và gây ảnh hưởng xấu đến sức khoẻ con người cũng như thủy sinh. Chương trình đánh giá chất lượng nước quốc gia Hoa Kỳ trên thuốc trừ sâu và các sản phẩm phân hủy của chúng, cho thấy thuốc trừ sâu phổ biến ở các con sông, suối và nước ngầm ở Hoa Kỳ. Hơn 95% mẫu sông suối và gần 50% mẫu nước ngầm được khảo sát chứa ít nhất một loại thuốc trừ sâu. Hơn 50% dòng suối có ít nhất 5 loại thuốc trừ sâu, và khoảng 10% chứa từ 10 loại thuốc trừ sâu.
3.4 Nguồn ô nhiễm tự nhiên
Các nguồn ô nhiễm tự nhiên từ các hiện tượng thảm họa thiên nhiên như núi lửa, xói mòn, lũ quét... góp phần đưa vào thủy quyển một số tác nhận gây ô nhiễm như đất đá, bùn đất, vi sinh vật gây bệnh.
Xói mòn đất từ các cánh đồng và các vùng đồi gây ra ô nhiễm lớp trầm tích trong các tuyến đường thủy. Ngoài ra, một số hóa chất nông nghiệp không tan trong nước, chẳng hạn như một số loại thuốc trừ sâu cũng xâm nhập do bám dính vào các hạt cát. Như vậy, các phương pháp bảo tồn đất cần kết hợp bảo tồn đất và giảm ô nhiễm nguồn nước.
Người ta nhận biết nước ô nhiễm nhờ các dấu hiệu cảm quan đặc trưng liên quan đến tính chất của nó: có màu, mùi, đục, có váng... Sau này, người ta đã xác định những thông số lập thành hệ thống các chỉ tiêu chất lượng nước.
4 Một số chỉ tiêu cơ bản đánh giá chất lượng nước
Nói chung, cách xác định các chỉ tiêu chất lượng nước đều được quy định trong Tiêu chuẩn Việt Nam (TCVN). Người thực hiện phải tuân thủ theo bộ quy chuẩn này.
4.1 Các chỉ tiêu vật lý
4.1.1 Tổng lượng rắn trong nước
Tổng lượng rắn hòa tan trong nước (TS) bao gồm tổng lượng rắn hòa tan (DS) và lượng rắn không tan lơ lửng trong nước (SS). Nguồn nước có SS, DS cao ảnh hưởng đến quá trình vận chuyển nước trong đường ống, nhiễm mặn, tạo cặn lắng, giảm tuổi thọ sử dụng.
Cách xác định SS theo TCVN 6625: 2000.
4.1.2 Nhiệt độ
Nhiệt độ ảnh hưởng tới quá trình sinh hóa trong nước: nhiệt độ tăng cao làm tăng tốc độ phân hủy vật chất, giảm hàm lượng oxy hòa tan.... Nước thải từ nhà máy nhiệt điện và một số ngành công nghiệp có nhiệt độ cao ảnh hưởng đến nguồn tiếp nhận, có thể tiêu diệt các loài thủy sinh bản địa và thúc đẩy các loại tảo có hại phát triển.
4.1.3 Màu sắc
Ngoại trừ nước tự nhiên ở một số nơi có màu đặc trưng do một số loài thực vật sinh sống trong đó, nước sạch không màu. Tuy nhiên màu trong các nguồn nước thải do các chất rắn vô cơ lơ lửng hoặc chất hữu cơ gây nên như kim loại: sắt và mangan, chất nhuộm màu, chất hữu cơ bị phân hủy. Độ màu ảnh hưởng đến cảm quan người sử dụng.
Cách xác định độ màu dựa vào thang đo chuẩn (đơn vị Pt-Co) theo TCVN 6185 : 2008.
4.1.4 Độ đục
Độ đục do các chất lơ lửng trong nước, cản trở sự truyền qua của ánh sáng. Kích thước và hàm lượng các hạt khác nhau sẽ làm cho nước ở trạng thái khác nhau: lơ lửng, keo, hoà tan và ảnh hưởng đến các phương pháp xử lý nước như lọc, khử trùng.
Xác định độ đục bằng so sánh với chuẩn bằng nhiều phương pháp theo TCVN 6184: 2008.
4.2 Các chỉ tiêu hóa học
4.2.1 pH
pH là một chỉ tiêu cần thiết đối với nước cấp sinh hoạt và nước thải. pH cho biết tính acid, base của nguồn nước, liên quan đến khả năng hòa tan, ăn mòn, các dạng tồn tại của một số cấu tử trong nước và ảnh hưởng tới đời sống thủy sinh vật. Nguồn nước sạch yêu cầu pH ~ 6,5 - 7,5.
4.2.2 Hàm lượng oxy hoà tan DO (mg/l)
Lượng oxy hoà tan trong nước liên quan đến đời sống và sự phát triển của động thực vật thủy sinh. DO rất quan trọng: duy trì điều kiện hiếu khí tự nhiên, tham gia các hoạt động của sinh vật, các phản ứng hóa học trong môi trường nước, đảm bảo điều kiện thuận lợi cho quá trình tự làm sạch. Nếu trong nước chứa nhiều các chất hữu cơ bị phân hủy sinh học sẽ cần một lượng không nhỏ oxy. Một số hợp chất hữu cơ không bị phân hủy sinh học nên khi có nhiều trong nước vẫn có thể không làm giảm giá trị DO. Lượng oxy trong nước cũng liên quan đến quá trình quang hợp trong nước. Ngoài ra, tuỳ theo nhiệt độ môi trường mà giá trị DO thay đổi. Chỉ số DO thấp có nghĩa là nước có rất nhiều chất hữu cơ, ngược lại có nhiều rong tảo, thực vật nổi tham gia quá trình quang hợp giải phóng oxy.
Để xác định DO có 2 phương pháp: điện hóa sử dụng điện cực Cd và Ag. Nếu có oxy trong nước, nó sẽ bị khử và tạo Ca(OH)2 và sinh dòng điện. Phương pháp hóa học (Winkler) hiện nay ít được sử dụng.
4.2.3 Nhu cầu oxy hóa sinh học BOD (mg/l)
BOD là lượng oxy cần thiết để oxy hóa các chất hữu cơ có thể bị phân hủy sinh học. Đây chính là khả năng tự làm sạch của các dòng chảy tự nhiên. Trong nước phải đảm bảo không có các chất ức chế hoạt động của vi sinh vật như kim loại, chất độc hóa học và đủ dinh dưỡng. Đây chỉ là phản ứng oxy hóa thuần túy sinh CO2, H2O và NH3. Quá trình oxy hóa các chất hữu cơ thường qua 2 giai đoạn:
- Oxy hóa các hợp chất hydrocarbon.
- Oxy hóa các hợp chất chứa nitơ.
Thời gian xác định BOD lâu do cần thời gian để VSV phát triển. Thông thường người ta quy ước xác định sau 5 ngày ở 20°C cho giá trị BODs. Các yếu tố ảnh hưởng đến giá trị BOD đều phải loại bỏ.
Xác định BOD theo TCVN 6001-1: 2008.
4.2.4 Nhu cầu oxy hóa học COD (mg/l)
COD là lượng oxy để oxy hóa các chất hữu cơ trong nước. Sản phẩm quá trình là CO2, H2O và NO3-.
Giá trị COD bao gồm cả BOD nhưng thời gian xác định nhanh do thực hiện các phản ứng hóa học (3 - 5 giờ). Nếu tỷ số COD/ BOD, càng lớn thì các chất hữu cơ không phân hủy sinh học trong mẫu nước càng nhiều.
Xác định COD theo TCVN 6491: 1999.
4.2.5 Hàm lượng nitơ (mg/l)
Đây là chỉ tiêu biểu hiện các dạng nitơ tồn tại trong nước, biểu diễn dưới dạng N - tổng, N-NH4+, N-NO2-, N-NO3-. Lượng hợp chất nitơ quá lớn trong tự nhiên gây hiện tượng phú dưỡng (tích tụ chất dinh dưỡng) cản trở dòng chảy hoặc tích tụ trong cơ thể qua chuỗi thức ăn ảnh hưởng đến sức khoẻ,
Nồng độ amoni NH4+ trong nước ngầm thường cao hơn trong nước bề mặt. Khi ph và nhiệt độ cao, NH4+ → NH3 độc cho các và động vật thủy sinh. Còn NO2- và NO3- là chất dinh dưỡng cho thực vật và tảo nhưng khi hàm lượng cao đều ảnh hưởng đến hệ sinh thái và sức khỏe người sử dụng. NO2- khi vào cơ thể người, kết hợp với hồng cầu, ngăn cản khả năng vận chuyển oxy, gây bệnh thiếu máu hoặc tạo với nhóm amin thành nitrosamin gây ung thư.
Có thể xác định hàm lượng nitơ bằng phương pháp sắc ký ion, điện hóa, đo quang... theo TCVN 7323-2-2004, TCVN 6179-2-1996, TCVN 6494-1-2011.
4.2.6 Hàm lượng sắt và mangan (mg/l)
Sắt và mangan tồn tại 2 dạng dễ tan và khó tan trong nước. Thông thường, trong nước ngầm chúng ở dạng Fe2+ và Mn2+ (trong điều kiện yếm khí, chúng dễ bị khử về hóa trị trên) nhưng khi tiếp xúc với không khí, chúng bị oxy hóa thành dạng Fe3+ và Mn4+ làm nước có tủa vàng, mùi tanh, váng nâu ảnh hưởng đến quá trình vận chuyển nước, đời sống và chất lượng sản phẩm trong ngành công nghiệp sản xuất giấy, thực phẩm. Sắt và mangan là những nguyên tố cần thiết cho sự phát triển của sinh vật nhưng với lượng vừa đủ:
- Nhu cầu dinh dưỡng Mn là 30 - 50 ug/kg thể trọng/ngày. Nếu dư, mangan tác động lên hệ thần kinh trung ương, gây tổn thương thận, hệ tuần hoàn, phổi, có thể dẫn tới tử vong.
- Nhu cầu dinh dưỡng Fe là 8,7 - 14,8 mg sắt/kg thể trọng/ngày. Sắt dư thừa sẽ đau dạ dày, táo bón, tổn thương niêm mạc đường tiêu hóa, gan, thận, tim, phổi, có thể dẫn tới suy gan.
Người ta xác định sắt và mangan bằng nhiều phương pháp: tạo phức màu đo quang (đối với Fe), định lượng phân tích thể tích, phổ hấp thụ nguyên tử AAS (với Fe, Mn).
4.2.7 Hàm lượng thành phần vi lượng (mg/l)
Một số chất ô nhiễm vi lượng: kim loại nặng (vết) như chì, thủy ngân, cadmi, crom; arsen; hóa chất bảo vệ thực vật nhóm clor hữu cơ, phosphor hữu cơ, carbamat, pyrethroid thường độc đối với con người, sinh vật và thời gian tồn tại trong môi trường lâu dài. Ngày nay hợp chất hữu cơ clor đã bị cấm sử dụng.
Do lượng ít và đặc trưng nên sử dụng phương pháp phân tích hiện đại và tốn kém: HPLC, GC (chất hữu cơ) hoặc AAS (chất vô cơ như As, Cd....). Phần này sẽ được trình bày kỹ trong môn Độc chất học.
4.3 Các chỉ tiêu vi sinh
Trong nước, đặc biệt là nước thải có rất nhiều loại vi khuẩn, tảo, vi trùng, virus có khả năng gây bệnh nên cần loại bỏ trước khi sử dụng. Có 3 nhóm chính:
- Nhóm Coliform, đặc trưng Escherichia Coli (E.coli) chiếm 80%,
- Nhóm Streptococci, đặc trưng Streptococcus faecalis,
- Nhóm Clostridia, đặc trưng Clostridium perfringents.
Giá trị E.coli là đại lượng đặc trưng mức độ nhiễm khuẩn của nguồn nước vì khi chủng vi khuẩn này giảm đến gần tiêu chuẩn thì các loài khác đã bị tiêu diệt. Chỉ tiêu an toàn theo yêu cầu TCVN đối với:
- Nước cấp: E. coli không tồn tại; Coliform < 20 MPN/100 ml.
- Nước thải: Coliform trong mình thôi loại A < 5000 MPN/100 ml,
Một số chỉ tiêu chất lượng nước cần xác định theo mục đích sử dụng được thể hiện ở bằng 4,7,
Bảng 47. Một số chỉ tiêu chất lượng nước cần xác định theo mục đích sử dụng
| TT | Mục đích sử dụng | Một số thông số chính |
| 1 | Sản xuất năng lượng | DO, pH |
| 2 | Tưới tiêu | DS |
| 3 | Nước uống | Độ màu, độ đục, độ cứng, vi sinh, chất hữu cơ |
| 4 | Nước cấp cho công nghiệp | Độ cứng, pH, DO |
| 5 | Giao thông | SS, pH |
| 6 | Nghề cá | DO, TBVTV, pH, kim loại nặng, CO2 |
| 7 | Giải trí | Vi sinh, pH |
5 Nguyên tắc lấy và bảo quản mẫu nước
- Xác định cụ thể vị trí lấy mẫu: đại diện được cho vùng nước:
+ Lấy theo chiều dọc hay chiều ngang dòng nước, lấy mẫu trên bề mặt hay theo các tầng nước.
+ Lấy trước và sau điểm thải,
- Lấy mẫu nước.
+ Số mẫu, thời điểm lấy mẫu, tần suất lấy mẫu phụ thuộc đặc điểm khu vực và mục tiêu nghiên cứu (thường lấy mẫu vào buổi sáng vì khi đó sự biến động của các chất diễn ra chậm).
+ Nếu lấy mẫu qua vòi, máy bơm... thì phải để chảy qua vài lit rồi mới lấy.
+ Nếu mẫu động: có thay đổi dòng chảy, điểm thải thì phải lấy ở các điểm khác nhau.
+ Lượng mẫu đủ để phân tích.
+ Nên lấy mẫu ở vị trí chảy mạnh nhất đối với nguồn chảy như sông, suối và lấy nhiều vị trí, nhiều độ sâu đối với nguồn tĩnh ao, hồ.
+ Mẫu nước thải nên lấy lúc xả thải và lúc triều thấp để đảm bảo chính xác,
- Bảo quản mẫu: nhằm giảm tác động của các quá trình diễn ra trong mẫu khi đi đến nơi phân tích. Do đó, nhiệt độ, pH, hàm lượng DO và các khí trong nước nên được đo ngay tại hiện trường. Người ta có thể bảo quản mẫu bằng cách điều chỉnh pH, lưu giữ ở nhiệt độ thấp, thêm hóa chất thích hợp như NaOH, H2SO4, CHCl3.... tùy theo đổi tượng phân tích (theo tiêu chuẩn quốc gia TCVN 6663-3: 2008).
6 Một số phương pháp xử lý nước
Hệ thống xử lý nước bao gồm các phương pháp cơ học, hóa lý và sinh học. Theo mục đích sử dụng nước, chất lượng nước đầu vào, yêu cầu chất lượng nước đầu ra mà các phương pháp được kết hợp lại thành dây chuyển xử lý nước (nước cấp sinh hoạt hoặc nước thải). Đối với nước thải thường chia làm 3 bậc:
- Bậc 1: xử lý sơ bộ thường là xử lý cơ học như song chắn rác, bể lắng. Đôi khi có kết hợp xử lý hóa lý tách dầu mỡ, trung hòa để tạo thuận lợi xử lý sinh học tiếp theo.
- Bậc 2: thường là công trình xử lý sinh học để phân hủy các chất hữu cơ.
- Bậc 3: đòi hỏi chất lượng nước cao hơn như khử trùng, khử tiếp thành phần nitrat, phosphat.
6.1 Xử lý cơ học
Các kỹ thuật cơ học thường sử dụng để tách các hạt rắn không tan và một phần dạng keo ra khỏi dòng lỏng.
6.1.1 Song, lưới chắn rác
Nước có chứa các hạt rắn được dẫn qua song, lưới chắn để loại bỏ tạp có kích thước lớn gây sự cố trong khi vận hành như tắc bơm, tắc đường ống. Sau đó nước được dẫn qua thiết bị khác trong hệ thống xử lý nước. Song và lưới chắn rác là các thanh chắn song song hoặc tấm lưới thép hoặc tấm thép đục lỗ. Song, lưới chắn rác thường được đặt ngay tại bước đầu tiên xử lý dòng lỏng. Tùy theo kết cấu người ta phân biệt song chắn rác thô và tinh, song chắn rác cố định và di động.
6.1.2 Bể điều hòa
Bể điều hòa nhằm điều tiết lưu lượng, thành phần dòng lỏng chảy vào hệ thống xử lý. Bể có thiết bị khuấy trộn để đảm bảo phân bố tốt. Vị trí bể điều hòa được xác định tùy thuộc yêu cầu dòng cần xử lý, thông thường nó được thiết kế nằm trong dòng thải cần xử lý, trước bể lắng.
6.1.3 Bể lắng
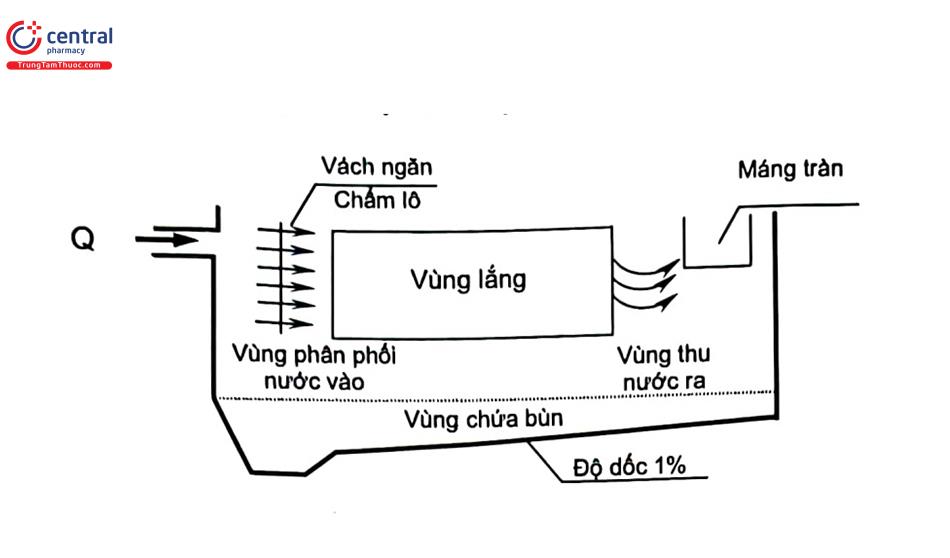
- Nguyên tắc: bể lắng là phương pháp đơn giản nhất để tách các hạt rắn (tồn tại trong nước hoặc bông cặn sau khi xử lý) khỏi dòng lỏng dưới tác dụng trọng lực. Có nhiều loại bể lắng: bể lắng ngang, lắng đứng, lắng tiếp tuyến. Bể lắng làm giảm giá trị của các chỉ tiêu SS, BOD, COD.
- Yếu tố ảnh hưởng: tốc độ lắng hạt rắn gây ra do đặc điểm hạt rắn rời rạc hay trạng thái bông và tốc độ chảy tràn của dòng lỏng qua đường ra của bể lắng và hình dạng bể lắng.
- Ưu nhược điểm và phạm vi sử dụng: bể lắng thường có kết cấu đơn giản, dễ dàng vận hành, chi phí xây dựng thấp. Bể lắng thường:
+ Đặt trước khi xử lý sinh học: loại bỏ các chất rắn, chất lơ lửng không hòa tan.
+ Đặt sau khi xử lý đông tụ, sinh học: lắng bông cặn, bùn hình thành làm trong nước trước khi đưa qua nguồn tiếp nhận.
Bể lắng có thể sử dụng để xử lý nước cấp sinh hoạt và nước thải.
6.1.4 Bể lọc cơ học
- Nguyên tắc: là phương pháp loại các hạt rắn kích thước nhỏ không tan trong nước mà bể lắng không tách được. Nước được dẫn nước qua một lớp vật liệu (cát vàng, than antraxit, polyme...). Phần lỏng thấm qua, còn các hạt rắn sẽ được giữ lại trên bề mặt. Có 2 cách lọc nước: lọc nhanh và lọc chậm được phân loại theo tốc độ lọc tức là tốc độ dòng chảy qua lớp vật liệu lọc.
- Lọc nhanh: lớp vật liệu có kích thước hạt lớn để tốc độ dòng chảy qua lớn, khoảng 5 - 15 m/h.
- Lọc chậm: tốc độ dòng chậm khoảng 0,1 - 0,5 m/h khi đi qua lớp vật liệu mịn.
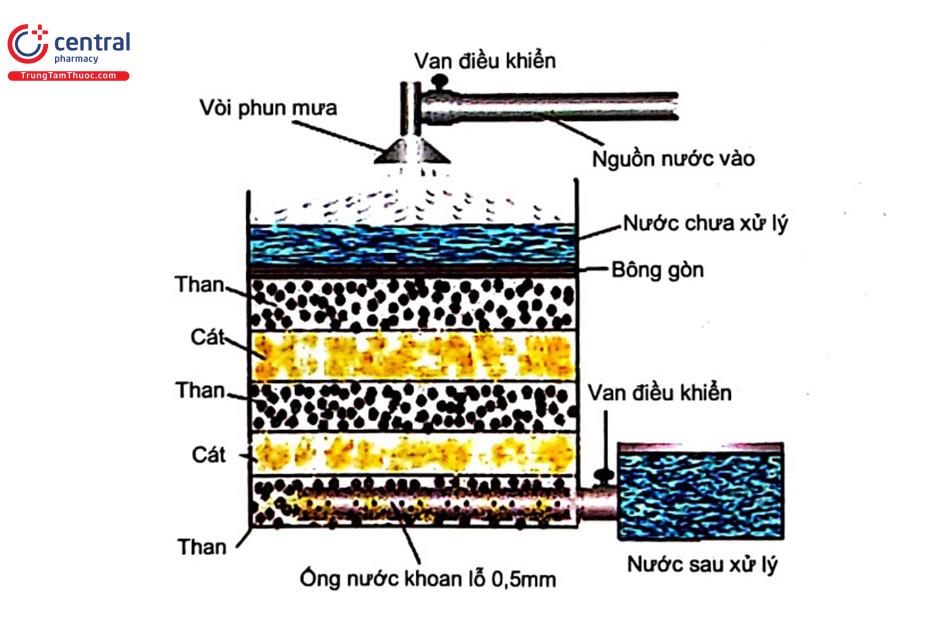
- Các yếu tố ảnh hưởng: bản chất và kích thước, hình dạng, độ đồng nhất vật liệu lọc, chất lượng nước đầu vào. Vật liệu lọc phải bền cơ và hóa học.
- Ưu nhược điểm và phạm vi sử dụng: đơn giản, dễ áp dụng. Tuy nhiên chúng đều phải có bước rửa lọc tức là rửa lớp vật liệu lọc sau một thời gian sử dụng hoặc thay mới. Bể lọc có thể sử dụng để xử lý nước cấp sinh hoạt và nước thải với nguồn nước có hạt rắn lớn hơn 10-4 mm. Lọc chậm cần đầu tư lớn hơn và mất nhiều thời gian hơn nhưng chất lượng nước tốt. Bể lọc chậm thường áp dụng ở nguồn nước quy mô không quá 1000 m3/ngày đêm và SS ≤ 50 mg/l.
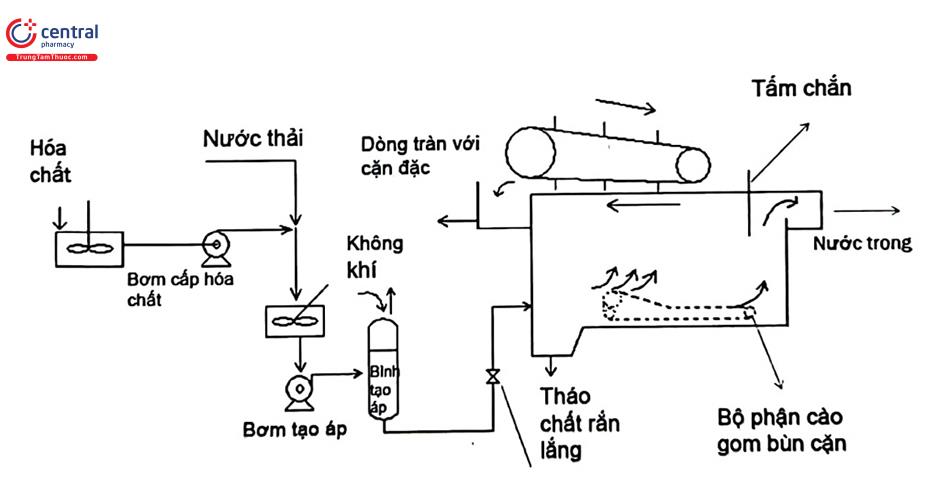
6.1.5 Tuyển nổi
- Nguyên tắc: tách các hạt rắn không tan lơ lửng, các chất hoạt động bề mặt hoặc chất lỏng có tỉ trọng nhỏ hơn trong dòng lỏng. Khi tuyển nổi, phải sục khí (thường là không khí) vào dòng lỏng. Các khí kết dính với các hạt (dầu, sợi giấy, len...) không thấm ướt cho đến khi lực nổi đủ lớn hình thành các đám bọt chứa hạt rắn và được gạt ra ngoài.
- Các yếu tố ảnh hưởng: khả năng kết dính bọt khí và các hạt rắn tức là hình dạng và bản chất hóa học hạt rắn, chất lỏng nhẹ cần tách, thời gian và cường độ sục khí, thời gian tồn tại bọt nổi, kích thước bọt.
- Ưu nhược điểm và phạm vi sử dụng: nguyên tắc đơn giản, đầu tư ít, thời gian nhanh, triển khai nhiều kỹ thuật. So với bể lắng, tuyển nổi có thể tách được hạt rắn kích thước nhỏ. Có thể kết hợp tuyển nổi sinh học và tuyển nổi hóa học: VSV lên men sinh khí CO2, CH4 hoặc các phản ứng hóa học sinh khí kéo cặn nổi lên và thường được sử dụng trong xử lý nước thải.
6.2 Xử lý hóa lý
6.2.1 Đông tụ keo tụ
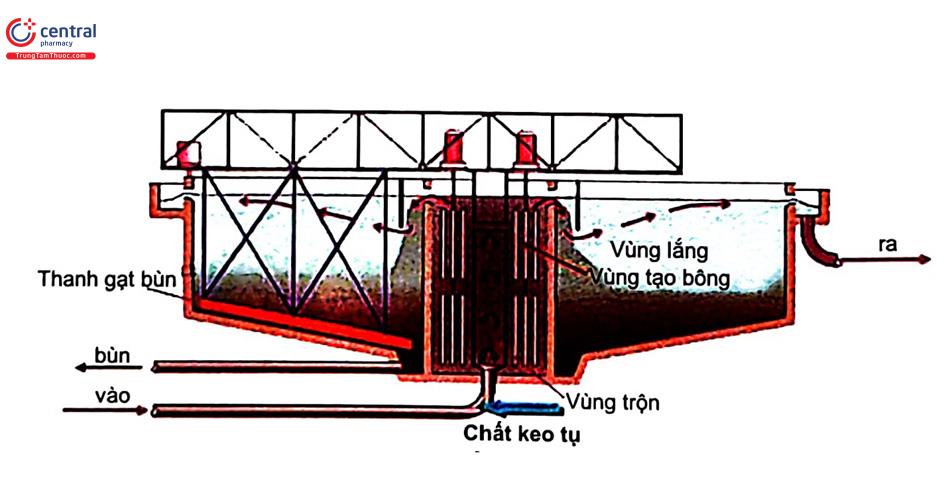
- Nguyên tắc: sử dụng hóa chất làm hạt nhân, hấp thu các hạt rắn lơ lửng không tan trong nước (thường các hạt rắn có kích thước dưới 104 mm) để tăng kích thước của chủng rồi dễ dàng loại bỏ bằng kỹ thuật lắng hoặc lọc nước. Quá trình gồm 2 giai đoạn: keo tụ phá vỡ trạng thái bền của hạt keo và tạo bông kết dính các hạt keo bị phá này. Các chất keo tụ mang điện dương như phèn nhôm hoặc phèn sắt được sử dụng nhiều trong kỹ thuật đông tụ, keo tụ do tạo ion dương thu hút các hạt keo mang điện âm trong nước. Muối phèn nhôm Al(SO4)3.14H2O đưa vào sẽ bị thủy phân tạo bông cặn Al(OH)3 hấp phụ các hạt lơ lửng nhưng pH môi trường tối ưu từ 5,5 - 7,5 do tính chất lưỡng tính của Al. Đối với phèn sắt tạo tủa Fe(OH)3 nên giới hạn giá trị pH từ 8 - 10. Lượng phèn sắt dùng bằng 0,3 - 0,5 lượng phèn nhôm và có tính ăn mòn hơn phèn nhôm. Theo tiêu chuẩn xây dựng, hàm lượng SS, độ đục, độ màu trong nước sẽ gợi ý việc sử dụng lượng phèn cần thiết.
Al3++ 3H2O = Al(OH)3 + 3H+
Fe3++ 3H2O = Fe(OH)3 + 3H+
Ngoài ra hiện nay người ta cho thêm các chất trợ keo tụ nguồn gốc thực vật để tạo bông cặn lớn hơn, tốc độ keo tụ nhanh hơn, hiệu suất cao hơn.
- Yếu tố ảnh hưởng: pH là yếu tố quan trọng để tạo ra lượng Al(OH)3 hoặc Fe(OH)3. Tiếp đó các yếu tố khác như lượng phèn, thời gian tiếp xúc giữa phèn và nước vừa đủ, tốc độ cánh khuấy cũng tác động đến hiệu suất quá trình.
- Ưu nhược điểm và phạm vi sử dụng: kỹ thuật này rất phổ biến nhằm loại bỏ các hạt lơ lửng không tan trong nước hoặc một số chất hữu cơ tan trong nước thông qua các chỉ tiêu cao như độ màu, SS, BODs, COD. Hóa chất rẻ tiền, thiết bị đơn giản, dễ lắp đặt vận hành. Kỹ thuật áp dụng được đối với nguồn nước sinh hoạt (đặc biệt nước bề mặt) và nước thải
6.2.2 Làm mềm kết hợp làm ngọt
- Nguyên tắc: làm mềm nước tức là loại bớt muối Ca và Mg ra khỏi nước. Làm mềm bằng hóa chất như NaOH, NazCO, hoặc cột cationit (tái tạo cột bằng zeolit Na2Al2Si2O8).
Na2Al2Si2O8. xH2O + Ca(HCO3)2 → 2NaHCO3 + CaAl2Si2O8. xH2O
Làm ngọt là loại bớt muối ra khỏi nước. Do vậy có thể kết hợp làm mềm với làm ngọt nước:
+ Trao đổi ion: là quá trình trao đổi mà các ion trên bề mặt chất rắn đổi chỗ với ion có cùng điện tích trong dung dịch khi cho tiếp xúc với nhau. Các chất trao đổi ion là zeolit, acid humic của đất, siligagel... Ví dụ:
2RNa + CaSO4 = R2Ca + Na2SO4
Quá trình này phụ thuộc loại nhựa (chất rắn) trao đổi, loại ion.
Ưu nhược điểm: thu hồi các chất có giá trị trong dòng lỏng cần xử lý, xử lý triệt để chọn lọc đối tượng. Chi phí đầu tư và vận hành lớn.
+ Thẩm thấu ngược: trái ngược với thẩm thấu, nhờ áp lực, dung môi từ dung dịch nồng độ lớn đi vào dung dịch loãng hơn qua màng bản thẩm. Màng bán thẩm này được làm từ cellulose acetat, polyamid... đường kính lỗ 1 um phải chịu được áp suất. Màng có tuổi thọ từ 2 - 5 năm.
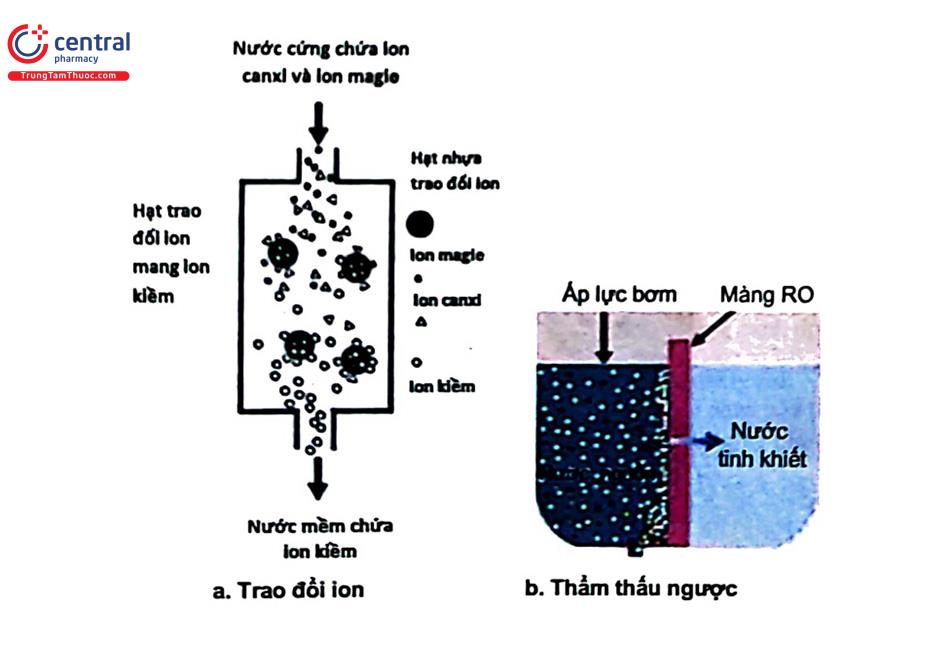
Quá trình này phụ thuộc áp lực, cấu trúc màng bán thấm, chất cần tách. Quá trình hiệu quả khi tách loại các chất có khối lượng phân tử thấp. Phương pháp này loại nguyên tố vô cơ, các chất có khối lượng phân tử thấp, VSV, chất rắn tan trong nước (DS) tốt. Giá thành chấp nhận được.
+ Điện thẩm tích: tác dụng của điện trường làm các ion muối trong nước di chuyển về điện cực trái dấu.
Phương pháp này có giá thành cao.
- Phạm vi áp dụng: các kỹ thuật này thường áp dụng cho các nguồn công suất nhỏ, thường là nước cấp sinh hoạt hoặc mục đích sử dụng đặc thù.
6.2.3 Trung hòa
- Nguyên tắc: khi nguồn nước có chứa acid hoặc kiềm, cần trung hòa để ngăn hiện tượng xâm thực, loại bớt kim loại nặng hoặc để thuận lợi cho quá trình xử lý sinh học tiếp theo thì cần điều chỉnh pH về 6,5 - 7,5.
Một số hóa chất sử dụng để trung hòa như CaCO3, Ca(OH)2, Na2CO3, HCl, H2SO4...
- Yếu tố ảnh hưởng: đặc điểm nguồn nước, yêu cầu tính chất nước đầu ra.
- Ưu nhược điểm, phạm vi áp dụng: đơn giản, dễ vận hành. Thường áp dụng với xử lý nước thải.
6.2.4 Làm thoáng, oxy hóa
- Nguyên tắc: thổi không khí hoặc khí trơ vào nguồn nước chứa chất hòa tan. Chất ô nhiễm dễ bay hơi thì sẽ khuếch tán vào bọt khí. Nếu chất này bị oxy hóa rồi kết tủa thì được tách ra khỏi pha lỏng. Có thể sử dụng các chất oxy hóa Cl2, H2O2 hoặc O3 để tăng hiệu suất quá trình.

- Yếu tố ảnh hưởng: nhiệt độ, mức độ phân tán khí, cường độ làm thoáng, pH, đặc điểm chất hòa tan.
- Ưu nhược điểm và phạm vi áp dụng: đơn giản, thường sử dụng làm thoáng bằng giàn mưa lấy oxy trong không khí, tạo các kết tủa của sắt, mangan và arsen trong nước rồi loại bỏ bằng phương pháp lẳng hoặc lọc.
Fe+2 → Fe+3
Mn+2 → Mn+4
As+3 → As+5
6.3 Xử lý sinh học
Dựa vào hoạt động của vi sinh vật để phân hủy (oxy hóa, khử) các hợp chất hữu chất dinh dưỡng, hợp chất và thành phần chất hữu cơ dạng vết hoặc hấp phụ, tạo keo thành bông sinh học. Các VSV thường tham gia trong bông bùn hoạt tính là Nitrosomonas, Nitrobacter, Pseudomonas....
Điều kiện dòng lỏng được xử lý bằng phương pháp sinh học:
- Không có chất độc hoặc ức chế hoạt động VSV, ví dụ kim loại nặng Ag, Cu, Hg, Co, Ni, Pb...
- Chất hữu cơ trong nước là cơ chất dinh dưỡng như hydrocarbon, protein, lipit... hòa tan trong nước.
- Tỉ số COD/BOD5 ≤ 2 thì xử lý hiếu khí. Nếu tỉ số này trên 2 và nước chứa cellulose, tinh bột... không tan thì xử lý yếm khí trước.
Phương pháp này thường áp dụng xử lý nước thải. Quá trình này cũng cho hiệu quả khử trùng đối với dòng lỏng chảy ra khá cao, từ 91 - 98%.
6.3.1 Xử lý với điều kiện tự nhiên
- Cánh đồng lọc
+ Nguyên tắc: khi cho dòng lỏng chảy qua, lớp đất như lớp vật liệu lọc lưu giữ các hạt rắn. Nhờ oxy trong lỗ rỗng và lớp mao quản đất mặt, VSV hiếu khi phân hủy chất hữu cơ trong nước. Khi xuống sâu, chỉ còn quá trình phân hủy yếm khí.
+ Yếu tố ảnh hưởng: đặc điểm nước thải, địa chất, địa lý vùng cánh đồng.
+ Ưu nhược điểm và phạm vi sử dụng: nếu nguồn nước chứa lượng lớn N, P, K thì có thể sử dụng như nguồn nước tưới trong nông nghiệp. Phương pháp này thân thiện với môi trường, đầu tư không lớn nhưng cần diện tích rộng. Do vậy không phù hợp ở đô thị, khu dân cư.
- Hồ sinh học
+ Nguyên tắc: các vi sinh vật sử dụng oxy từ rêu, tảo, thực vật trong quá trình quang hợp và oxy từ không khí oxy hóa các hợp chất hữu cơ trong nước. Thực vật lại tiêu thụ phosphat, nitrat từ sản phẩm phân hủy sinh học trên. Hoạt động của hồ phụ thuộc chủ yếu khả năng tự làm sạch. Hồ còn có tên gọi hồ ổn định nước thải. Căn cứ hoạt động của VSV, chia ra hồ hiểu khí, hồ kỵ khí (dể lắng và phân hủy cặn lắng) và hồ hiểu kỵ khí.
+ Yếu tố ảnh hưởng: nhiệt độ nước (≥ 6 độ C), pH và mức độ nhiễm bẩn nguồn nước, thời gian lưu nước trong hồ.
+ Ưu nhược điểm và phạm vi sử dụng: đơn giản, tận dụng hồ ao tự nhiên, thời gian dài. Hồ kỵ khí phù hợp xử lý nước thải có giá trị COD, BOD, SS lớn hơn hồ hiếu khí, hiếu kỵ khí. Hồ sinh học đòi hỏi diện tích lớn. Có thể kết hợp nhiều hồ.
6.3.2 Xử lý với điều kiện nhân tạo
- Lọc sinh học
+ Nguyên tắc: lớp vật liệu lọc có chứa các VSV để tăng hiệu quả quá trình.
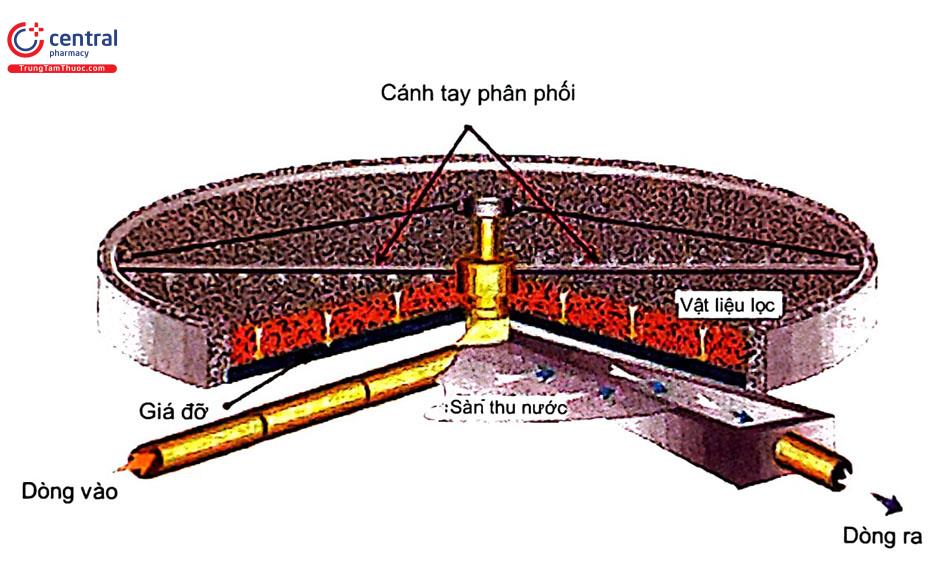
+ Yếu tố ảnh hưởng: chủng và diện tích VSV trên lớp vật liệu, loại vật liệu lọc, tính chất nước thải đầu vào: nhiệt độ, pH, nồng độ chất hữu cơ, thời gian lưu nước trong bể.
+ Ưu nhược điểm và phạm vi sử dụng: làm giảm giá trị BOD, SS, nitơ trong nước. Thời gian vận hành nhanh, ít cặn hơn bể phân hủy hiếu khí, chiếm ít diện tích. Tuy nhiên môi trường quanh bể thường có mùi và ruồi muỗi. Bể lọc sinh học thường áp dụng quá trình nitrat hóa, đứng độc lập hoặc sau bể aerotank, phù hợp quy mô xử lý nhỏ và vừa.
- Bể phân hủy hiếu khí (aerotank)
+ Nguyên tắc: bùn hoạt tính là các bông cặn có chứa chất dinh dưỡng được đưa vào bể để phát triển các VSV. Với sự hỗ trợ của thiết bị sục khí, VSV sẽ oxy hóa phân hủy chất hữu cơ trong nước: chất nền (BOD), chất dinh dưỡng (N, P) thành các chất trợ không tan và tế bào mới. Các quá trình xảy ra trong bể aerotank:
- Quá trình tăng sinh khối: số lượng VSV trẻ tăng lên.
- Quá trình chuyển hóa cơ chất:
Chất hữu cơ + O2 → CO2 + H2O
- Quá trình khử nitơ và phospho:
Hợp chất hữu cơ chứa nitơ tạo ra NH4+ →NO2- → NO3- → N2;
Hợp chất hữu cơ chứa phospho tham gia tổng hợp tạo ATP, acid nucleic.
Lượng bùn sinh ra được mang đi xử lý, một phần được tuần hoàn ngược trở lại bể aerotank để duy trì nồng độ VSV, đảm bảo thời gian phân hủy các chất ô nhiễm.
+ Yếu tố ảnh hưởng: loại bùn hoạt tính, tốc độ và thời gian sục khí, tính chất nước thải: pH, nhiệt độ, DO, SS.
+ Ưu nhược điểm và phạm vi sử dụng: có thể ứng dụng với nguồn nước thải lưu lượng lớn, giá trị COD, BOD cao mà xử lý triệt để (khử tới 70% BOD từ hợp chất carbon), thời gian phân hủy dài ngày. Thiết bị và vận hành đơn giản nhưng cần cấp năng lượng hoạt động. Phải theo dõi và kiểm soát các sự cố đối với bùn hoạt tính: bùn có nhớt, tạo bọt và bị váng.

- Bể phân hủy yếm khí UASB
+ Nguyên tắc: nước thải có pH và chất dinh dưỡng hữu cơ phù hợp được đưa vào từ đáy bể, thực hiện quá trình phân hủy yếm khí: NO3 thành N2 nhờ VSV như Pseudomonas, Bacillus, Spirillum, Acinetobacter.... Nước sạch chảy tràn phía trên. Sản phẩm khí tạo ra có 70 - 80 % là CH4. Quá trình phân hủy các chất hữu cơ trải qua 3 giai đoạn:
- Thủy phân các chất hữu cơ lơ lửng hoặc chất hữu cơ hòa tan phân tử lượng lớn,
- Phân hủy chất hữu cơ phân tử lượng thấp thành acid béo bay hơi, cuối cùng là acid acetic,
- Tạo metan.
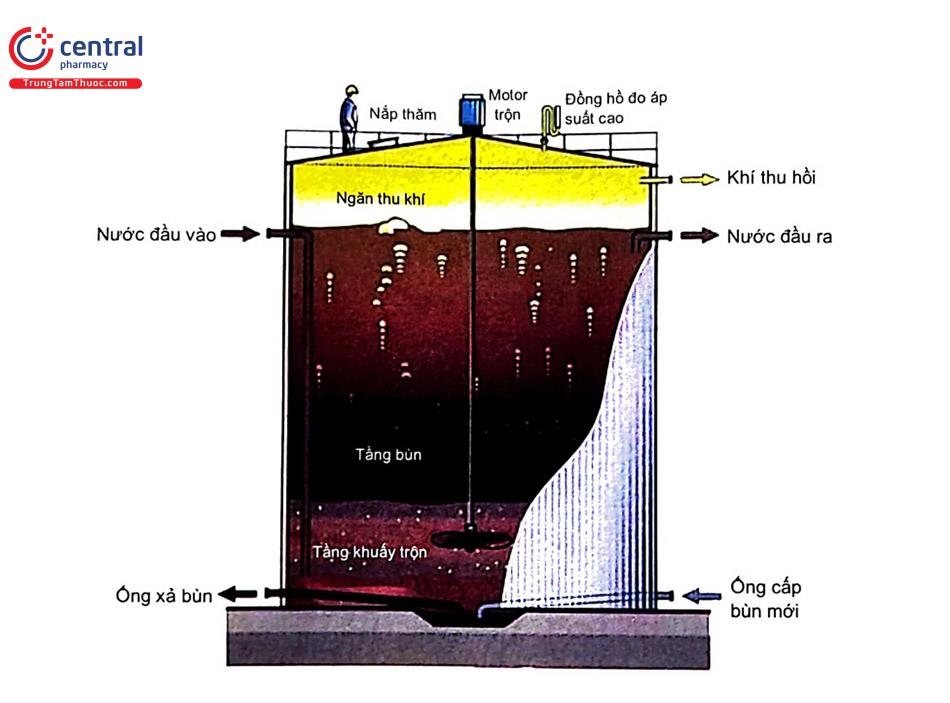
+ Yếu tố ảnh hưởng: đặc điểm nguồn nước (nhiệt độ tối ưu 30 - 35°C, pH tối ưu 6,8 - 7,5), tỉ lệ chất dinh dưỡng, vận tốc dòng thải đi vào (1m/giờ), hàm lượng SS <3000 mg/l, SO42- < 500 mg/l...
+ Ưu nhược điểm và phạm vi sử dụng: giảm đáng kể chi số COD (hiệu suất tới 80%) và BOD trong nước thải, lượng bùn thải tạo ra ít. Có thể tận dụng khí thải CH4. Yêu cầu lượng dinh dưỡng N và P trong nước thải thấp. Nhạy cảm yếu tố môi trường: nhiệt độ, pH, độ mặn và không xử lý được hoàn toàn chất độc.
Tùy theo tính chất, đặc điểm nguồn nước thải, điều kiện thực tế tại đơn vị mà lắp đặt thiết bị phân hủy hiếu khí hoặc yếm khí xử lý nước thải. Nhìn chung, phương pháp phân hủy yếm khí có ưu điểm: nhu cầu năng lượng và dinh dưỡng thấp, lượng bùn thải ít nhưng tận dụng khí CH4 sinh ra. Tuy nhiên, quá trình khởi động phân hủy lâu, môi trường kiềm hơn, không có chất độc và không khử được hợp chất chứa N, P.
6.4 Khử trùng
Nguyên tắc: là quá trình loại bỏ, tiêu diệt hoặc vô hiệu hóa các nhóm VSV hoặc các chủng VSV gây bệnh chưa được xử lý triệt để trong các bước xử lý nước phía trước. Khử trùng là khâu cuối cùng, sau khi đã xử lý cơ học, hóa lý, sinh học. Khử trùng bằng tác nhân vật lý: nhiệt độ, tia UV hoặc các màng lọc d=0,2 um và tác nhân hóa học như ozon, clor.
6.4.1 Khử trùng bằng tia cực tím (UV)
- Nguyên tắc: tia cực tím tác dụng vào cấu trúc ADN của VSV. Vùng tia UV diệt vi khuẩn mạnh nhất có bước sóng 200 - 280 nm (lớn nhất tại bước sóng 254 nm). Thiết bị là đèn thủy ngân chân không có bước sóng phát xạ 254 nm. Đèn phát thế hệ mới: đèn phẳng hiệu suất phát tia cao, bền nhiệt, thời gian sử dụng dài hơn, định hướng được tia phát ra song song với hướng dòng chảy.
- Yếu tố ảnh hưởng: độ đục, chất màu của nước và đặc điểm VSV. Thời gian sử dụng đèn khống chế 3000 - 8000 giờ.
- Ưu nhược điểm và phạm vi sử dụng
- Ưu điểm: mùi vị và thành phần nước không thay đổi, không có sản phẩm phụ như clo. Thời gian khử trùng ngắn, không có nguy cơ quá liều. Thiết bị hoạt động không phức tạp, an toàn cao.
- Nhược điểm: hiệu suất khử khuẩn thấp khi nước có độ truyền qua < 80%, có nhiều muối hòa tan. Nước đã khử trùng có thể nhiễm lại (do tính hồi phục của VSV) nên cần khử trùng bổ sung khi mạng dẫn nước dài.
Sử dụng đối với nước cấp sinh hoạt, nước sản xuất phạm vi nhỏ hẹp, công suất thấp hoặc các loại nước đóng chai.
6.4.2 Khử trùng bằng vi lọc
- Nguyên tắc: tương tự như lọc nước nhưng đường kính lỗ lọc nhỏ 0,2 - 0,3 m để lưu giữ được các vi sinh vật.
Thiết bị vi lọc hình trụ. Nến lọc được sản xuất từ diatomit và đất sét cùng phụ gia được thiêu kết có độ xốp cao làm cho các mao quản có kích thước nhỏ hơn vi khuẩn cần loại.
- Yếu tố ảnh hưởng; nước đầu vào cần độ trong nhất định và chất lượng nến lọc.
- Ưu nhược điểm và phạm vi sử dụng
- Ưu điểm: tính linh hoạt cao nên có thể lắp song song nhiều nến lọc công suất khác nhau. Thành phần khoảng của nước không đổi. Giá thành thấp.
- Nhược điểm: nước dễ nhiễm khuẩn trở lại khi lưu giữ lâu. Nến lọc cần thay định kỳ.
Áp dụng với xử lý nước cấp sinh hoạt quy mô nhỏ, lượng nước cần khử trùng ít
6.4.3 Khử trùng bằng clor
- Nguyên tắc: khi đưa clor hoặc muối clorid hoà vào nước, xảy ra phản ứng:
Cl2 + H2O → HCIO + HCl
Ca(OCI)2 + H2O → CaO + 2HCIO
HOCl khuếch tán qua lớp vỏ tế bào VSV, gây phản ứng với men tế bào, từ đó phá hủy quá trình trao đổi chất của tế bào VSV.
- Các yếu tố ảnh hưởng
+ Tốc độ khuếch tán của clor qua màng tế bào vi khuẩn.
+ Nồng độ chất khử trùng.
+ Thời gian tiếp xúc, nhiệt độ, pH (pH 6 là tối ưu vì thành phần HClO chiếm 99,5%), chủng loại vi khuẩn, tạp chất khác trong nước....
- Ưu nhược điểm và phạm vi sử dụng:
- Ưu điểm: có thể sử dụng nhiều dạng clor: clor lỏng, nước javen NaClO. Thời gian tác dụng ngắn. Hóa chất bảo quản dễ, giá thành thấp.
- Nhược điểm: phải kiểm soát hàm lượng trong nước để tránh nước có mùi. Hàm lượng clor trong nước cấp sau cùng là 0,05mg/l, nước thải là 0,5mg/l. Có thể dùng Than hoạt tính hấp thụ clor dư trong nước. Kiểm soát thành phần hữu cơ trong nước để tránh tạo thành hợp chất clor hữu cơ ảnh hưởng xấu tới môi trường.
Khử trùng bằng clor được áp dụng đối với xử lý nước cấp sinh hoạt và nước thải mọi quy mô.
6.4.4 Khử trùng bằng ozon
- Nguyên tắc: ozon là khí màu tím ít tan trong nước, mùi hắc và dễ nhận biết. Khi ozon tiếp xúc với nguồn nước nhanh chóng tham gia vào quá trình kết tụ các phân tử làm cho các tạp chất lơ lửng lắng xuống bể và đóng cặn. Độ hòa tan ozon lớn gấp 13 oxy nên phải đủ ozon để oxy hóa chất hữu cơ, VSV xong thì mới có tác dụng khử trùng. Khi vừa cho vào trong nước khả năng tiệt trùng của ozon là rất ít. Sau khi đã hòa tan đủ liều lượng, thời gian tiệt trùng xảy ra trong khoảng 3 - 8 giây. Khử trùng nước uống cần dùng 0,5 - 1,5 mg/l, lượng dư sau 5 phút 0,2 - 0,4 mg/l.
Điều chế ozon từ không khí hoặc khí oxy khô: không khí được lọc để loại bụi, hạ nhiệt độ 3°C (loại 90% độ ẩm) và qua cột hút ẩm CaCl2, nhôm oxid để loại hết nước. Không khí khô dẫn vào buồng phóng điện: điện cực xoay chiều với điện thế 3.000 - 20.000 V để tạo nguyên tử oxy. Một phần oxy sẽ được chuyển hóa thành ozon.
- Yếu tố ảnh hưởng: phải làm sạch không khí để tạo ozon và đặc điểm nguồn nước: nước ngầm cần 0,75 - 1 mg/l, nước mặt 1,0 - 3,0 mg/l.
- Ưu nhược điểm và phạm vi sử dụng
- Ưu điểm: ozon phân hủy rất nhanh và có khả năng oxy hóa mạnh hơn clor nên hoạt tính khử trùng cũng cao hơn. Hiệu quả về tốc độ và tác dụng ozon hơn clor 3000 lần. Sản phẩm oxy hóa triệt để nên loại bỏ màu, mùi, vị của nước. Không có sản phẩm phụ độc hại.
- Nhược điểm: ozon độc, phân hủy nhanh nên phải sản xuất tại nơi tiêu thụ. Giá thiết bị cao, tiêu thụ điện nhiều năng lượng tiêu hao 15 - 30 kWV/ kg ozon. Có khả năng ăn mòn vật liệu.
Phạm vi sử dụng: mọi nguồn nước đều có thể áp dụng nhưng cần cân nhắc yếu tố chi phí.
Một nguồn nước thải có thể được kết hợp nhiều biện pháp xử lý khác nhau để có chất lượng nước đầu ra thỏa mãn yêu cầu.
Bảng 4.8. Các phương pháp xử lý nước thải thường áp dụng
| Các bước xử lý | Các phương pháp xử lý | Mục tiêu xử lý |
| Xử lý sơ bộ | Hóa lý: tuyển nổi, đông tụ | Tách chất lơ lửng và tạo màu |
| Hóa học: oxy hóa, trung hòa | Trung hòa, khử độc | |
| Xử lý tập trung | Cơ học: song chắn rác, lắng, lọc | Chất rắn, cặn lơ lửng |
| Sinh học: hồ sinh học, lọc sinh học... | Chất hữu cơ hòa tan và lơ lửng | |
| Hóa học kết hợp sinh học | Kim loại nặng | |
| Khử trùng | Nguồn mang VSV gây bệnh | |
| Xử lý bùn: bể metan, sấy, lọc | Giảm lượng thải bùn | |
| Xử lý triệt để | Cơ học: lọc cát | Tách các chất lơ lửng |
| Sinh học: aeroten II, hồ sinh học II | Khử nitơ, phospho | |
| Oxy hóa khử | Khử hợp chất nitơ, phospho, lưu huỳnh,... |
6.5 Xử lý bùn cặn
Sau khi qua các thiết bị xử lý, dòng lỏng sẽ được tách lớp cặn. Đặc biệt đối với nước thải, lượng cặn rắn, bùn khá nhiều nên cần có biện pháp xử lý. Các yếu tố quyết định đến kỹ thuật xử lý bùn:
- Tính chất và số lượng bùn.
- Yêu cầu bùn ở nơi tiếp nhận.
- Điều kiện: diện tích đất xử lý, khí hậu thời tiết, đầu tư và chi phí quản lý.

7 Một số mô hình dây chuyền xử lý nước
7.1 Một số yêu cầu khi thiết kế hệ thống xử lý nước
- Các yêu cầu vệ sinh môi trường: bố trí hợp lý mặt bằng và giải quyết các vấn đề đặt ra. Vị trí cuối hướng gió, cuối dòng sông, khoảng cách an toàn với khu dân cư. Khoảng cách này phụ thuộc các kỹ thuật xử lý nước trong mô hình:
+ Lưu lượng nước nhỏ hơn 50.000 m3/ngày đêm, sử dụng phương pháp cơ học và sinh học thì khoảng cách tối thiểu 300 - 500 m.
+ Lưu lượng trên 50.000 m3/ngày đêm, sử dụng cánh đồng lọc thì khoảng cách tối thiểu là 1 km.
- Các yêu cầu về phương pháp xử lý
Các phương pháp được lựa chọn phải đáp ứng yêu cầu kỹ thuật, vệ sinh môi trường, kinh tế và được phê duyệt. Các thông số về tiêu chuẩn, mức độ xử lý, công suất, đặc điểm dòng lỏng, đặc điểm khí hậu địa chất địa phương góp phần đưa ra quyết định cuối cùng. Tổ hợp các thiết bị trong dây chuyền xử lý đảm bảo xây dựng, vận hành từng bước, có khả năng sửa chữa và mở rộng công suất xử lý nước.
7.2 Những nguyên nhân phá hủy chế độ làm việc của dây chuyền xử lý nước
- Công trình bị quá tải: lượng nước vào hệ thống xử lý tăng đột ngột hoặc chất lượng nước đầu vào thay đổi đáng kể.
- Sự cố bất ngờ: nguồn điện cung cấp bị ngắt, lũ lụt gây ngập lụt một phần hoặc toàn bộ dây chuyền xử lý.
- Không bảo dưỡng, bảo trì thiết bị đúng hạn.
- Vận hành sai sót, không đúng kỹ thuật.
7.3 Ví dụ mô hình xử lý nước
7.3.1 Xử lý nước tự nhiên phục vụ nước cấp sinh hoạt, sản xuất
- Đặc điểm nguồn nước cung cấp làm nước sinh hoạt, sản xuất như nước bề mặt (sông, suối) hoặc nước ngầm khác nhau sẽ quyết định lựa chọn các kỹ thuật xử lý nước khác nhau.
+ Nước bề mặt thường (sông, hồ) mang theo nhiều tạp chất, rêu tảo và vi khuẩn, lượng oxi hòa tan cao. Chất lượng nước mặt phụ thuộc thành phần khoáng hóa mà nguồn nước chảy qua.
+ Nước ngầm thường thành phần ổn định, có thể khai thác ở khu vực hẻo lánh. Nước ngầm được khai thác tập trung trong nhà máy hoặc hộ gia đình. Tuy nhiên, nguồn nước ngầm là nguồn khó tái tạo, thường có hàm lượng sắt và mangan hòa tan cao. Do đó, khi khai thác cần oxy hóa Fe2+ và Mn2+ hòa tan trong nước thành dạng tủa để dễ dàng loại bỏ bằng kỹ thuật lắng hoặc lọc.
- Mô hình xử lý làm nước sinh hoạt phổ biến như hình 4,12.
Nước ngầm được bơm từ giếng được làm thoáng cưỡng bức bằng giàn mưa cung cấp oxy trong không khí nhằm oxy hóa muối hoà tan trong nước như sắt, mangan. Sau đó nước được dẫn vào bể lọc hoặc bể lắng tách các tủa này. Tiến hành khử trùng rồi cung cấp qua hệ thống cấp nước sinh hoạt địa phương. Nếu hàm lượng sắt trong nước ngầm lớn hơn 10 mg/1 thì sau khi làm thoáng có thêm bước xử dụng hóa chất để tăng cường khả năng oxy hóa sắt, tạo kết tủa với sắt rồi mới chuyển sang thiết bị lọc.
a. Từ nước ngầm
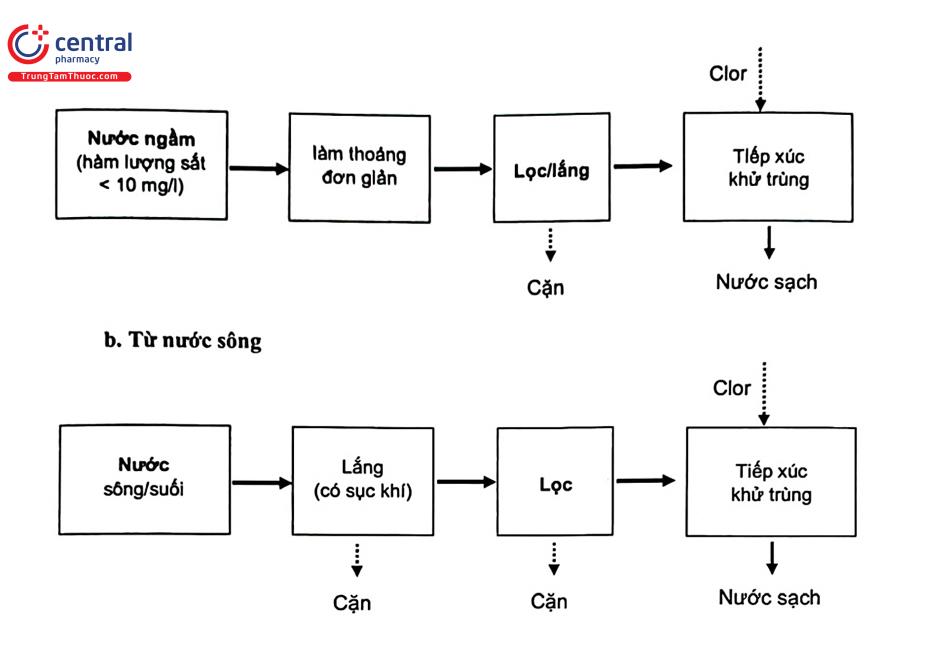
Nước sông được máy bơm cao áp hút đưa về bể lắng có sục khí để đẩy nhanh quá trình lắng đọng các tạp chất hữu cơ. Thiết bị lắng là khâu quan trọng trong quá trình, giúp loại bỏ các huyền phù hòa tan có kích thước lớn. Các bông cặn lắng xuống đáy bể lắng, còn nước tiếp tục được bơm qua bể lọc áp lực. Lớp lọc giữ lại các hạt cặn lơ lửng trong nước có kích thước lớn, các hạt keo sắt, keo hữu cơ có kích thước bé hơn nhiều lần kích thước các lỗ rỗng nhưng có khả năng dính kết và hấp thụ lên bề mặt lớp vật liệu lọc. Vật liệu lọc rất phong phú, được sử dùng kết hợp như:
+ Cát thạch anh (0,9 - 1,6 mm) kích cỡ đồng nhất có nhiều cạnh sắc nên dễ dàng giữ lại các tạp chất kết tủa ở quá trình oxi hóa nước.
+ Vật liệu lọc Filox: hạt chứa tới 98% MnO2 hoạt động như một chất oxi hóa bề mặt dùng để kết tủa sắt, mangan, arsen, tạo thành tủa bám vào bề mặt các hạt lọc và sẽ được thải ra ngoài bằng cơ chế rửa ngược. Hạt Filox loại được nhiều kim loại nặng nên được sử dụng rộng rãi.
+ Vật liệu lọc Mangan Greensand còn được gọi là cát mangan với kích thước hạt đồng đều nhiều cạnh sắc có khả năng liên kết tốt. Cát mangan hiệu quả trong việc loại bỏ kim loại nặng (đồng, kẽm, crom, niken), arsen, flor, đồng thời nâng và ổn định pH của nước trong khoảng 6,5 - 8,0; giảm hàm lượng hợp chất nitơ, phosphat và một số hợp chất hữu cơ, dầu có trong nước.
Cuối cùng nước bề mặt sau khi đã xử lý hóa lý được khử trùng rồi bơm vào hệ thống phân phối của thành phố.
7.3.2 Xử lý nước thải sản xuất
- Đặc điểm nguồn nước thải sản xuất phụ thuộc rất nhiều loại hình sản xuất, năng suất. Do đó nguồn nước thải sản xuất công nghiệp thường kết hợp nhiều kỹ thuật xử lý mới thỏa mãn yêu cầu xả thải.
- Một vài dây chuyền hệ thống xử lý nước thải sản xuất công nghiệp.
+ Dây chuyền xử lý nước thải nhà máy sản xuất thủy sản.
• Đặc điểm nguồn nước thải:
Nước thải chứa nhiều các chất hữu cơ có nguồn gốc từ động vật nên thành phần chủ yếu là protein và các chất béo. Các chất hữu cơ bị phân hủy sẽ làm giảm DO. Các chất rắn lơ lửng làm cho nước đục hoặc có màu gây ảnh hưởng tới quá trình quang hợp của tảo, rong rêu... Các chất dinh dưỡng N, P nồng độ cao gây ra hiện tượng phú dưỡng. Các VSV đặc biệt vi khuẩn gây bệnh và trứng giun sán trong nguồn nước gây ô nhiễm nặng nề, bệnh dịch như lỵ, thương hàn, bại liệt, nhiễm khuẩn đường tiết niệu, tiêu chảy cấp tính... Đặc trưng một dòng thải được trình bày ở bảng 4.9.
Bảng 4.9. Đặc trưng nước thải nhà máy chế biến thủy sản
| TT | Chỉ tiêu | Đơn vị | Giá trị | QCVN 11:2008, loại B |
| 1 | pH | 6 - 9,5 | 5,5 - 9 | |
| 2 | COD | mg/l | 3000-4000 | 80 |
| 3 | BOD5 | mg/l | 2000-3000 | 50 |
| 4 | TS | mg/l | 500-1500 | 100 |
| 5 | Dầu mỡ động vật | mg/l | 30-60 | 20 |
| 6 | Tổng N | mg/l | 120-160 | 60 |
| 7 | Tổng P | mg/l | 6-10 | - |
| 8 | Tổng coliform | MPN/100 ml | 109 | 5000 |
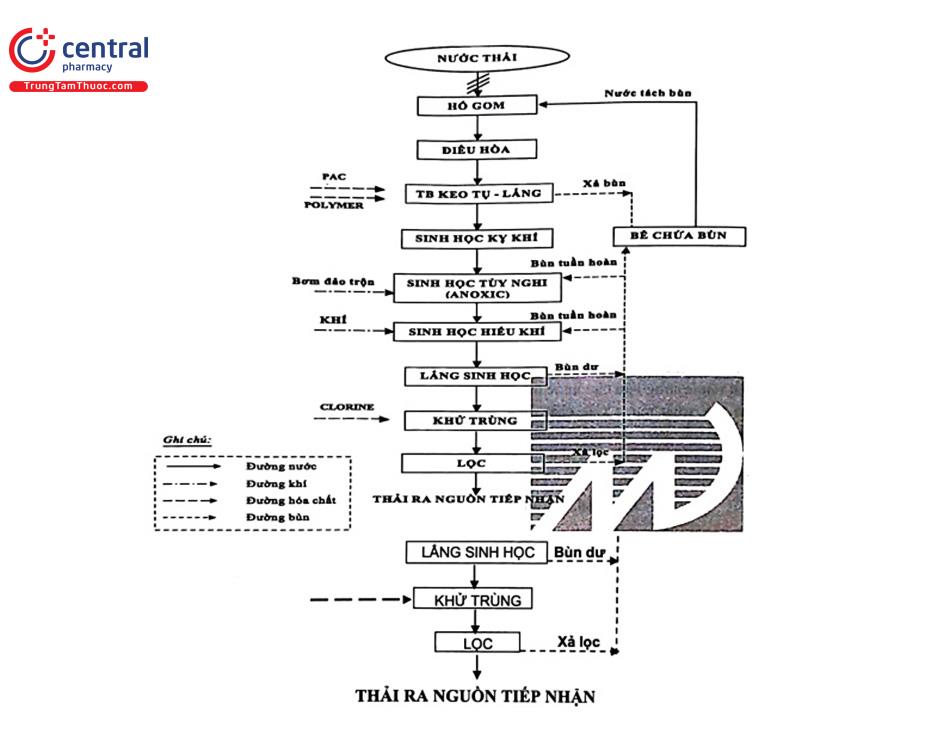
• Sơ đồ dây chuyền xử lý nước thải Công ty TNHH Vina Hưng với công suất 50 m3/ngày đêm hoạt động như hình 4.13.
Nguồn: Công ty môi trường sạch Saco
Nước thải từ các nguồn phát sinh công đoạn sơ chế, nước rửa thiết bị, rửa sàn... được thu gom dẫn qua song chắn rác giữ lại những thành phần rác thô, cặn lơ lửng có kích thước tương đối lớn. Sau khi tách rác, nước thải lẫn cát từ quá trình rửa sàn nhà xưởng và từ nguyên liệu chế biến chảy về bể gom. Sau khi lắng cát, nước thải sẽ được bơm tiếp qua bể điều hòa. Máy thổi khí sẽ cấp khí để ngăn hiện tượng lắng cặn ở bể sinh ra mùi khó chịu, đồng thời có chức năng điều hòa lưu lượng và nồng độ nước thải đầu vào. Nước thải tiếp tục được bơm đến bể keo tụ - lắng nhằm loại bỏ hàm lượng cặn lơ lửng kích thước nhỏ và các thành phần hữu cơ ở dạng keo. Phần nước trong chảy vào máng thu nước phía trên và được dẫn về bể sinh học yếm khí. Các VSV sẽ phân hủy các chất hữu cơ có trong nước thải thành các chất vô cơ ở dạng đơn giản và khí biogas:
Chất hữu cơ + VSV → CO2 + CH4 + H2S + Sinh khối mới + ...
Sau bể sinh học kỵ khí, nước thải được dẫn qua cụm bể anoxic (thiếu khí) và phân hủy hiếu khí (aerotank). Bể anoxic kết hợp aerotank được lựa chọn để xử lý tổng hợp: khử BOD, nitrat hóa, khử NH4+ và khử NO3- thành N2, khử phospho. Việc lựa chọn bể bùn hoạt tính xử lý kết hợp đan xen giữa quá trình xử lý thiếu khí, hiếu khí sẽ tận dụng được lượng carbon khi khử BOD, tiết kiệm được 50% lượng oxy khi nitrat hóa khử NH4+ do tận dụng được lượng oxy từ quá trình khử NO3- . Nước sau cụm bể này tự chảy vào bể lắng. Bùn được giữ lại ở đáy bể lắng. Một phần được tuần hoàn lại bể anoxic, một phần được đưa đến bể chứa bùn. Nước trong sau khi lắng tại bể lắng sinh học sẽ theo chế độ chảy tràn sang bể khử trùng tiêu diệt VSV có hại có trong nước thải, đồng thời oxy hóa các chất hữu cơ còn sót lại trong nước. Cuối cùng nước thải được bơm vào thiết bị lọc áp lực nhằm loại bỏ hàm lượng cặn còn sót lại mà quá trình lắng chưa thực hiện được.
Bùn rắn lắng từ bể lắng kỵ khí và thiết bị keo tụ lắng định kỳ sẽ được dẫn về bể phân hủy bùn. Nước sau khi tách bùn sẽ tuần hoàn trở lại bể gom để tiếp tục xử lý. Định kỳ bơm cát từ bể gom tách cát lên sân phơi cát rồi đổ bỏ theo chất thải rắn sinh hoạt trong công ty.
- Dây chuyền xử lý nước thải xí nghiệp dệt nhuộm
+ Đặc điểm nước thải xí nghiệp dệt nhuộm: sử dụng nhiều loại thuốc nhuộm như thuốc nhuộm hoạt tính, thuốc nhuộm trực tiếp, thuốc nhuộm hoàn nguyên, thuốc nhuộm phân tán, thuốc nhuộm Lưu Huỳnh, thuốc nhuộm acid, thuốc in, nhuộm pigmen. Một số đặc trưng của nguồn nước thải của một số nhà máy dệt nhuộm được thể hiện ở bảng 4.10.
Nước dùng trong nhà máy dệt phân bố như sau: sản xuất hơi nước 5,3%, làm mát thiết bị 6,4%, phun mù và khử bụi trong các phân xưởng 7,8%, nước dùng trong các công đoạn công nghệ 72,3%, nước vệ sinh và sinh hoạt 7,6%, phòng hỏa và cho các việc khác 0,6%.
Hầu như tất cả các công đoạn của quá trình nhuộm và hoàn tất đều phát sinh nước thải, thành phần nước thải thường không ổn định, thay đổi theo loại thiết bị nhuộm, nguyên liệu nhuộm, thuốc nhuộm. Nước thải dệt nhuộm thường có nhiệt độ, độ màu và COD cao, thường khó xử lý do cấu tạo phức tạp của thuốc nhuộm cũng như nhiều loại thuốc nhuộm và trợ nhuộm được sử dụng trong quá trình.
Bảng 4.10. Đặc trưng nguồn nước thải một số nhà máy dệt nhuộm
| Thông số | Đơn vị | Kết quả | ||
| Nước thải hoạt tính | Nước thải sulfid | Nước thải tẩy | ||
| pH | 10-11 | > 11 | > 12 | |
| Độ màu | Pt - Co | 7000 - 50000 | 10000 - 50000 | 500 - 2000 |
| COD | mg/l | 450 - 1500 | 10000 - 40000 | 9000 - 30000 |
| BOD | mg/l | 200 - 800 | 200 - 10000 | 4000 - 17000 |
| SS | mg/l | - | - | 120 - 1300 |
| Tổng N | mg/l | 5 -15 | 100 - 1000 | 200 - 1000 |
| Tổng P | mg/l | 0,7 -3 | 7 - 30 | 10 - 30 |
| Độ đục | FAU | 140 -1500 | 8000 - 200000 | 1000 - 5000 |
Nguồn: Phòng Quản lý Môi trường - Sở Khoa học Công nghệ Môi trường Tp.HCM
Nước dùng trong nhà máy dệt phân bố như sau: sản xuất hơi nước 5,3%, làm mát thiết bị 6,4%, phun mù và khử bụi trong các phân xưởng 7,8%, nước dùng trong các công đoạn công nghệ 72,3%, nước vệ sinh và sinh hoạt 7,6%, phòng hỏa và cho các việc khác 0,6%.
Hầu như tất cả các công đoạn của quá trình nhuộm và hoàn tất đều phát sinh nước thải, thành phần nước thải thường không ổn định, thay đổi theo loại thiết bị nhuộm, nguyên liệu nhuộm, thuốc nhuộm. Nước thải dệt nhuộm thường có nhiệt độ, độ màu và COD cao, thường khó xử lý do cấu tạo phức tạp của thuốc nhuộm cũng như nhiều loại thuốc nhuộm và trợ nhuộm được sử dụng trong quá trình.
+ Sơ đồ dây chuyền xử lý nước thải được thể hiện ở hình 4.14.
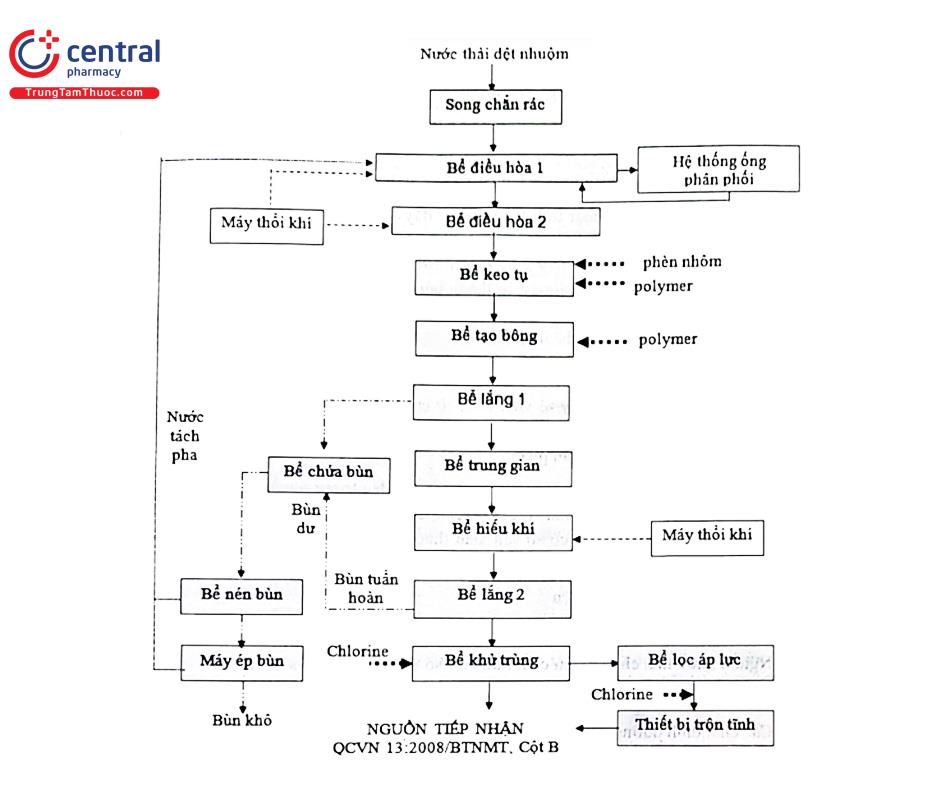
Song chắn rác: loại bỏ các chất rắn lơ lửng và chất rắn có kích thước lớn được thu gom về bể điều hòa 1.
Bể điều hoà 1: nước được bơm lên hệ thống ống phân phối kèm thổi cấp khí nhằm làm giảm nhiệt độ của nước thải, phối trộn nồng độ.
Bể điều hoà 2 ổn định nồng độ và lưu lượng lần nữa. Bể keo tụ tạo bông kết dính các chất bẩn trong nước ở dạng lơ lửng thành các bông cặn có khả năng lắng rồi để nước thải tự chảy qua bể lắng 1 nhằm tách các bông cặn. Nước thải được dẫn sang be trung gian nhằm ổn định lưu lượng rồi bơm tiếp.
Bể hiếu khí phân hủy các chất hữu cơ còn lại trong nước thải thành các chất vô cơ ở dạng đơn giản rồi dẫn sang bể lắng 2.
Chất hữu cơ + VSV hiểu khí → H2O + CO2 + sinh khối mới + ...
Tại bể lắng này, bùn hoạt tính lắng xuống đáy và được dẫn ra bể chứa bùn, còn nước thải ở phía trên mặt sẽ chảy tràn sang bể khử trùng với dung dịch Ca(OCl)2 xử lý triệt để E.coli, Coliform... Bùn đáy 2 bể lắng được bơm về bể chứa bùn và bể nén tiếp tục loại nước. Bùn được đưa vào máy ép thành bùn khô và nước. Bùn khô được thải bỏ như chất thải rắn công nghiệp, còn phần nước trên bề mặt bể chứa bùn, bề nén bùn, và sau khi ép bùn được dẫn trở lại bể điều hòa 1.
7.3.3 Xử lý nước thải trong lĩnh vực y tế
Nước thải trong lĩnh vực y tế xuất phát từ các cơ sở y tế như: bệnh viện, phòng khám tư nhân, cơ sở sản xuất dược phẩm, viện nghiên cứu, phòng thí nghiệm tổng hợp hóa dược, kiểm tra chất lượng sản phẩm.
Đặc điểm và lưu lượng các dòng thải phụ thuộc đặc trưng nguồn phát thải. Ví dụ nước thải từ bệnh viện chứa vi sinh vật gây bệnh, chứa nhiều chất hữu cơ phân hủy sinh học, chất tẩy rửa. Nước thải từ cơ sở sản xuất thuốc, đông dược chứa hợp chất hữu cơ, dung môi hữu cơ, cặn không tan từ dược liệu,...
- Nguồn nước thải bệnh viện
+ Đặc điểm nguồn nước thải bệnh viện (bảng 4.11)
Nguồn nước thải chứa nhiều chất hữu cơ khó và dễ phân hủy sinh học.
Chứa các VSV gây bệnh: bao gồm nhiều loại truyền nhiễm gây bệnh nguy hiểm.
Các chất dinh dưỡng giàu nitơ và phospho.
Các chất lơ lửng.
+ Dây chuyền hệ thống xử lý nước thải bệnh viện: nhìn chung, hệ thống xử lý nước thải các bệnh viện có nhiều điểm giống nhau: có xử lý sinh học và khử trùng do có nhiều thành phần hữu cơ và các yếu tố truyền nhiễm. Tuy nhiên, tùy theo lưu lượng, mức độ ô nhiễm mà có thể thêm xử lý hóa lý hoặc kết hợp nhiều thiết bị trong cùng nguyên tắc, ví dụ vừa xử lý sinh học hiếu khí và kỵ khí, thiết kế các thiết bị.
Bảng 4.11. Đặc điểm nước thải bệnh viện
| Thông số | Giá trị đo tại các bệnh viên | Sau xử lý TCVN 7382 - 2004 | |
| Nhiệt đới TP Hồ Chí Minh | Giao thông vận tải Đà Nẵng | ||
| Lưu lượng nước thải | 50 m3/ngày đêm | 50 m3/ngày đêm | |
| pH | 6,8 -7,5 | 6,0 - 8,5 | 6,5 - 8,5 |
| Tổng coliform (MPN/100 ml) | 106 | 104 - 108 | 5000 |
| BOD5 (mg/l) | 200 - 280 | 100 - 300 | 30 |
| COD (mg/l) | 300 - 350 | ||
| SS (mg/l) | 100 - 200 | 100 - 200 | 100 |
| NO3- (mg/l) | 40 - 60 | 30 | |
| PO43-(mg/l) | 8 -10 | 6 | |
Nguồn: Số liệu phân tích của Trung tâm KTMT Đà Nẵng, 2007 - 2009. Bệnh viện Nhiệt đới thành phố Hồ Chí Minh, 2007 - 2009.
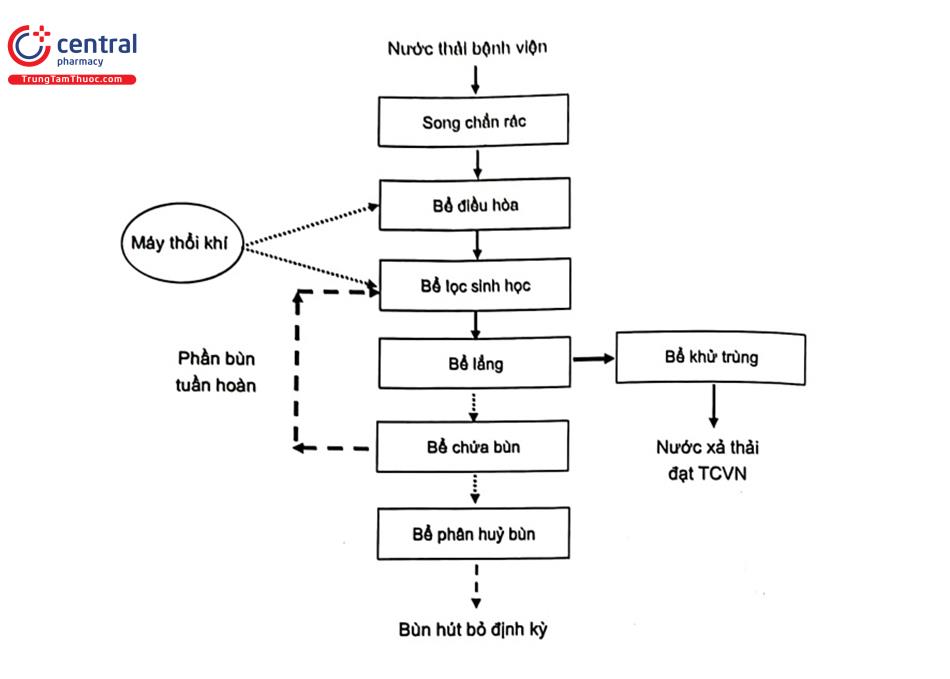
Hình 4.15 mô tả dây chuyền xử lý nước thải tại bệnh viện Nhiệt đới thành phố Hồ Chí Minh. Nước thải bệnh viện được tập trung, xử lý sơ bộ qua song chắn rác. Bể điều. hoà có tác dụng điều hoà lưu lượng, thành phần, pH của các dòng thải đổ vào. Nước được xử lý chính bằng phương pháp sinh học, phân hủy hiếu khí để phân hủy các chất hữu cơ, giảm hàm lượng SS, COD, BOD. Bùn được tách riêng để xử lý bùn cặn. Nước thải tiếp tục được khử trùng để loại bỏ các VSV gây bệnh, đảm bảo tiêu chuẩn xả thải.
- Nguồn nước thải xí nghiệp sản xuất dược phẩm.
Nước thải nhà máy sản xuất dược phẩm nói riêng hoặc các nhà máy sản xuất nói chung thường được đưa vào hệ thống xử lý riêng của cơ sở hoặc hệ thống xử lý tập trung của khu công nghiệp. Thông thường, hệ thống xử lý riêng phải có nước thải đầu ra đáp ứng tiêu chuẩn của từng quốc gia. Còn nếu nước thải được tập trung xử lý thì chỉ cần xử lý sơ bộ khi rời khỏi cơ sở sản xuất. Trong 4 bước sản xuất dược phẩm, 93% lượng nước thải phát sinh từ quá trình tổng hợp hóa học và lên men.
+ Quá trình tổng hợp hóa dược: sử dụng nhiều dung môi và lượng dung môi thu hồi để tái sử dụng lên tới 95%. Phần dung môi còn lại được thu gom và gộp với chất thải rắn mang đi thiêu đốt.
+ Lên men: tương tự như quá trình tổng hợp hóa dược, lượng dung môi thu hồi trong quá trình lên men cũng được xử lý bằng phương pháp đốt. Tại Mỹ, mỗi năm thu hồi khoảng 25.000 tấn dung môi cô đặc mang đi xử lý.
+ Chiết xuất: đối với quá trình chiết xuất từ dược liệu, ba loại dung môi phát sinh trong quá trình sản xuất thường được phân loại tại chỗ rồi mới đưa vào hệ thống xử lý:
Nước, dịch chiết cây, muối acid hữu cơ được xử lý trong hệ thống xử lý nước thải.
Dung môi hữu cơ chứa clor không tan trong nước. Sau khi tuần hoàn, sử dụng nhiều lần thì có thể thiêu đốt có kiểm soát hoặc xử lý trong hệ thống xử lý nước thải.
Dung môi hữu cơ không chứa clor được đưa vào hệ thống xử lý nước thải.
+ Bào chế: quá trình này sử dụng các dung môi thân dầu hoặc thân nước. Do dây chuyền công nghệ sản xuất hiện đại và khép kín nên thất thoát không đáng kể mà chủ yếu phát tán dưới dạng hơi. Tuy nhiên, vì lý do thân thiện môi trường nên ưu tiên sử dụng hợp hóa chất thân nước.
Ngoài ra, có thể phát sinh dòng thải lỏng từ sự cố rò rỉ, nước thải sinh hoạt trong cơ sở
+ Một ví dụ về đặc điểm nước thải Xí nghiệp Dược phẩm TW 25, thành phố Hồ Chi Minh và hệ thống xử lý được trình bày ở bảng 4.12.
Bảng 4.12. Thông số nước thải Xí nghiệp Dược phẩm TW 25
| Thông số | Giá trị |
| Lưu lượng nước thải | 12 m3/ngày đêm |
| pH | 5,1 -6,2 |
| BOD5 (mg/l) | 462 - 699 |
| COD (mg/l) | 853-1176 |
| SS (mg/l) | 144 - 193 |
| DS (mg/l) | 921-2384 |
| Tổng N (mg/l) | 6,7 -9,5 |
| Tổng P (mg/l) | 1,3-2,1 |
Nguồn: Viện Sinh học Nhiệt đới, 2006.
Khác với nước thải từ bệnh viện, nước thải từ xí nghiệp sản xuất dược phẩm có các đặc điểm tương tự nước thải từ khu vực sản xuất, tức là phụ thuộc vào ngành sản xuất, sản phẩm. Do đó, nước thải từ các xí nghiệp dược phẩm sản xuất mặt hàng khác nhau thì có thêm các đặc điểm riêng.
+ Mô hình dây chuyền hệ thống xử lý nước thải Xí nghiệp Dược phẩm TW 25 được biểu diễn ở hình 4.16. Trong dây chuyền này, nước thải từ phân xưởng B - lactam được phân loại riêng với các phân xưởng khác, xử lý sơ bộ cắt vòng B - lactam trước bằng các tác nhân oxy hóa để các thành phần trong nước thải dễ dàng tham gia quá trình xử lý tiếp theo. Sau đó toàn bộ nước thải trong xí nghiệp được tập trung đưa vào bể điều hòa nhằm điều hòa lưu lượng và pH với yêu cầu pH 6,5 - 7. Nước thải từ bể điều hòa được bơm vào hệ thống xử lý sinh học yếm khí và hiếu khí. Một phần bùn hoạt tính được tuần hoàn vào bể aerotank để giảm thời gian lên men (tức thời gian lưu) của nước thải trong bể này.
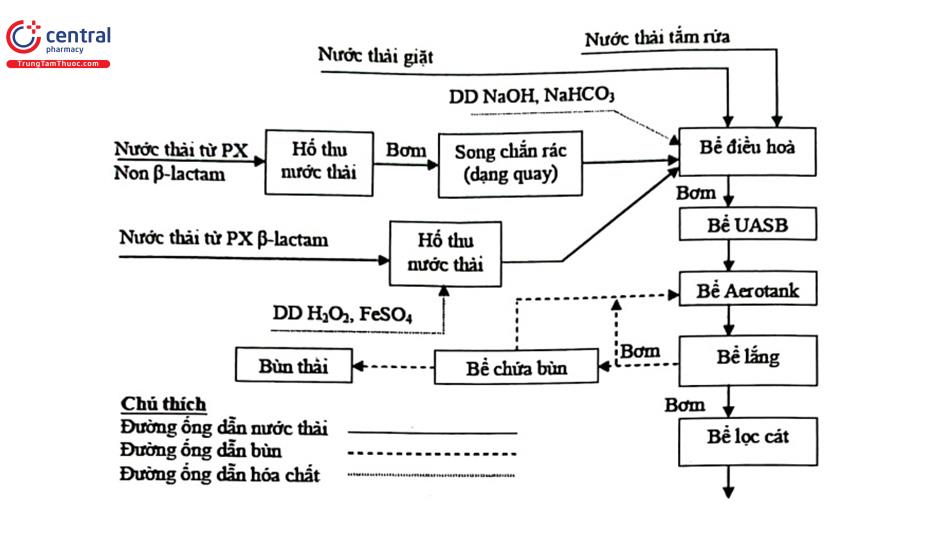
Nguồn: Xí nghiệp Dược phẩm TW 25, 2006.
8 Quản lý và sử dụng nguồn nước hiệu quả
Hiện tại, con người trên thế giới đang đối mặt với một số vấn đề liên quan đến nước như thiếu nước sạch hợp vệ sinh, thiếu nước sạch cung cấp cho một số địa phương. Năm 2050 ước tính thế giới sẽ có 10 tỷ dân. Lượng nước tiêu thụ bình quân đầu người mỗi năm sẽ giảm từ 6.600 m xuống mức báo động 1.700 m3/người. Tuy vậy, hiện vẫn còn 20% dân số thế giới chưa tiếp cận với nước sạch. Điều này càng gây ra mâu thuẫn giữa những người cùng sử dụng chung nguồn nước trong xã hội và giữa các quốc gia với nhau.
Sự ô nhiễm nước làm biến mất nhiều loài cá và động vật thủy sinh. Sử dụng nước bị ô nhiễm là nguyên nhân gây ra nhiều bệnh: tả, lỵ, thương hàn. Tại các nước đang phát triển, 80% các bệnh dịch hoành hành liên quan đến nước. Vì vậy các giải pháp nhằm quản lý, kiểm soát và sử dụng nguồn nước hiệu quả thực sự cấp bách trên phạm vi toàn cầu.
8.1 Quản lý số lượng nước
- Xây dựng hệ thống đập và bể chứa để lưu trữ và điều tiết dòng chảy theo thời gian và vị trí.
- Khai thác và sử dụng nước ngầm có kế hoạch và phù hợp nhu cầu, mục đích.
- Tăng cường khai thác và sử dụng nguồn nước biển và đại dương.
- Cung cấp và sử dụng nước hiệu quả hơn trong đời sống: giảm thất thoát trong tưới tiêu, áp dụng công nghệ tiên tiến như tưới nhỏ giọt, xử lý nước thải đô thị để tái sử dụng tưới tiêu.
8.2 Quản lý và giám sát chất lượng nước
Mục đích sử dụng khác nhau thì có tiêu chuẩn chất lượng khác nhau. Không đưa các tác nhân ô nhiễm vào khu vực khai thác nước và xử lý nước sau khi sử dụng.
- Xây dựng các trạm giám sát: nguồn gốc và đường đi của các chất ô nhiễm; giám sát các hoạt động khai thác nước cho các mục đích khác nhau.
- Đánh giá tác động của con người đối với chất lượng nước, mục đích sử dụng nước và xu hướng thay đổi chất lượng nước.
8.3 Quản lý, duy trì tính đa dạng sinh học và nguồn lợi sinh vật nước
- Tránh hoạt động khai thác quá mức: đánh bắt thủy sản, chọn giống và thuần hóa các loài phục vụ lợi ích con người... dẫn tới mất cân bằng sinh thái.
- Xây dựng ngân hàng gen, vườn quốc gia, khu vực dự trữ và bảo tồn thiên nhiên.
- Thiết lập bộ luật, chính sách ngăn ngừa những việc làm có hại và thúc đẩy quản lý tài nguyên nước một cách hữu hiệu.
8.4 Sử dụng nguồn nước hiệu quả
- Tuần hoàn, tái sử dụng.
- Xử lý nước thải đảm bảo tiêu chuẩn dòng xả.
- Phối hợp các mục đích sử dụng: nông nghiệp, thủy lợi, sản xuất điện năng.
9 Tài liệu tham khảo
1. Lê Huy Bá, 1997. Môi trường tập I. Nhà xuất bản Khoa học và Kỹ thuật, Hà Nội. 2. Đặng Đình Bạch, Nguyễn Văn Hải, 2006, Giáo trình Hóa học môi trường, Nhà xuất bản Khoa học kỹ thuật.
3. Lê Thạc Cán, 1995. Cơ sở khoa học môi trường. Viện Đại học Mở Hà Nội.
4. Lưu Đức Hải, 2001. Cơ sở khoa học môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội.
5. Lê Văn Khoa, 2002. Khoa học môi trường. Nhà xuất bản Giáo dục, Hà Nội. 6. Trần Thị Thanh, Trần Yêm, Đồng Kim Loan, 2004. Giáo trình công nghệ môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội
7. Lê Văn Thăng, 2007. Giáo trình Khoa học môi trường đại cương. Đại học Huế. 8. Quốc hội nước Cộng hòa Xã hội Chủ nghĩa Việt Nam, Luật Bảo vệ môi trường, Hà Nội 2014.
9. Lê Văn Khoa, Nguyễn Xuân Cự, Lê Đức, Trần Khắc Hiệp, Trần Cẩm Vân, 2000. Đất và môi trường. Nhà xuất bản Giáo dục.
10. Kerry J. Howe, David W. Hand, John C. Crittenden, Rhodes R. Trussell, George Tchobanoglous, 2012. Principles of Water Treatment, John Wiley & Sons, Inc, USA.
11. Mark Z. Jacobson, 2012. Air pollution and global warming: History, science, and solutions. 2nd ed. Cambridge University Press, USA.
12. Metcalf and Eddy, 2004. Wastewater Engineering Treatment, Disposal, Reuse, 4th ed. McGraw Hill Higher Education, USA
13. Ibrahim A. Mirsal, 2008. Soil pollution: Origin, monitoring and remediation, 2nd ed. Springer, Germany
14. John Pichtel, 2005. Waste management practices: municipal, hazardous, and industrial. CRC Press, Taylpr & Francis Group, USA.
15. Petter H. Raven; Linda R.Berg; David M. Hassenzahl, 2010. Environment, 7th ed. John Wiley & Sons, Inc., USA.
16. Daniel A. Vallero, 2014. Fundamentals of air pollution, 5th ed. Elsevier Inc, USA.
10 Phụ lục 1
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ CHẤT LƯỢNG KHÔNG KHÍ XUNG QUANH QCVN 05:2009/BTNMT
Bảng 1. Giá trị giới hạn các thông số cơ bản trong không khí xung quanh (Đơn vị: ug/m3)
| TT | Thông số | Trung bình 1 giờ | Trung bình 3 giờ | Trung bình 24 giờ | Trung bình năm |
| 1 | SO2 | 350 | - | 125 | 50 |
| 2 | CO | 30000 | 10000 | 5000 | - |
| 3 | NOx | 200 | - | 100 | 40 |
| 4 | O3 | 180 | 120 | 80 | - |
| 5 | Bụi lơ lửng (TSP) | 300 | - | 200 | 140 |
| 6 | Bụi ≤ 10 μm (PM10) | - | - | 150 | 50 |
| 7 | Pb | - | - | 1,5 | 0.5 |
| Ghi chú: dấu (-) là không quy định | |||||
11 Phụ lục 2
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHÍ THẢI CÔNG NGHIỆP ĐỐI VỚI BỤI VÀ CÁC CHẤT VÔ CƠ (QCVN 19:2009/BTNMT)
Bảng 2. Nồng độ C của bụi và các chất thải vô cơ làm cơ sở tính nồng độ tối đa cho phép trong khí thải công nghiệp (áp dụng kể từ ngày 1/1/2015)
| TT | Thông số | Nồng độ C (mg/Nm3) |
| 1 | Bụi tổng | 200 |
| 2 | Bụi chứa silic | 50 |
| 3 | Amoniac và các hợp chất amoni | 50 |
| 4 | Arsen và các hợp chất, tính theo As | 10 |
| 5 | Antimon và hợp chất, tính theo Sb | 10 |
| 6 | Cadmi và hợp chất, tính theo Cd | 5 |
| 7 | Chì và hợp chất, tính theo Pn | 5 |
| 8 | CO | 1000 |
| 9 | Clor | 10 |
| 10 | Đồng và hợp chất, tính theo Cu | 10 |
| 11 | Kẽm và hợp chất, tính theo Zn | 30 |
| 12 | HCl | 50 |
| 13 | Flor, HF hoặc các hợp chất vô cơ của flor, tính theo HF | 20 |
| 14 | H2S | 7,5 |
| 15 | SO2 | 500 |
| 16 | NOx, tính theo NO2 | 860 |
| 17 | NOx (cơ sở sản xuất hóa dầu), tính theo NO2 | 1000 |
| 18 | Hơi H2SO4 hoặc SO3, tính theo SO3 | 50 |
| 19 | Hơi HNO3 (các nguồn khác), tính theo NO2 | 500 |
12 Phụ lục 3
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ KHÍ THẢI LÒ ĐỐT CHẤT THẢI RẮN Y TẾ (QCVN 1002:2008/BTNMT)
Bảng 3. Giới hạn cho phép các thông số ô nhiễm trong khí thải lò đốt chất thải rắn y tế
| TT | Thông số | Giới hạn cho phép (mg/Nm3) |
| 1 | Bụi | 115 |
| 2 | HF | 2 |
| 3 | HCl | 100 |
| 4 | CO | 100 |
| 5 | NOx | 250 |
| 6 | SO2 | 300 |
| 7 | Hg | 0,55 |
| 8 | Cd | 0,16 |
| 9 | Pb | 1,2 |
| 10 | Tổng Dioxin/Furan (TEQ) | 2,3*10-6 |
13 Phụ lục 4
QUY CHUẨN KỸ THUẬT VIỆT NAM VỀ GIỚI HẠN CHO PHÉP CỦA MỘT SỐ KIM LOẠI NẶNG TRONG ĐẤT (QCVN 03-MT:2015/BTNMT)
Bảng 4. Giới hạn tối đa hàm lượng tổng số của một số kim loại nặng trong tầng đất mặt (Đơn vị: mg/kg đất khô)
| TT | Thông số | Đất nông nghiệp | Đất lâm nghiệp | Đất dân sinh | Đất công nghiệp | Đất thương mại, dịch vụ |
| 1 | Arsen (As) | 15 | 20 | 15 | 25 | 20 |
| 2 | Cadmi (Cd) | 1,5 | 3 | 2 | 10 | 5 |
| 3 | Chì (Pb) | 70 | 100 | 70 | 300 | 200 |
| 4 | Crom (Cr) | 150 | 200 | 200 | 250 | 250 |
| 5 | Đồng (Cu) | 100 | 150 | 100 | 300 | 200 |
| 6 | Kẽm (Zn) | 200 | 200 | 200 | 300 | 300 |
14 Phụ lục 5
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ NƯỚC THẢI CÔNG NGHIỆP (QCVN 40:2011/BTNMT)
Bảng 1. Giá trị C của các thông số ô nhiễm trong nước thải công nghiệp
| TT | Thông số | Đơn vị | Giá trị | |
| A | B | |||
| 1 | Nhiệt độ | oC | 40 | 40 |
| 2 | Màu | Pt/Co | 50 | 150 |
| 3 | pH | - | 6 đến 9 | 5,5 đến 9 |
| 4 | BOD5 (20 độ C) | mg/l | 30 | 50 |
| 5 | COD | mg/l | 75 | 150 |
| 6 | Chất rắn lơ lửng | mg/l | 50 | 100 |
| 7 | Asen | mg/l | 0,05 | 0,1 |
| 8 | Thủy ngân | mg/l | 0,005 | 0,01 |
| 9 | Chì | mg/l | 0,1 | 0,5 |
| 10 | Cadimi | mg/l | 0,05 | 0,1 |
| 11 | Crom (VI) | mg/l | 0,05 | 0,1 |
| 12 | Crom (III) | mg/l | 0,2 | 1 |
| 13 | Đồng | mg/l | 2 | 2 |
| 14 | Kẽm | mg/l | 3 | 3 |
| 15 | Niken | mg/l | 0,2 | 0,5 |
| 16 | Mangan | mg/l | 0,5 | 1 |
| 17 | Sắt | mg/l | 1 | 5 |
| 18 | Tổng xianua | mg/l | 0,07 | 0,1 |
| 19 | Tổng phenol | mg/l | 0,1 | 0,5 |
| 20 | Tổng dầu mỡ khoáng | mg/l | 5 | 10 |
| 21 | Sunfua | mg/l | 0,2 | 0,5 |
| 22 | Florua | mg/l | 5 | 10 |
| 23 | Amoni (Tính theo N) | mg/l | 5 | 10 |
| 24 | Tổng nitơ | mg/l | 20 | 40 |
| 25 | Tổng phốt pho (tính theo P) | mg/l | 4 | 6 |
| 26 | Clorua (không áp dụng khi xả vào nguồn nước mặn, nước lợ) | mg/l | 500 | 1000 |
| 27 | Clo dư | mg/l | 1 | 2 |
| 28 | Tổng hóa chất bảo vệ thực vật clo hữu cơ | mg/l | 0,05 | 0,1 |
| 29 | Tổng hóa chất bảo vệ thực vật phốt pho hữu cơ | mg/l | 0,3 | 1 |
| 30 | Tổng PCB | mg/l | 0,003 | 0,01 |
| 31 | Coliform | Vi khuẩn / 100ml | 3000 | 5000 |
| 32 | Tổng hoạt độ phóng xạ alpha | Bq/l | 0,1 | 0,1 |
| 33 | Tổng hoạt độ phóng xạ beta | Bq/l | 1,0 | 1,0 |
Cột A: quy định khi xả vào nguồn nước được dùng cho mục đích cấp nước sinh hoạt.
Cột B: quy định khi xả vào nguồn nước không dùng cho mục đích cấp nước sinh hoạt.
15 Phụ lục 6
QUY CHUẨN KỸ THUẬT QUỐC GIA VỀ NƯỚC THẢI Y TẾ (QCVN 28:2010/BTNMT)
Bảng 1. Giá trị C của các thông số ô nhiễm
| TT | Thông số | Đơn vị | Giá trị C: Các chất gây ô nhiễm | |
| A | B | |||
| 1 | pH | - | 6,5 - 8,5 | 6,5 - 8,5 |
| 2 | BOD5 (20°C) | mg/l | 30 | 50 |
| 3 | COD | mg/l | 50 | 100 |
| 4 | Tổng chất rắn lơ lửng (TSS) | mg/l | 50 | 100 |
| 5 | Sunfua (tính theo H2S) | mg/l | 1,0 | 4,0 |
| 6 | Amoni (tính theo N) | mg/l | 5 | 10 |
| 7 | Nitrat (tính theo N) | mg/l | 30 | 50 |
| 8 | Phosphat (tính theo P) | mg/l | 6 | 10 |
| 9 | Dầu mỡ động thực vật | mg/l | 10 | 20 |
| 10 | Tổng hoạt độ phóng xạ alpha | Bq/l | 0,1 | 0,1 |
| 11 | Tổng hoạt độ phóng xạ beta | Bq/l | 1,0 | 1,0 |
| 12 | Tổng coliforms | MPN/100 ml | 3000 | 5000 |
| 13 | Salmonella | Vi khuẩn/100 ml | KPH | KPH |
| 14 | Shigella | Vi khuẩn/100 ml | KPH | KPH |
| 15 | Vibrio cholerae | Vi khuẩn/100 ml | KPH | KPH |
- KPH không phát hiện.
- Thông số Tổng hoạt độ phóng xạ alpha và beta chỉ áp dụng đối với các cơ sở khám, chữa bệnh có sử dụng nguồn phóng xạ.
- Giá trị tối đa (Cmax) khi thải ra nguồn tiếp nhận được tính như sau:
Cmax = C x K với K là hệ số về quy mô và loại hình cơ sở y tế.
16 Tài liệu tham khảo
- Trần Nguyên Hà, Vũ Ngân Bình (2023), "Môi trường nước. Phụ lục”, Môi Trường. Nhà xuất bản Y học, trang 95 - 139, 142-147. Tải bản PDF tại đây.
- Lê Huy Bá, 1997. Môi trường tập I. Nhà xuất bản Khoa học và Kỹ thuật, Hà Nội.
- Đặng Đình Bạch, Nguyễn Văn Hải, 2006, Giáo trình Hóa học môi trường, Nhà xuất bản Khoa học kỹ thuật.
- Lê Thạc Cán, 1995. Cơ sở khoa học môi trường. Viện Đại học Mở Hà Nội.
- Lưu Đức Hải, 2001. Cơ sở khoa học môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội.
- Lê Văn Khoa, 2002. Khoa học môi trường. Nhà xuất bản Giáo dục, Hà Nội. 6. Trần Thị Thanh, Trần Yêm, Đồng Kim Loan, 2004. Giáo trình công nghệ môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội
- Trần Thị Thanh, Trần Yêm, Đồng Thị Kim Loan, 2004. Giáo trình công nghệ môi trường. Nhà xuất bản Đại học Quốc gia Hà Nội.
- Lê Văn Thăng, 2007. Giáo trình Khoa học môi trường đại cương. Đại học Huế.
- Quốc hội nước Cộng hòa Xã hội Chủ nghĩa Việt Nam, Luật Bảo vệ môi trường, Hà Nội 2014.
- Lê Văn Khoa, Nguyễn Xuân Cự, Lê Đức, Trần Khắc Hiệp, Trần Cẩm Vân, 2000. Đất và môi trường. Nhà xuất bản Giáo dục.
- Kerry J. Howe, David W. Hand, John C. Crittenden, Rhodes R. Trussell, George Tchobanoglous, 2012. Principles of Water Treatment, John Wiley & Sons, Inc, USA.
- Mark Z. Jacobson, 2012. Air pollution and global warming: History, science, and solutions. 2nd ed. Cambridge University Press, USA.
- Metcalf and Eddy, 2004. Wastewater Engineering Treatment, Disposal, Reuse, 4th ed. McGraw Hill Higher Education, USA
- Ibrahim A. Mirsal, 2008. Soil pollution: Origin, monitoring and remediation, 2nd ed. Springer, Germany
- John Pichtel, 2005. Waste management practices: municipal, hazardous, and industrial. CRC Press, Taylor & Francis Group, USA.
- Petter H. Raven; Linda R.Berg; David M. Hassenzahl, 2010. Environment, 7th ed. John Wiley & Sons, Inc., USA.
- Daniel A. Vallero, 2014. Fundamentals of air pollution, 5th ed. Elsevier Inc, USA.

