Kỹ thuật định danh vi khuẩn và kháng sinh đồ
Trường Đại Học Y Hà Nội - Bộ môn Khoa học xét nghiệm
Chủ biên PGS.TS.BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ
Các tác giả tham gia biên soạn
PGS. TS. BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ, TS. BS. Nguyễn Thúy Hương, TS. BS. Nguyễn Thị Thanh Hải
ThS. Đặng Quang Huy, Ths. BSNT. Nguyễn Quỳnh Giao, Ths. BSNT. Vũ Đức Anh, ThS. Trịnh Thị Phương Dung
Ths. BSNT. Lê Văn Toàn, Ths. BSNT. Ngô Diệu Hoa, BSNT. Phạm Thị Hương Trang, Ths. BSNT. Nguyễn Thị Thu Thảo
Ths. BS. Nguyễn Thị Hảo, CKI. Đỗ Thị Hường, CKI. Nguyễn Thúy Hà, ThS. Vũ Thị Bích Hồng
CN. Lê Thanh Thảo, CN. Nguyễn Hữu Hùng
Bệnh nhiễm trùng là một trong những bệnh phổ biến hiện nay, nó gặp ở mọi lứa tuổi và ảnh hưởng rất lớn đến sức khỏe. Có rất nhiều loại vi khuẩn ảnh hưởng đến con người, chúng có khả năng gây ra nhiều bệnh khác nhau và mỗi loại cần có cách điều trị riêng. Kỹ thuật định danh vi khuẩn và kháng sinh đồ nhằm mục đích xác định chính xác vi khuẩn đang gây hại cho cơ thể giúp bác sĩ đưa ra phương pháp chữa bệnh phù hợp, hạn chế sự kháng thuốc của vi khuẩn, đảm bảo sức khỏe cho người bệnh. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về kỹ thuật định danh vi khuẩn và kháng sinh đồ.
1 Quá trình phát triển của các phương pháp định danh vi khuẩn
Một số phương pháp định danh vi khuẩn từ cổ điển đến hiện đại đang được sử dụng. Phương pháp cổ điển nhất là phương pháp định danh dựa trên các tính chất cơ bản sinh vật-hoá học của vi sinh vật. Tuy nhiên, phương pháp này hiện nay chủ yếu dùng để minh họa lý thuyết cho sinh viên thực tập ở các trường đại học, chỉ còn 1 vài tính chất còn sử dụng trong lâm sàng như tính di động (thạch mềm) hay lên men đường (KIA hay Manitol). Phương pháp này dễ thao tác, rẻ tiền nhưng phụ thuộc vào chủ quan người đọc nên đôi khi kết quả thiếu chính xác. Dựa trên lý thuyết định danh, hệ thống định danh tự động sử dụng thẻ định danh như máy Vitek hay Phoenix được phát triển. Ngoài ra, có thể kết hợp phương pháp định danh bằng tuýp huyết thanh để xác định rõ một số căn nguyên. Hiện nay có thể sử dụng nhiều tuýp huyết thanh gây bệnh khác nhau bằng phản ứng ngưng kết với kháng thể đặc hiệu. Bên cạnh đó, phương pháp sinh học phân tử nhằm khuếch đại đoạn gene đặc trưng cho từng loại vi khuẩn (ví dụ gene mã hóa protein 16S ribosome) sau đó tiến hành giải trình tự đoạn gene đó cũng được áp dụng để định danh các loại sinh vật.
2 Các phương pháp định danh vi khuẩn
2.1 Phương pháp định danh dựa trên các tính chất cơ bản sinh vật – hóa học của vi sinh vật
2.1.1 Nguyên lý của phương pháp
Phần lớn các phòng thí nghiệm vi sinh lâm sàng vẫn dựa vào nuôi cấy để phát hiện hầu hết các tác nhân gây bệnh vi khuẩn từ các mẫu bệnh phẩm lâm sàng. Theo truyền thống, kỹ thuật nuôi cấy được thực hiện bằng cách sử dụng môi trường thạch đa năng (ví dụ như thạch máu) sẽ hỗ trợ sự phát triển của nhiều loại tác nhân gây bệnh. Mỗi loại khuẩn lạc được thu thập và sau đó xác định các tác nhân gây bệnh có thể xảy ra. Để phát hiện một số tác nhân gây bệnh, điều cần thiết là sử dụng các môi trường nuôi cấy cụ thể hơn. Ví dụ, dựa trên sự khác biệt trong hoạt động trao đổi chất của vi khuẩn mà có thể sử dụng hệ thống chỉ thị sinh hóa (ví dụ: sự kết hợp của đường (dinh dưỡng) cộng với chỉ thị pH (để phát hiện sự chuyển hóa của các chất) để chỉ ra khả năng có mặt của một chất cụ thể tác nhân gây bệnh. Môi trường nuôi cấy cũng có thể “chọn lọc” (bằng cách kết hợp các chất kháng sinh) để tăng khả năng phân lập một tác nhân gây bệnh mục tiêu cụ thể. Ví dụ, để phân lập Salmonella từ một mẫu phân có thể chứa hàng chục loài vi khuẩn khác nhau, điều cần thiết là sử dụng môi trường nuôi cấy vừa có tính chọn lọc (ví dụ bằng cách sử dụng các chất kháng sinh như cefsulodin và novobiocin) và phân biệt (bằng cách phát hiện hydro sulfua được tạo ra hoặc các enzym cụ thể - xem Bảng 1).
| Tác nhân gây bệnh | Enzyme đích để phát hiện |
| Vi khuẩn Gram dương | |
| Staphylococcus aureus (bao gồm chủng MRSA) | Phosphatase or α-glucosidase |
| Clostridium difficile | β-Glucosidase |
| Group B streptococcus | Phosphatase |
| Vi khuẩn Gram âm | |
| Salmonella species | C8-Esterase or α-galactosidase |
| Shigella species | β-Ribosidase |
| Escherichia coli | β-Glucuronidase or β- galactosidase |
| Pseudomonas aeruginosa | β-Alanyl aminopeptidase |
Sau khi phân lập, việc xác định cấp độ loài và chi được thực hiện, trong đó các bảng xét nghiệm chỉ thị sinh vật – hóa học được bán sẵn trên thị trường thường được sử dụng; bao gồm các loại đường để phát hiện quá trình acid hóa (thông qua quá trình oxy hóa hoặc lên men) bằng cách sử dụng chất chỉ thị pH. Việc cấy và đọc các bảng sinh hóa có thể được thực hiện thủ công bằng cách sử dụng các bộ công cụ thương mại như bộ chỉ số các loại giá đường. Hiện nay, việc kiểm tra được tự động hóa và có nhiều loại trang thiết bị thương mại có thể thực hiện việc cấy và đọc bảng sinh hóa tự động như các thiết bị của BD Phoenix hoặc Vitek 2. Đối với một số loài, các hệ thống tự động như vậy có thể nhận dạng vi khuẩn trong 2-3 giờ, cũng như thực hiện kiểm tra tính nhạy cảm kháng sinh tự động.
Ngoài ra, có thể sử dụng các môi trường sinh sắc tố để phân lập vi khuẩn. Do dễ sử dụng, chi phí tương đối thấp và yêu cầu chuyên môn tối thiểu, phương pháp xác định vi khuẩn thường được sử dụng trong các phòng thí nghiệm lâm sàng liên quan đến việc sử dụng môi trường sinh sắc tố. Các môi trường này yêu cầu nuôi cấy một lượng nhỏ các mẫu lâm sàng từ các vị trí nghi ngờ nhiễm trùng, sử dụng môi trường thạch hoặc môi trường nuôi cấy tối ưu với sự có mặt của chất tạo màu hoặc chất tạo fluor, được thủy phân và phát triển màu khi có mặt các enzym duy nhất được biểu hiện bởi vi khuẩn quan tâm. Các chất nền được thêm vào môi trường không có màu hoặc huỳnh quang, nhưng khi được tác động bởi các enzym đặc trưng cho vi khuẩn lây nhiễm nghi ngờ, chúng có thể bị thay đổi cấu trúc, dẫn đến giải phóng một chất đánh dấu có màu hoặc huỳnh quang, điều này giúp cho biết sự hiện diện của vi khuẩn trong mẫu đang cần phát hiện.
Việc áp dụng môi trường nuôi cấy sinh sắc tố là một nỗ lực để thực hiện phân lập và xác định các tác nhân gây bệnh cụ thể chỉ cần trong một bước cấy duy nhất. Môi trường như vậy kết hợp một hoặc nhiều cơ chất enzym tạo sắc tố nhắm mục tiêu vào các enzym vi khuẩn cụ thể, thường kết hợp với các chất kháng sinh chọn lọc để ức chế các loài không mong muốn được phân lập. Điều này cho phép chọn lọc các tác nhân gây bệnh với độ đặc hiệu cao và nhận dạng ngay lập tức chúng dựa trên màu sắc khuẩn lạc. Các chất nền sinh màu được sử dụng trong các môi trường như vậy thường nhắm đến đến các enzyme thủy phân của vi khuẩn - phổ biến nhất là glycosidase, chẳng hạn như β-galactosidase hoặc β-glucosidase. Sự phân cắt đường khỏi các chất nền này bởi một enzym vi khuẩn sẽ giải phóng một chất màu sáng, thường không hòa tan nhất, vẫn còn khu trú cao trên các khuẩn lạc vi khuẩn, do đó phân biệt các khuẩn lạc mục tiêu sở hữu enzyme với các khuẩn lạc không có enzyme.
.jpg)
Môi trường sinh sắc tố (chromID® CARBA) sử dụng sự kết hợp của các chất nền sinh màu để phát hiện Enterobacteriaceae sản sinh carbapenemase (CPE). Sau khoảng thời gian nuôi cấy, E. coli ở dạng khuẩn lạc màu đỏ (do hoạt động của B- glucuronidase/B-galactosidase) và K. pneumoniae ở dạng khuẩn lạc xanh lục-xanh lam (do hoạt động của B-glucosidase).
2.1.2 Ứng dụng của phương pháp
Trong thực tế, môi trường sinh sắc tố không hoàn toàn đặc hiệu và cần xác nhận thêm về danh tính loài, ví dụ: sử dụng MALDI-TOF MS. Tuy nhiên, môi trường sinh sắc tổ đã được sử dụng rộng rãi trong các phòng thí nghiệm lâm sàng góp phần làm giảm khối lượng công việc (vì chỉ những khuẩn lạc có màu mới yêu cầu xử lý) và có thể tăng cường khả năng phát hiện (vì các khuẩn lạc có màu dễ bị bỏ qua, đặc biệt khi một hỗn hợp phức tạp của các loài có mặt trong một mẫu).
Một nhược điểm lớn của môi trường sinh sắc tố là thời gian phát hiện, thường là sau 16-48 giờ, vì phụ thuộc vào quá trình nuôi cấy tạo ra đủ số khuẩn lạc vi khuẩn để phát triển màu sắc. Nhược điểm này có thể được giải quyết bằng cách sử dụng chất nền hoặc thuốc nhuộm có chứa fluor, do huỳnh quang dễ phát hiện hơn cảm nhận về màu sắc/sự hấp thụ ánh sáng, cho phép phát hiện các vi khuẩn trong vòng 2 giờ sau khi ủ bằng thiết bị đo nhạy cảm. Đây là một lĩnh vực tương đối mới chưa được phát triển trong vi sinh lâm sàng.
2.2 Phương pháp phân tích khối phổ (MALDI-TOF MS)
Kể từ năm 2010, việc xác định tác nhân gây bệnh (vi khuẩn) đã được cách mạng hóa bằng sự ra đời của MALDI-TOF MS. Và đây hiện là phương pháp được lựa chọn để xác định vi khuẩn trong hầu hết các phòng thí nghiệm lâm sàng tiên tiến.
2.2.1 Nguyên lý của phương pháp
Với phương pháp MALDI-TOF MS, mẫu được xử lý bằng chất nền, hấp thụ năng lượng từ tia laser, dẫn đến làm nóng nhanh, hóa hơi và ion hóa chất phân tích; các ion sau đó được tách ra dựa trên thời gian chúng đến được máy dò, vì tất cả các ion có cùng điện tích đều có động năng như nhau. Trong thực tế, phần lớn các phân tử của vi khuẩn mà MALDI-TOF MS quan sát được là protein ribosome, với khối lượng đặc trưng cho protein của các vi khuẩn cụ thể làm phát sinh phổ MS đặc trưng, các phổ đặc trưng này có thể được so sánh với cơ sở dữ liệu MS trực tuyến để xác định các chi và loài cụ thể. Việc xác định các loài phụ và chủng phụ thuộc vào sự sẵn có của cơ sở dữ liệu rộng rãi, trong khi việc sử dụng các tế bào nguyên vẹn đã dẫn đến cải thiện khả năng phân tích so với các phương pháp trước đó, đòi hỏi quá trình chiết xuất và phân tích protein phải được thực hiện trong các điều kiện tiêu chuẩn.
2.2.2 Hoạt động hệ thống trang thiết bị
Trong vi sinh vật học lâm sàng, có một số bước chuẩn bị cho định danh trên MALDI-TOF MS, đó là lấy một khuẩn lạc nguyên vẹn lên đĩa MALDI (có và không bổ sung dung dịch acid formic) và dung dịch tách chiết protein đã chuẩn bị. Xử lý khuẩn lạc trực tiếp trên đĩa MALDI là dễ dàng nhất, nhanh nhất và ít tốn kém nhất. Một khuẩn lạc được “chọn” từ đĩa nuôi cấy đưa đến “vị trí” trên đĩa MALDI-TOF – MS. Việc bổ sung dung dịch acid formic vào đĩa MALDI có thể được sử dụng để cải thiện chất lượng của phổ khối được tạo ra, điều này có thể đặc biệt hữu ích đối với một số loại sinh vật, chẳng hạn như nấm men. Sau khi làm khô, tấm đĩa được đặt trong buồng ion hóa của khối phổ (Hình 17.2).
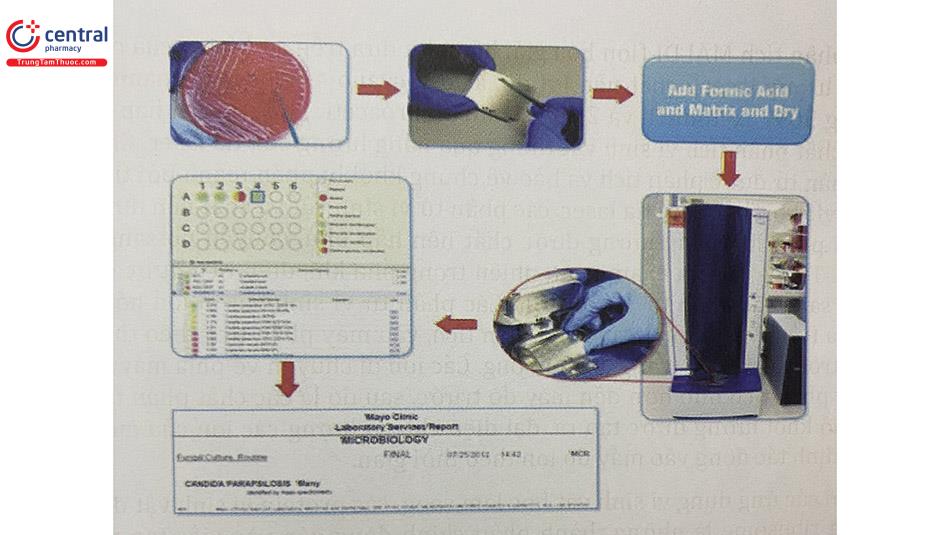
Sử dụng que Nhựa hoặc que gỗ, ăng cấy hoặc đầu pipet, khuẩn lạc được chọn từ đĩa nuôi cấy đến một điểm trên đĩa MALDI-TOF MS (đĩa có thể tái sử dụng hoặc dùng một lần với một số điểm thử nghiệm). Một hoặc nhiều chủng phân lập có thể được thử nghiệm tại một thời điểm. Trong ví dụ này, các tế bào được xử lý bằng acid formic trên đĩa đích. Mỗi chấm trên đĩa chứa vi khuẩn được phủ lên với 1-2 FL chất nền và được làm khô. Một tấm được đặt trong buồng ion hóa của khối phổ kế (Hình 2). Một phổ khối lượng được phần mềm tạo ra và so sánh với cơ sở dữ liệu về khối phổ, dẫn đến định danh vi sinh vật.
.jpg)
Trong phân tích MALDI (ion hóa giải hấp phụ dựa trên sự hỗ trợ của các chất nền và năng lượng laser), chất nền (ví dụ, acid a-cyano-4-hydroxycinnamic được hòa tan trong 50% axetonitril và 2,5% acid trifluoroacetic) hỗ trợ giải hấp phụ và ion hóa các chất phân tích vi sinh vật thông qua năng lượng của tia laser. Chất nền cô lập các phân tử được phân tích và bảo vệ chúng khỏi bị phân mảnh bởi tia laser. Kết quả của việc bị “bắn” bởi tia laser, các phân tử vi sinh vật và chất nền được khử hấp thụ, với phần lớn năng lượng được chất nền hấp phụ, chuyển nó sang trạng thái ion hóa. Thông qua va chạm ngẫu nhiên trong pha khí, điện tích được chuyển từ chất nền sang các phân tử vi sinh vật. Các phân tử vi sinh vật bị ion hóa được tăng tốc, dựa trên tỷ lệ khối lượng trên điện tích, vào máy phân tích theo thời gian thực (TOF) trong một ống trong chân không. Các ion di chuyển về phía máy dò ion, với các chất phân tích nhỏ hơn đến máy dò trước, sau đó là các chất phân tích lớn dần. Một phổ khối lượng được tạo ra, đại diện cho số lượng các ion của một khối lượng nhất định tác động vào máy dò ion theo thời gian.
Đối với các ứng dụng vi sinh vật học lâm sàng, các protein vi sinh vật đa dạng như protein ribosome là những thành phần chính đóng góp vào việc tạo ra khối phổ, mặc dù các protein không được xác định cụ thể bằng khối lượng và sự đa dạng của chúng chỉ đơn thuần là được mã hóa. Nói chung, khối phổ là duy nhất cho từng loại sinh vật riêng lẻ, với các đỉnh đặc trưng cho các chi, loài vi sinh vật. Khối phổ của chất phân lập thử nghiệm được so sánh với cơ sở dữ liệu về khối phổ chuẩn để xác định mức độ liên quan đến phổ trong cơ sở dữ liệu; các sinh vật có quan hệ họ hàng gần nhất được xác định với một giá trị được cung cấp về mức độ tin cậy trong định danh. Tùy thuộc vào giá trị cao như thế nào, sinh vật có thể được xác định ở cấp họ, chi hoặc loài. Một loạt các thuật toán được sử dụng để so sánh cơ sở dữ liệu. Ví dụ, hệ thống Biotyper sử dụng nhận dạng mẫu và tạo ra điểm số từ 0 đến 3.000 tín hiệu phổ khối (đỉnh) của các chủng vi sinh vật phù hợp trên cơ sở dữ liệu. Theo tiêu chí của nhà sản xuất đưa ra cho ứng dụng RUO: điểm ≥ 2.000 thể hiện cấp độ loài, điểm số 1.700–1.999 ở cấp độ chi và điểm số ≤ 1.700 không xác định được. Tuy nhiên, những người sử dụng thiết bị đã nhận thấy rằng các ngưỡng điểm thấp hơn có thể đủ để xác định các nhóm sinh vật nhất định; Do vậy, cần xác minh rộng rãi bởi người dùng cuối trước khi áp dụng phương pháp này. Đối với Hệ thống MALDI Biotyper CA, điểm ≤ 1,999 thể hiện không định danh được. Trong khi đó, trên cơ sở dữ liệu hệ thống VITEK MS RUO được tìm kiếm bằng 1 trong 2 thuật toán. Một là quy trình so sánh mẫu, được gọi là phương pháp tiếp cận phổ tham chiếu. Hai là, các nhóm khối phổ được tập hợp lại với nhau dưới dạng “SuperSpectra”, đại diện cho phổ của các tín hiệu thu được từ nhiều chủng riêng lẻ của một nhóm sinh vật cụ thể, với các tín hiệu đó được tính trọng số theo đặc tính của chúng đối với loài, chi và/hoặc họ. Kết quả đầu ra có giá trị tin cậy, nằm trong khoảng từ 0% đến 100%. Với hệ thống VITEK MS, không trực tiếp phân tích dựa trên nhận dạng mẫu so sánh khối phổ. Các khối phổ của các chủng riêng lẻ được sắp xếp một cách tính toán thành các nhóm có trọng số tạo ra "Bộ phân loại phổ nâng cao".
Một số hạn chế đối với việc sử dụng MALDI-TOF MS, như không có khả năng phân biệt các vi khuẩn liên quan đến phân loại, ví dụ loài Shigella có khả năng gây bệnh cao từ E. coli cùng loại và không có khả năng phân biệt Streptococcus pneumoniae với một số loài liên cầu khuẩn ở miệng. Hiện nay, MALDI-TOF MS được sử dụng chủ yếu với các phương pháp nuôi cấy để xác nhận việc xác định vi khuẩn đã được khuếch đại bằng nuôi cấy chọn lọc. Kỹ thuật MALDI-TOF MS rất nhanh và cho phép xác định cấp độ loài trong vòng vài phút chứ không phải vài giờ. Mặc dù kinh phí đầu tư cao để có được thiết bị này nhưng không thể phủ nhận công suất của phương pháp này rất lớn (ví dụ: ít nhất 100 chủng mỗi ngày).
2.3 Các phương pháp chẩn đoán phân tử để phát hiện vi khuẩn
Phương pháp chẩn đoán phân tử dựa vào việc phân tích các dấu hiệu bộ gen tương ứng với trình tự acid nucleic. Sự phân loại và phát sinh loài của vi khuẩn dựa trên trình tự của các gen được bảo tồn, đặc biệt là những gen mã hóa cho các acid ribonucleic của ribosome (rRNA). Vì chúng có mặt ở khắp nơi và bao gồm các phần có tỷ lệ đột biến khác nhau (một số được bảo tồn cao, một số khác rất thay đổi). Các thông tin để định danh loài thường được thu thập nhiều nhất thông qua đặc điểm rRNA, khuếch đại gen và đặc điểm của amplicon, hoặc giải trình tự trực tiếp của các gen ribosome.
Kỹ thuật lai phân tử: Phát hiện dựa trên kỹ thuật lai phân tử để phát hiện sự hiện diện hoặc vắng mặt của các gen quan tâm. Các đầu dò là các đoạn DNA tổng hợp sợi đơn hoặc sợi đôi được đánh dấu bằng thuốc nhuộm huỳnh quang (ví dụ Cy3 9 hoặc FITC 10), do tính chất ghép cặp bổ sung của chúng với acid nucleic đích, để thực hiện phép lai. Do đó, tín hiệu huỳnh quang cho biết sự có mặt của chất phân tích. Ví dụ, lai huỳnh quang tại chỗ (FISH), sử dụng đầu dò phổ quát vi khuẩn và nấm men, đã có thể xác định 96,5% vi sinh vật hiện diện trong 115 trường hợp vi khuẩn huyết ở cấp độ họ, chi hoặc loài trong vòng 2,5 giờ. Mặc dù cần phải kết hợp với quan sát mẫu vi khuẩn bằng kính hiển vi và số lượng vi khuẩn có giới hạn phát hiện là 103 CFU trên mỗi mL máu, nhưng tiết kiệm được thời gian so với các phương pháp thông thường và có thể cứu sống được nhiều bệnh nhân trong các trường hợp nhiễm trùng huyết. Cách tiếp cận này đã được cải tiến bằng cách sử dụng phương pháp lai huỳnh quang acid nucleic peptid (PNA-FISH, AdvanDx) để xác định vi khuẩn Gram dương và Gram âm, cũng như các loài Candida trong cấy máu. Bằng cách nhắm vào khoảng 10 nhóm phổ biến nhất các tác nhân gây bệnh được báo cáo liên quan đến nhiễm trùng đường máu tại bệnh viện, độ chính xác của phương pháp này được chứng minh là 100% đối với vi khuẩn và 91% đối với nấm men trong các mẫu có ít nhất 105 CFU/mL.
Phương pháp khuếch đại: phương pháp khuếch đại để tăng cường tín hiệu phát hiện được thiết kế cho các mẫu bệnh phẩm gồm nhiều tế bào từ các vi khuẩn khác nhau, cùng với số lượng vi khuẩn cần quan tâm thấp. Phương pháp này cho phép nhắm vào các trình tự không phải là acid nucleic của ribosom, thường cần thiết khi tìm kiếm độc lực hoặc cơ chế kháng thuốc cụ thể. Một trong số các kỹ thuật khuếch đại này được phát triển để phát hiện Salmonella trong thực phẩm, được so sánh bằng cách nhắm mục tiêu vào gen invA hoặc ARN thông tin tương ứng của nó, vì chúng mã hóa cho một yếu tố độc lực thiết yếu của Salmonella. Định lượng phản ứng chuỗi polymerase theo thời gian thực (qPCR) và PCR thời gian thực của enzyme sao chép ngược (RT-qPCR) đều là phương pháp in vitro dựa trên các bước điều nhiệt chính xác để biến tính và polyme hóa acid nucleic với các mồi oligonucleotide được bổ sung cụ thể và thường được đánh dấu để tạo thành các DNA sợi kép tương tự mới, sau đó cung cấp các mục tiêu mới cho chu kỳ tiếp theo. Bằng cách đo những thay đổi trong tín hiệu huỳnh quang từ khi bắt đầu quá trình phản ứng dây chuyền, qPCR cho phép giảm thiểu việc xử lý mẫu trước và sau khi khuếch đại, do đó giảm nguy cơ nhiễm bẩn và thời gian cần thiết. Hơn nữa, ưu điểm chính của RT-qPCR là khả năng phân biệt và chỉ đo lường các sinh vật còn sống.
Một phương pháp khác là phương pháp khuếch đại đẳng nhiệt qua trung gian vòng (LAMP) có một số ưu điểm bổ sung so với kỹ thuật PCR, bao gồm quy trình khuếch đại nhiệt độ vừa phải, do đó cho phép thiết bị đơn giản và hiệu quả về chi phí. Độ đặc hiệu cao đạt được trong quá trình khuếch đại bước đơn nhanh chóng và mạnh mẽ (tránh biến tính ở nhiệt độ cao), cung cấp khả năng phát hiện trực tiếp DNA ở 60–65° C trong vòng 15–60 phút từ các mẫu gần như thô bằng cách sử dụng 4 mồi và hoạt động dịch chuyển sợi của DNA polymerase.
3 Tài liệu tham khảo
1. Barbara H.Estridge & Anna P.Reynolds. (2008). Basic clinical laboratory technique.
2. James H. Jorgensen & Michael A. Pfaller. (2015). Manual of clinical microbiology.
3. PGS. TS. BS. Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ (2023). “Kỹ thuật định danh vi khuẩn và kháng sinh đồ”. Kỹ thuật và thiết bị xét nghiệm y học. Nhà xuất bản y học, trang 315-322. Tải bản pdf tại đây.

