Ilaris 150mg/ml
Thuốc kê đơn
| Thương hiệu | Công ty Novartis |
| Công ty đăng ký | Novartis International AG |
| Dạng bào chế | Bột pha tiêm |
| Quy cách đóng gói | Hộp 01 lọ bột pha tiêm |
| Hạn sử dụng | 3 năm kể từ |
| Hoạt chất | Canakinumab |
| Tá dược | Polysorbate 80 (Tween 80) |
| Xuất xứ | Thụy Sĩ |
| Mã sản phẩm | at290 |
| Chuyên mục | Thuốc Điều Trị Gút |
- Chi tiết sản phẩm
- Hỏi & Đáp 0
- Đánh giá 0
Thuốc Ilaris (Canakinumab) 150mg/ml được sử dụng trong điều trị các hội chứng sốt định kỳ tự viêm, bệnh Still và gout. Vậy, thuốc có liều dùng như thế nào? Cần những lưu ý gì khi sử dụng? Hãy cùng Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) tìm hiểu những thông tin về thuốc Ilaris 150mg/ml trong bài viết sau đây.
1 Ilaris (Canakinumab) được phê duyệt trong điều trị bệnh gout
Ngày 30 tháng 8 vừa qua, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt Canakinumab (Ilaris) để điều trị các đợt gout cấp ở người lớn không thể điều trị bằng NSAID, Colchicine (Colcrys) hoặc các đợt điều trị lặp lại bằng Corticosteroid. Thuốc cũng được chỉ định cho những người không thể dung nạp hoặc có phản ứng không đầy đủ với NSAID hoặc Colchicine [1].

Theo Novartis - nhà sản xuất Canakinumab (Ilaris), loại thuốc này là một kháng thể đơn dòng kháng interleukin-1β được nhân bản hóa, là loại thuốc sinh học đầu tiên và duy nhất được phê duyệt ở Hoa Kỳ để điều trị các đợt bùng phát bệnh gút. Nó được dùng dưới dạng tiêm dưới da một liều duy nhất 150 mg.
Canakinumab lần đầu tiên được phê duyệt ở Mỹ vào năm 2009 để điều trị cho trẻ em và người lớn mắc hội chứng chu kỳ liên quan đến cryopyrin (CAPS - Cryopyrin-associated periodic syndrome). Kể từ đó, nó đã được phê duyệt để điều trị một số bệnh tự viêm khác, bao gồm bệnh Still và hội chứng sốt tái phát.
Vào năm 2011, một hội đồng tư vấn của FDA đã bỏ phiếu chống lại việc phê duyệt Canakinumab (Ilaris) để điều trị các đợt bùng phát bệnh gout cấp tính không thể điều trị bằng NSAID, Colchicine hoặc các đợt điều trị lặp lại bằng Corticosteroid, trong khi vào năm 2013, Cơ quan Y tế Châu u đã phê duyệt loại thuốc này cho chỉ định điều trị này.
Kể từ cuộc họp ủy ban cố vấn của FDA và thư từ chối sau đó của FDA, Công ty Novartis đã tiến hành các nghiên cứu bổ sung ở những bệnh nhân bị bệnh gout bùng phát và các nhóm đối tượng liên quan khác để mô tả thêm về sự an toàn ngắn hạn và dài hạn của Canakinumab (Ilaris) để hỗ trợ cho đơn xin phê duyệt hiện tại. Trung tâm Nghiên cứu và Đánh giá Thuốc của FDA cho biết trong một tuyên bố với Medscape: "Dựa trên những cân nhắc này và thông tin an toàn sẵn có, Cơ quan đã xác định rằng Canakinumab, với liều lượng khuyến cáo, có hồ sơ lợi ích - nguy cơ tốt ở nhóm bệnh nhân được chỉ định.
2 Thành phần
Thành phần trong mỗi lọ bột pha tiêm thuốc Ilaris chứa:
- 180 mg Canakinumab
- Tá dược: Manitol, L - Histidine hydrochloride monohydrate, Tween 80
Dạng bào chế: Bột pha tiêm.
3 Tác dụng - Chỉ định của thuốc Ilaris 150 mg/ml
3.1 Tác dụng của thuốc Ilaris 150 mg/ml
3.1.1 Dược lực học
3.1.1.1 Cơ chế hoạt động
Ilaris(Canakinumab) là kháng thể đơn dòng kháng interleukin-1 beta (IL-1 beta) ở người. Hoạt chất này liên kết với ái lực cao đặc biệt với IL-1 beta ở người và vô hiệu hóa hoạt động sinh học của IL-1 beta bằng cách ngăn chặn sự tương tác của nó với các thụ thể IL-1, do đó ngăn chặn sự kích hoạt gen do IL-1 beta gây ra và sản xuất các chất trung gian gây viêm [2] [3].
3.1.1.2 Tác dụng dược lực học
- Đối với các bệnh CAPS, TRAPS, HIDS/MKD và FMF
Trong các nghiên cứu lâm sàng, những bệnh nhân CAPS, TRAPS, HIDS/MKD và FMF sản xuất quá mức IL-1 beta không kiểm soát được cho thấy đáp ứng nhanh chóng và bền vững với liệu pháp Ilaris(Canakinumab), tức là các thông số xét nghiệm như protein phản ứng C (CRP) và amyloid huyết thanh A (SAA), số lượng bạch cầu trung tính và tiểu cầu, bạch cầu nhanh chóng trở lại bình thường.
- Bệnh Still (SJIA và AOSD)
Bệnh Still khởi phát ở người trưởng thành và bệnh viêm khớp vô căn toàn thân ở trẻ vị thành niên là những bệnh tự viêm nghiêm trọng, được thúc đẩy bởi khả năng miễn dịch bẩm sinh thông qua các cytokine gây viêm, một trong số đó là IL-1-beta.
Các đặc điểm chung của (SJIA và AOSD) bao gồm sốt, phát ban, gan lách to, bệnh hạch, viêm đa thanh mạc và viêm khớp. Điều trị bằng Ilaris(Canakinumab) giúp cải thiện nhanh chóng và bền vững cả đặc điểm khớp và hệ thống của SJIA với việc giảm đáng kể số lượng khớp bị viêm, hạ sốt kịp thời và giảm các chất phản ứng giai đoạn cấp tính ở phần lớn bệnh nhân.
- Viêm khớp do gout
Một cơn viêm khớp do gout gây ra bởi các tinh thể urat (monosodium urate monohydrate) trong khớp và mô xung quanh, kích hoạt các đại thực bào thường trú sản xuất IL-1 beta thông qua phức hợp “NALP3 inflammasome”. Kích hoạt đại thực bào và đồng thời sản xuất quá mức IL-1 beta dẫn đến phản ứng viêm đau cấp tính. Sau khi điều trị bằng Ilaris(Canakinumab), các dấu hiệu viêm CRP hoặc SAA và các dấu hiệu viêm cấp tính (ví dụ như đau, sưng, đỏ) ở khớp bị ảnh hưởng giảm nhanh chóng.
3.1.2 Dược động học
Hấp thu
Nồng độ Ilaris(Canakinumab) trong huyết thanh cao nhất (Cmax) đạt được khoảng 7 ngày sau khi tiêm dưới da liều duy nhất 150mg.
Sinh khả dụng của Ilaris(Canakinumab) tiêm dưới da được ước tính là 70%. Thời gian bán thải khoảng 26 ngày.
Phân bố
Canakinumab liên kết với IL-1 beta huyết thanh. Thể tích phân bố (Vd ) của Ilaris(Canakinumab) thay đổi tùy theo trọng lượng cơ thể. Nó được ước tính là 6,2 lít ở một bệnh nhân CAPS có trọng lượng cơ thể 70 kg.
Chuyển hóa và thải trừ
Con đường chuyển hóa và thải trừ Ilaris(Canakinumab) vẫn chưa được xác định.
3.2 Chỉ định của thuốc Ilaris 150 mg/ml
3.2.1 Hội chứng sốt định kỳ
Ilaris(Canakinumab) được chỉ định để điều trị các hội chứng sốt định kỳ tự viêm sau đây ở người lớn, thanh thiếu niên và trẻ em từ 2 tuổi trở lên:
Hội chứng định kỳ liên quan đến Cryopyrin (CAPS), bao gồm:
- Hội chứng Muckle-Wells (MWS),
- Bệnh viêm đa hệ khởi phát ở trẻ sơ sinh (NOMID) / hội chứng thần kinh, da, khớp mãn tính ở trẻ sơ sinh (CINCA),
- Các dạng nặng của hội chứng tự viêm do cảm lạnh gia đình (FCAS)/mề đay do lạnh gia đình (FCU) biểu hiện với các dấu hiệu và triệu chứng ngoài phát ban nổi mề đay do cảm lạnh.
Hội chứng định kỳ liên quan đến thụ thể yếu tố hoại tử khối u (TRAPS)
Hội chứng Hyperimmunoglobulin D (HIDS)/thiếu hụt mevalonate kinase (MKD)
Sốt Địa Trung Hải gia đình (FMF)
3.2.2 Bệnh Still
Điều trị bệnh Still đang hoạt động bao gồm bệnh Still khởi phát ở người trưởng thành (AOSD) và bệnh viêm khớp tự phát ở trẻ vị thành niên (SJIA) ở những bệnh nhân từ 2 tuổi trở lên không đáp ứng đầy đủ với liệu pháp trước đó bằng thuốc chống viêm không steroid ( NSAID) và corticosteroid toàn thân.
3.2.3 Bệnh gout
Điều trị triệu chứng cho bệnh nhân trưởng thành bị các cơn viêm khớp do gút thường xuyên (ít nhất 3 cơn trong 12 tháng trước) ở những người không thể điều trị bằng NSAID, Colchicine (Colcrys) hoặc các đợt điều trị lặp lại bằng Corticosteroid.
4 Cách dùng - Liều dùng của thuốc Ilaris 150 mg/ml
4.1 Liều dùng của thuốc Ilaris 150 mg/ml
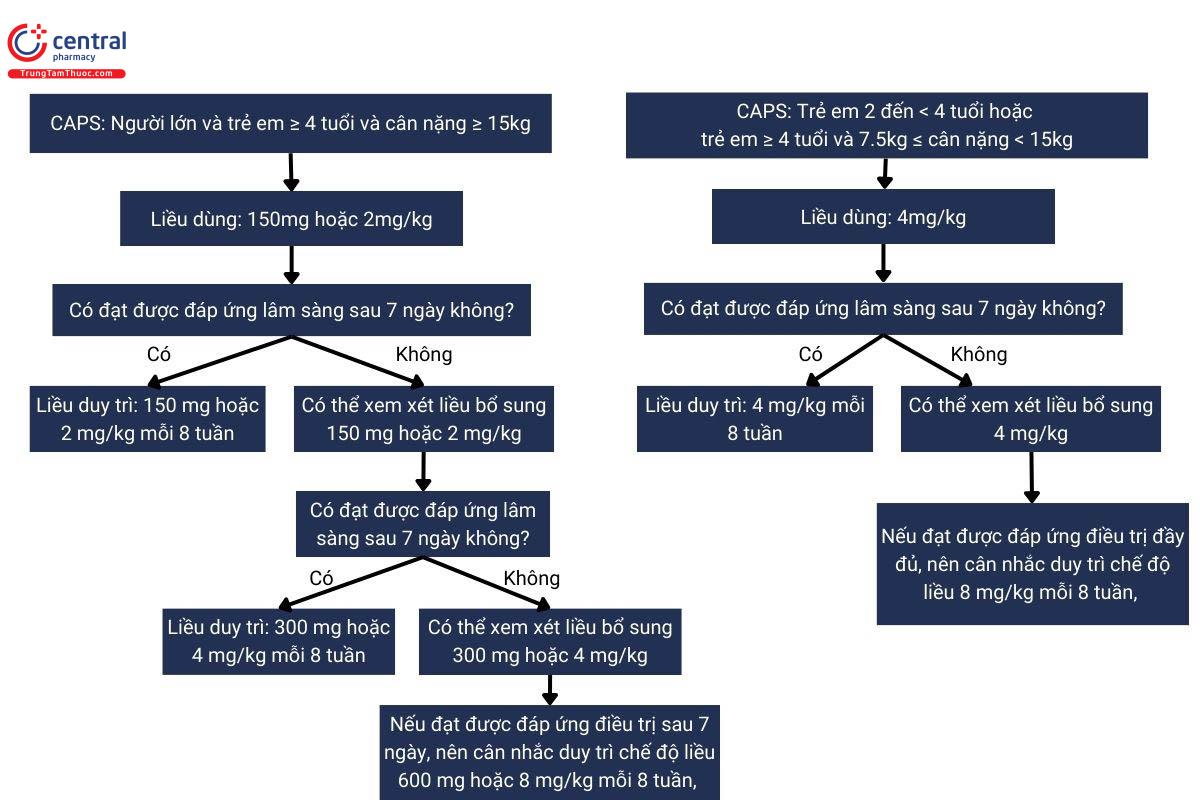
4.1.1 Hội chứng định kỳ liên quan đến Cryopyrin (CAPS):
Người lớn, thanh thiếu niên và trẻ em từ 2 tuổi trở lên
Liều khởi đầu Ilaris(Canakinumab) được khuyến nghị cho bệnh nhân CAPS là:
Người lớn, thanh thiếu niên và trẻ em ≥ 4 tuổi:
- 150 mg cho bệnh nhân có cân nặng > 40 kg
- 2 mg/kg đối với bệnh nhân có trọng lượng cơ thể ≥ 15 kg và ≤ 40 kg
- 4 mg/kg cho bệnh nhân có cân nặng ≥ 7,5 kg và < 15 kg
Trẻ em từ 2 đến < 4 tuổi: 4 mg/kg cho bệnh nhân có cân nặng ≥ 7,5 kg
Thuốc này được dùng 8 tuần một lần dưới dạng một liều duy nhất qua đường tiêm dưới da.
4.1.2 Hội chứng định kỳ liên quan đến thụ thể yếu tố hoại tử khối u (TRAPS), Hội chứng Hyperimmunoglobulin D/Thiếu hụt Mevalonate Kinase (HIDS/MKD) và Sốt Địa Trung Hải có tính chất gia đình (FMF)
Người lớn, thanh thiếu niên và trẻ em từ 2 tuổi trở lên
Liều khởi đầu được khuyến nghị của Ilaris(Canakinumab) ở bệnh nhân TRAPS, HIDS/MKD và FMF là:
- 150 mg cho bệnh nhân có cân nặng > 40 kg
- 2 mg/kg cho bệnh nhân có trọng lượng cơ thể ≥ 7,5 kg và ≤ 40 kg
Điều này được thực hiện bốn tuần một lần dưới dạng một liều duy nhất thông qua tiêm dưới da.
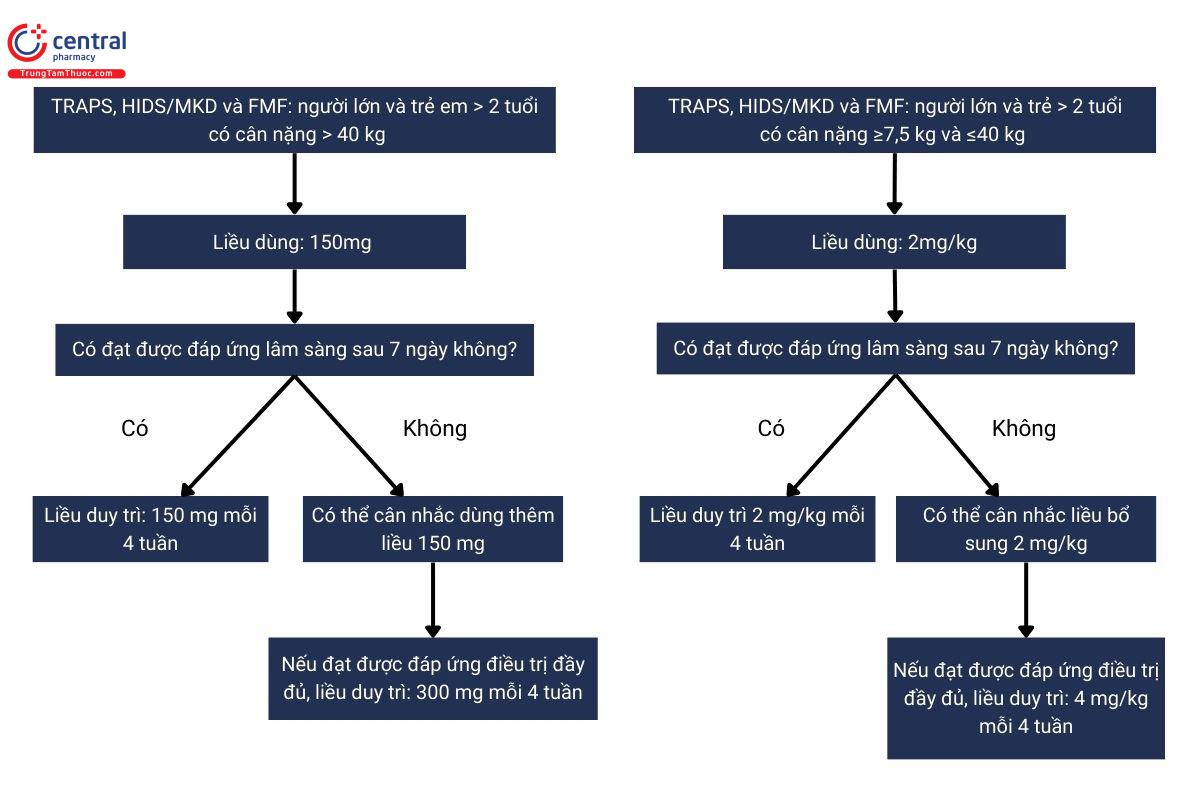
4.1.3 Bệnh Still (SJIA và AOSD)
Liều Ilaris(Canakinumab) được khuyến nghị cho bệnh nhân mắc bệnh Still có trọng lượng cơ thể ≥ 7,5 kg là 4 mg/kg (tối đa 300mg) tiêm dưới da bốn tuần một lần. Việc tiếp tục điều trị bằng Ilaris(Canakinumab) ở những bệnh nhân không cải thiện lâm sàng nên được bác sĩ điều trị xem xét lại.
4.1.4 Bệnh gout
Liều Ilaris(Canakinumab) được khuyến nghị cho bệnh nhân trưởng thành bị gout là 150mg tiêm dưới da dưới dạng một liều duy nhất trong đợt tấn công. Để có hiệu quả tối đa, Ilaris(Canakinumab) nên được dùng càng sớm càng tốt sau khi bắt đầu cơn gút cấp.
Những bệnh nhân không đáp ứng với điều trị ban đầu không nên điều trị lại bằng Ilaris (Canakinumab). Ở những bệnh nhân đáp ứng và cần điều trị lại, nên có khoảng thời gian ít nhất 12 tuần trước khi dùng liều Ilaris (Canakinumab) mới
4.1.5 Một số đối tượng đặc biệt
- Suy thận: Không cần hiệu chỉnh liều
- Suy gan: Ilaris (Canakinumab) chưa được nghiên cứu ở bệnh nhân suy gan. Không có khuyến nghị về liều lượng có thể được thực hiện.
- Trẻ em: Tính an toàn và hiệu quả của Ilaris (Canakinumab) trẻ dưới 2 tuổi chưa được chứng minh.
- Người già: không cần hiệu chỉnh liều.
4.2 Cách dùng của thuốc Ilaris 150 mg/ml
Chỉ sử dụng tiêm dưới da
Sau đây là các vị trí tiêm thích hợp: đùi trên, bụng, cánh tay trên hoặc mông. Nên chọn vị trí tiêm khác nhau mỗi lần tiêm sản phẩm để tránh đau nhức. Nên tránh những vùng da bị trầy xước và những vùng bị bầm tím hoặc bị phát ban. Nên tránh tiêm vào mô sẹo vì điều này có thể dẫn đến tiếp xúc không đủ với Ilaris (Canakinumab).
5 Chống chỉ định
Quá mẫn cảm với hoạt chất hoặc với bất kỳ tá dược nào được liệt kê trong phần
Nhiễm trùng nặng
6 Tác dụng không mong muốn
Phản ứng có hại của thuốc thường gặp nhất là nhiễm trùng chủ yếu ở đường hô hấp trên.
Các loại tần suất được xác định theo quy ước sau: rất phổ biến ( ≥ 1/10); phổ biến ( ≥ 1/100 đến < 1/10); không phổ biến ( ≥ 1/1.000 đến < 1/100); hiếm ( ≥ 1/10.000 đến < 1/1.000); rất hiếm (< 1/10.000); chưa biết (không thể ước tính từ dữ liệu có sẵn).
Trong mỗi nhóm tần suất, các phản ứng bất lợi được trình bày theo thứ tự mức độ nghiêm trọng giảm dần.
| Nhiễm trùng và nhiễm độc | |
Rất phổ biến | Nhiễm trùng đường hô hấp (bao gồm viêm phổi, viêm phế quản, cúm, nhiễm virus, viêm xoang, viêm mũi, viêm họng, viêm amidan, viêm mũi họng, nhiễm trùng đường hô hấp trên) Nhiễm trùng tai Viêm mô tế bào Viêm dạ dày ruột Nhiễm trùng đường tiết niệu |
| Phổ biến | Nhiễm nấm candida âm hộ |
| Rối loạn hệ thần kinh | |
| Phổ biến | Chóng mặt/chóng mặt |
| Rối loạn tiêu hóa | |
| Rất phổ biến | Đau bụng trên |
| Không phổ biến | Bệnh trào ngược dạ dày thực quản |
| Rối loạn da và mô dưới da | |
| Rất phổ biến | Phản ứng tại chỗ tiêm |
| Rối loạn cơ xương và mô liên kết | |
| Rất phổ biến | Đau khớp |
| Phổ biến | Đau cơ xương khớp Đau lưng |
| Rối loạn chung và tình trạng tại chỗ dùng thuốc | |
| Phổ biến | Mệt mỏi, suy nhược |
| Các tác dụng không mong muốn khác | |
| Rất phổ biến | Độ thanh thải creatinin ở thận giảm Protein niệu Giảm bạch cầu |
| Phổ biến | Giảm bạch cầu trung tính |
| Không phổ biến | Số lượng tiểu cầu giảm |
7 Tương tác
Tỷ lệ nhiễm trùng nghiêm trọng tăng lên có liên quan đến việc sử dụng một thuốc chẹn IL-1 khác kết hợp với thuốc ức chế TNF. Vì vậy, không nên sử dụng Ilaris (Canakinumab) cùng với thuốc ức chế TNF vì điều này có thể làm tăng nguy cơ nhiễm trùng nghiêm trọng.
Sự biểu hiện của enzyme CYP450 ở gan có thể bị ức chế bởi các cytokine kích thích tình trạng viêm mãn tính, chẳng hạn như interleukin-1 beta (IL-1 beta). Do đó, biểu hiện CYP450 có thể bị đảo ngược khi áp dụng liệu pháp ức chế cytokine mạnh, chẳng hạn như Ilaris (Canakinumab). Điều này có liên quan về mặt lâm sàng đối với chất nền CYP450 có chỉ số điều trị hẹp trong đó liều được điều chỉnh riêng lẻ. Khi bắt đầu sử dụng Ilaris (Canakinumab) ở những bệnh nhân đang điều trị bằng loại thuốc này, nên thực hiện theo dõi điều trị về tác dụng hoặc nồng độ hoạt chất và điều chỉnh liều của từng loại thuốc khi cần thiết.
Không có dữ liệu về tác động của việc tiêm vaccine sống hoặc sự lây truyền nhiễm trùng thứ cấp do vắc xin sống ở những bệnh nhân dùng Ilaris (Canakinumab). Do đó, không nên tiêm vaccine sống đồng thời với Ilaris (Canakinumab) trừ khi lợi ích rõ ràng vượt trội so với rủi ro. Nếu chỉ định tiêm vaccine sống sau khi bắt đầu điều trị bằng Ilaris (Canakinumab), khuyến nghị là nên đợi ít nhất 3 tháng sau lần tiêm Ilaris (Canakinumab) cuối cùng và trước lần tiêm tiếp theo.
8 Lưu ý khi dùng và bảo quản
8.1 Lưu ý và thận trọng
8.1.1 Nhiễm trùng
Ilaris (Canakinumab) có liên quan đến việc tăng tỷ lệ nhiễm trùng nghiêm trọng. Do đó, bệnh nhân cần được theo dõi cẩn thận các dấu hiệu và triệu chứng nhiễm trùng trong và sau khi điều trị bằng Ilaris (Canakinumab). Các bác sĩ nên thận trọng khi dùng Ilaris (Canakinumab) cho bệnh nhân bị nhiễm trùng, có tiền sử nhiễm trùng tái phát hoặc các tình trạng tiềm ẩn có thể khiến họ bị nhiễm trùng.
8.1.2 Phụ nữ có khả năng sinh con / Tránh thai ở nam và nữ
Phụ nữ nên sử dụng các biện pháp tránh thai hiệu quả trong thời gian điều trị bằng Canakinumab và tối đa 3 tháng sau liều cuối cùng.
8.2 Lưu ý khi dùng cho phụ nữ có thai và cho con bú
8.2.1 Phụ nữ có thai
Có rất ít dữ liệu về việc sử dụng Ilaris (Canakinumab) ở phụ nữ mang thai. Các nghiên cứu trên động vật không chỉ ra tác hại trực tiếp hoặc gián tiếp liên quan đến độc tính sinh sản. Nguy cơ đối với thai nhi/mẹ chưa được biết rõ. Do đó, phụ nữ đang mang thai hoặc mong muốn có thai chỉ nên điều trị sau khi đã đánh giá kỹ lưỡng lợi ích-rủi ro.
Các nghiên cứu trên động vật chỉ ra rằng Ilaris (Canakinumab) đi qua nhau thai và được phát hiện ở bào thai. Không có dữ liệu trên người, nhưng vì Ilaris (Canakinumab) là một globulin miễn dịch nhóm G (IgG1) nên có thể xảy ra hiện tượng truyền qua nhau thai ở người. Tác động lâm sàng của điều này vẫn chưa được biết. Tuy nhiên, không nên tiêm vaccine sống cho trẻ sơ sinh tiếp xúc với Ilaris (Canakinumab) trong tử cung trong 16 tuần sau liều Ilaris (Canakinumab) cuối cùng của người mẹ trước khi sinh. Những phụ nữ đã sử dụng Ilaris (Canakinumab) trong thời kỳ mang thai nên được hướng dẫn thông báo cho chuyên gia chăm sóc sức khỏe của em bé trước khi tiêm bất kỳ loại vắc xin nào cho trẻ sơ sinh của họ.
8.2.2 Phụ nữ cho con bú
Chưa rõ Ilaris (Canakinumab) có bài tiết qua sữa mẹ hay không. Do đó, quyết định có nên cho con bú bằng sữa mẹ trong khi điều trị bằng Ilaris (Canakinumab) hay không chỉ nên được đưa ra sau khi đánh giá kỹ lưỡng lợi ích-nguy cơ.
Các nghiên cứu trên động vật đã chỉ ra rằng kháng thể beta IL-1 kháng chuột ở chuột không có tác dụng không mong muốn đối với sự phát triển ở chuột con đang bú và kháng thể này đã được chuyển sang chúng.
8.3 Ảnh hưởng lên khả năng lái xe và vận hành máy móc
Ilaris (Canakinumab) có ảnh hưởng nhỏ đến khả năng lái xe và vận hành máy móc. Điều trị bằng Ilaris có thể dẫn đến chóng mặt/chóng mặt hoặc suy nhược (xem phần 4.8). Những bệnh nhân gặp phải các triệu chứng như vậy trong quá trình điều trị bằng Ilaris nên đợi tình trạng này thuyên giảm hoàn toàn trước khi lái xe hoặc vận hành máy móc.
8.4 Quá liều và xử trí
Kinh nghiệm được báo cáo về quá liều còn hạn chế. Trong các thử nghiệm lâm sàng ban đầu, bệnh nhân và tình nguyện viên khỏe mạnh được dùng liều cao tới 10 mg/kg, tiêm tĩnh mạch hoặc tiêm dưới da mà không có bằng chứng về độc tính cấp tính.
Trong trường hợp quá liều, nên theo dõi bệnh nhân về bất kỳ dấu hiệu hoặc triệu chứng nào của phản ứng bất lợi và tiến hành điều trị triệu chứng thích hợp ngay lập tức.
8.5 Bảo quản
Bảo quản trong tủ lạnh (2°C - 8°C).
Bảo quản trong bao bì gốc để tránh ánh sáng.
9 Nhà sản xuất
Nhà sản xuất: Công ty Novartis International AG
Đóng gói: Hộp 01 lọ bột pha tiêm
10 Ưu điểm
Giải pháp hiệu quả để điều trị các đợt gout cấp ở người lớn không thể điều trị bằng NSAID, Colchicine (Colcrys) hoặc các đợt điều trị lặp lại bằng Corticosteroid.
Thuốc cũng được chỉ định cho những người không thể dung nạp hoặc có phản ứng không đầy đủ với NSAID hoặc Colchicine.
11 Nhược điểm
Có thể gây đau tại chỗ tiêm và một vài phản ứng khác.
Phải dùng dưới sự hỗ trợ, giám sát của nhân viên y tế.
Sản phẩm hiện chưa lưu hành tại một số quốc gia, trong đó có Việt Nam.
Tài liệu tham khảo
- ^ Lucy Hicks (Đăng ngày 30 tháng 8 năm 2023). FDA Approves Canakinumab for Gout Flares, Medscape. Ngày truy cập: 4 tháng 9 năm 2023.
- ^ Tờ HDSD Ilaris lưu hành tại Anh (Cập nhật ngày 6 tháng 7 năm 2021). Ilaris 150mg/ml Solution for Injection, emc. Ngày truy cập 4 tháng 9 năm 2023.
- ^ Chuyên gia của Pubchem. Canakinumab, Pubchem. Ngày truy cập: 4 tháng 9 năm 2023.