Fludarabin
0 sản phẩm
 Dược sĩ Hương Trà Dược sĩ lâm sàng - Đại học Y Dược Thái Nguyên
Dược sĩ Hương Trà Dược sĩ lâm sàng - Đại học Y Dược Thái Nguyên
Ngày đăng:
Cập nhật:
Bài viết biên soạn theo
Dược thư quốc gia Việt Nam, lần xuất bản thứ ba
Do Bộ Y Tế ban hành Quyết định số 3445/QĐ-BYT ngày 23 tháng 12 năm 2022
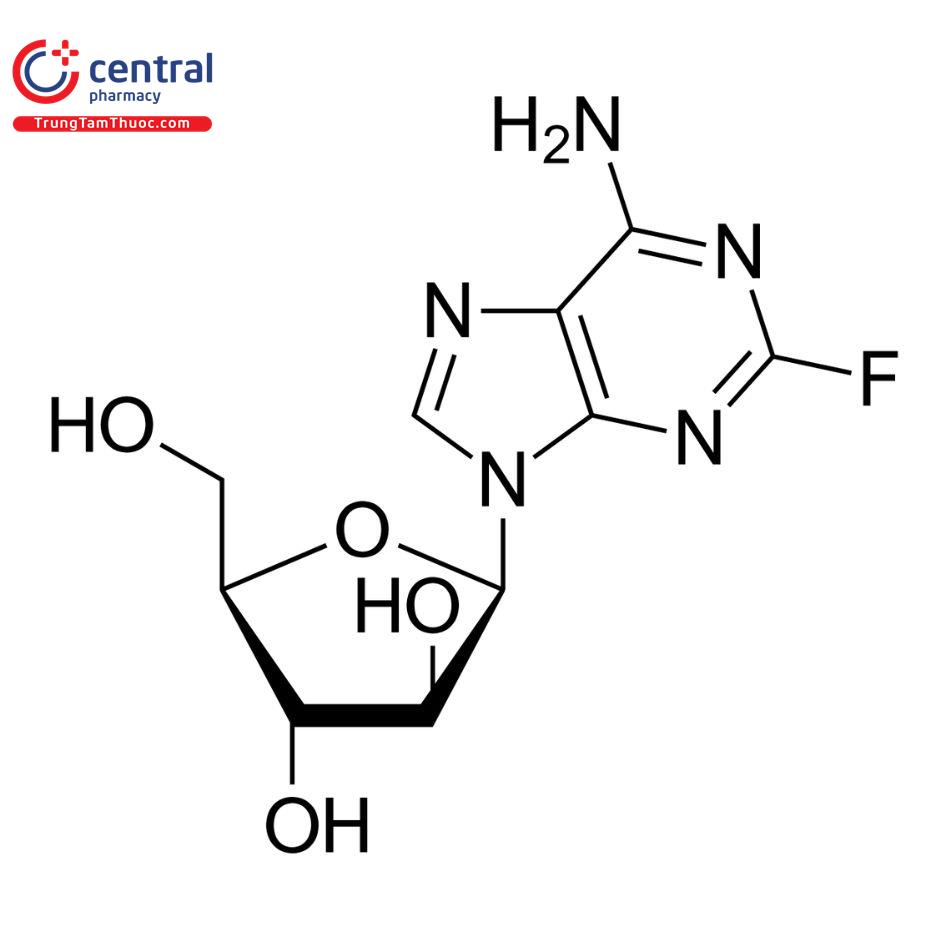
FLUDARABIN PHOSPHAT
Tên chung quốc tế: Fludarabine phosphate
Mã ATC: LOIBEOS
Loại thuốc: Thuốc chống ung thư loại chống chuyển hóa.

1 Dạng thuốc và hàm lượng
Bột đông khô để pha tiêm: 50 mg.
Dung dịch tiêm: 50 mg/2 ml.
Viên nén: 10 mg.
2 Dược lực hoc
Khi vào máu, fludarabin phosphat bị chuyển hóa thành fludarabin và được vận chuyển vào tế bào. Tại đây, enzym deoxycytidin kinase xúc tác làm chuyển hóa fludarabin thành 2-fluoroarabino- cho là có tác dụng độc tế bào. Trong các tế bào khỏe mạnh, tỷ lệ vận chuyển thuốc qua màng tế bào ít hơn trong các tế bào ung thư Mặc dù cơ chế chính xác của fludarabin chưa được chứng minh cụ thể, tuy nhiên fludarabin triphosphat (FATP) cho thấy ức chế các enzym alpha-DNA polymerase, ribonucleotid reductase, DNA-primase bằng cách cạnh tranh với các cơ chất sinh học như deoxyadenosin triphosphat, kết quả là ức chế tổng hợp DNA. Cũng có bằng chứng khác cho thấy dạng phosphoryl có hoạt tính của thuốc có thể gắn kết vào sợi DNA đang phát triển như một nucleotid giả, làm cán trở sợi kéo dài thêm nên chấm dứt quả trình tổng hợp DNA, hoặc cản trở tổng hợp RNA và protein bằng cách giảm sự kết hợp uridin và leucin vào RNA và protein tương ứng. Tuy nhiên, để ức chế quá trình tổng hợp RNA và protein cần nồng độ thuốc cao hơn so với ức chế tổng hợp DNA.
Mặc dù cả nghiên cứu in vitro và in vivo cho thấy tác dụng độc tế bào trên tế bào T nhạy cảm hơn tế bảo B, nhưng thuốc vẫn có tác dụng mạnh đối với tế bào B ở bệnh nhân rối loạn tăng lympho, kể cả bệnh nhân mắc bệnh bạch cầu mạn dòng lympho. Ngoài ra, tác dụng tiêu tế bảo của thuốc thậm chí còn tương đối nhanh trên khối u ở bệnh bạch cầu mạn dòng lympho được đặc trưng bởi tốc độ tăng sinh thấp.
Mặc dù fludarabin có thể hiện hoạt tính kháng virus trong ống nghiệm (ví dụ: HSV-1 và HSV-2), thuốc lại hầu như không thể hiện hoạt tính kháng virus trên lâm sàng ở liều it hơn liễu gây độc với người..
Thuốc có tác dụng trên bệnh bạch cầu mạn dòng tủy hoặc lympho tái phát ở trẻ em, bệnh Waldenstrom, điều trị chống thải ghép trong ghép tế bào gốc. Thuốc đang nghiên cứu sử dụng trong điều trị u lympho non-Hodgkin độ ác tính thấp kháng thuốc hoặc thất bại với điều trị bước 1.
3 Dược động học
Đường tiêm
Sau khi được tiêm truyền tĩnh mạch, Hudarabin phosphat nhanh chóng chuyển thành fludarabin trong 2 đến 5 phút, dạng monophosphat còn lại có nồng độ ở mức không thể phát hiện. Do đó, mặc dù thuốc được đưa vào dưới dạng fludarabin phosphat (dạng monophosphat), liều dùng và các thông số dược động học đều được tính theo fludarabin và fludarabin triphosphat. Sau khi tiêm truyền tĩnh mạch 25 mg/m trong 30 phút mỗi ngày, thuốc tích lũy vừa phải trong máu với nồng độ đáy tăng gấp 2 lần sau 5 ngày điều trị Chi đạt được khoảng 2 giờ sau khi tiêm truyền. AUC của fludarabin trong máu và fludarabin triphosphat trong nguyên bảo tỷ lệ với liều. Lượng fludarabin liên hợp với acid nucleic và lượng fludarabin triphosphat tích lũy nội bào được ghi nhận cổ tương quan trực tiếp và tỷ lệ thuận với nhau. Ở bệnh nhân không bị ung thư bạch cầu, sự giảm số lượng bạch cầu tỷ lệ với nồng độ fludarabin trong máu và liều dùng.
Tiêm truyền tĩnh mạch mức liều khuyến cáo 25 mg/m ngày, trong 5 ngày liên tiếp, thể tích phân bố ở trạng thái ổn định là 96 - 98 lít/m2. Mặc dù fludarabin và dạng chuyển hòa chưa được chứng minh là có phân bố ở TKTW, tuy nhiên đã có những báo cáo về độc tính thần kinh nghiêm trọng, đặc biệt khi dùng thuốc ở liều cao. In vitro tỷ lệ liên kết protein huyết trong khoảng 19 - 29%.
Nồng độ thuốc trong máu giám tuyến tính không phụ thuộc vào liều tiêm truyền. Quá trình thải trừ của thuốc theo 2 pha hoặc 3 pha tùy theo thời điểm lấy mẫu ban đầu và phương pháp định lượng, tuy nhiên nửa đời thải trừ pha cuối giống nhau. Ở một số bệnh nhân tiêm truyền fudarabin phosphat 18 hoặc 25 mg/mi/ngày trong 5 ngày, nồng độ thuốc trong máu giảm theo 2 pha, với trai và t trung bình khoảng 30 phút và 9,3 giờ. Ở bệnh nhân tiêm truyền nhanh (2 – 5 phút) 80 - 260 mg/m3, sự thải trừ theo 3 pha, cụ thể, nửa đời pha thứ nhất, thứ hai, thứ ba lần lượt là 5 - 7 phút, 1,4 - 1,7 giờ và khoảng 10 giờ.
Sau khi tiêm truyền fludarabin phosphat liều từ 20 - 125 mg/m/ ngày trong 30 phút, trong 5 ngày, nửa đời thải trừ pha cuối của FATP là 15 giờ. Ở bệnh nhân ung thư, nửa đời thai trừ pha cuối của FATP có thể lên đến 20 giờ với liều 25 mg/m3/ngày, truyền tĩnh mạch trong 30 phút, trong 5 ngày. Độ thanh thải toàn phần của fludarabin tưởng quan trực tiếp với độ thanh thải creatinin cho thấy thải trừ qua thận đóng vai trò quan trọng trong việc thải trừ thuốc, đặc biệt khi sử dụng thuốc liều cao. Với liều 18 - 25 mg/m ngày tiêm truyền tĩnh mạch trong 5 ngày, 24% liễu được thải trừ. qua thận ở dạng fludarabin trong 24 giờ. Trái lại, khi truyền liều 80 - 260 mg/m), thải trừ qua nước tiểu là 41 – 60%.
Bệnh nhân suy thận mức độ vừa (C1, 17 -41 ml/phút/1,73 m), khi sử dụng mức liều giảm 20% cho kết quả AUC giống như bệnh nhân có chức năng thận bình thường.
Đường uống:
Sau khi uống, fludarabin phosphat nhanh chóng chuyển thành fludarabin. Nồng độ fludarabin cao nhất trong máu khi dùng đường uống (đạt được sau uống 1 - 2 giờ) chỉ bằng 20 - 30% so với nồng độ cao nhất khi dùng đường tiêm ở liều tương ứng. Sinh khả dụng của fludarabin dùng đơn liều hay liều lặp lại nằm trong khoảng 50-65%.
Khi uống fludarabin phosphat với thức ăn sẽ làm tăng nhẹ AUC (< 10%), giảm C., kéo dài thời gian đạt Can nhưng không ảnh hưởng đến nửa đời thải trừ.
Trong khi nửa đời thải trừ, độ thanh thái và thể tích phân bố của fludarabin không thay đổi khi thay đổi liều dùng thi nồng độ fludarabin trong máu và AUC của flucarabin tỉ lệ thuận với liều dùng.
4 Chỉ định
Điều trị ban đầu cho bệnh bạch cầu mạn dòng lympho B tiến triển hoặc sau điều trị bước 1 ở bệnh nhân còn đủ dự trữ tủy xương.
5 Chống chỉ định.
Bệnh nhân mẫn cảm với fludarabin.
Suy thận nặng (Cl < 30 ml/phút).
Thiếu máu tan huyết mắt bù.
Phụ nữ mang thai hoặc đang cho con bú.
6 Thận trọng
Fludarabin là thuốc có độc tính cao với chỉ số điều trị thấp, đáp ứng điều trị thưởng đi kèm với độc tỉnh. Thuốc phải được sử dụng dưới sự theo dõi thưởng xuyên của nhân viên y tế có kinh nghiệm trong việc điều trị với thuốc gây độc tế bảo. Các ADR của thuốc có thể xử lý nếu phát hiện kịp thời. Trong trường hợp tác dụng phụ xảy ra nghiêm trọng, cần phải ngừng thuốc hoặc giảm liều ở mức độ cần thiết. Fludarabin được sử dụng lại tùy theo tình trạng bệnh nhân, cẩn thận trọng đánh giá nguy cơ tái xuất hiện độc tính và lợi tích điều trị của thuốc.
Kiểm tra các thông số huyết học thường xuyên và cẩn thận trong và sau khi điều trị. Định kỳ theo đội công thức máu và số lượng tế bào máu ngoại vi để phát hiện trường hợp thiếu máu, giảm tiểu cấu hoặc bạch cầu. Vì biến chứng có nguy cơ tử vong cao nên bệnh nhân cần phải thông báo ngay cho nhân viên y tế nếu phát hiện thấy sốt, đau họng, chảy máu hoặc thăm tim bất thường.
Cần cân nhắc sử dụng máu chiếu xạ ở những bệnh nhân cần truyền máu trong quá trình điều trị vì có nguy cơ xảy ra hội chứng mô ghép chồng chủ (có liên quan đến truyền tế bào bạch cầu). Bệnh nhân trước điều trị có khối u kích thước lớn có nguy cơ bị hội chứng phân giải khối u khi điều trị bằng fludarabin. Tác dụng tiêu tế bào có thể xảy ra 1 tuần sau khi bắt đầu điều trị bằng fludarabin, do đó bệnh nhân cần phải được quan tâm đến nguy cơ này bằng xét nghiệm acid uric và LDH máu trước điều trị.
Độ thanh thái của fludarabin có liên quan trực tiếp đến độ thanh thải creatinin, do đó bệnh nhân suy giảm chức năng thận cần phải điều chỉnh liều một cách cẩn thận. Khuyến cáo giảm liều khi suy thận vừa và không sử dụng thuốc khi suy thận nặng.
Các bệnh nhân suy tủy từ trước, người cao cao tuổi có thể tăng nguy cơ nhiễm độc do fludarabin, vì vậy cần phải theo dõi kiểm soát chặt chẽ độc tỉnh của thuốc ở những bệnh nhân này.
Không sử dụng đồng thời corticosteroid với các dẫn chất purin (bao gồm fludarabin và các dẫn chất khác) để tránh nguy cơ nhiễm khuẩn. Trong khi nguy cơ của một số độc tỉnh (như độc tính thần kinh) tăng lên khi tăng liều dùng, thi ảnh hưởng của tốc độ truyền tĩnh mạch đối với những độc tinh này vẫn đang được xác định, và độc tỉnh trên thần kinh đã xảy ra cả khi thuốc được đưa bằng đường tiêm tĩnh mạch nhanh hoặc truyền tĩnh mạch chậm.
7 Thời kỳ mang thai
Fludarabin gây độc với bảo thai khi sử dụng cho người mang thai. Người trong độ tuổi sinh sản nên tránh mang thai khi sử dụng fludarabin; và ngược lại fludarabin chỉ sử dụng cho phụ nữ mang thai khi tình trạng bệnh nghiêm trọng, nguy hiểm đến tính mạng mà không sử dụng được các thuốc khác an toàn hơn. Cần phải thông báo đầy đủ thông tin về nguy cơ tử vong đối với thai nhi cho các bệnh nhân mang thai khi sử dụng thuốc.
8 Thời kỳ cho con bú
Chưa rõ khả năng phân bố của thuốc vào sữa mẹ. Tuy nhiên vì phân bố vào sữa, cần cân nhắc nếu dùng thuốc thì phải ngừng cho những nguy cơ nghiêm trọng có thể xảy ra trong trường hợp thuốc con bú.
9 Tác dụng không mong muốn (ADR)
Rất thường gặp
Tim mạch; phủ (8 - 19%).
TKTW: sốt (bồn chồn, lo lắng) (11 - 69%), mệt mỏi (10 - 38%), đau (5 - 22%), ớn lạnh (11 - 19%).
Da: phát ban (4 - 15%).
Tiêu hóa: nôn và buồn nôn (1 - 36%), chán ăn (khoảng 34%). ia chảy (5 - 15%), chảy máu đường tiêu hóa (3 - 13%).
Sinh dục, tiết niệu: nhiễm khuẩn đường niệu (2 - 15%).
Máu: suy tủy (trầm trọng nhất sau 10 - 14 ngày, hồi phục sau 5 -7 tuần, độc tính cần giảm liều), thiếu máu (14 - 60%), giảm bạch cầu trung tỉnh (độ 4: 37 - 59%, trầm trọng sau 13 ngày), giảm tiểu cầu (17 - 55%, trầm trọng sau 16 ngày).
Hô hấp: họ (≤44%), viêm phổi (3 – 22%), khó thở (1 – 22%), nhiễm khuẩn đường hô hấp trên (2 - 16%), viêm mũi (<11%). Thần kinh cơ và xương: yếu cơ (9 - 65%), đau cơ (4 - 16%), dị cảm (4 - 12%).
Mắt: giảm thị lực (3 - 15%).
Nhiễm khuẩn (12 - 44%): nhiễm trùng cơ hội (viêm phổi, Herpes zoster virus, Esptein-Barr-virus,...).
Thường gặp
Tim mạch: phù ngoại vi (≤ 7%), đau thắt ngực (≤ 6%), đau ngực (≤ 5%), suy tim sung huyết (≤ 3%), loạn nhịp tim (≤ 3%), tai biến mạch máu não (≤ 3%), nhồi máu cơ tim (≤ 3%), cơn nhịp nhanh kịch phát (≤ 3%), nghẽn mạch sâu (1 - 3%), viêm tĩnh mạch (1 - 3%), chứng phình mạch (≤ 1%), thiếu máu não cục bộ (≤ 1%). TKTW: đau đầu (≤ 9%), khó chịu (5 6 - 8%), rối loạn giấc ngủ (1 - 3%), hội chứng tiểu não (≤ 1%), trầm cảm (≤ 1%), tâm lý tổn thương (≤ 1%).
Da: rụng tóc (≤ 3%), ngửa sần (1 - 3%), tiết chất nhờn (≤ 1%).
Nội tiết và chuyển hóa: Tăng đường huyết (1 - 6%), tăng LDH (≤ 6%), mất nước (≤ 1%).
Tiêu hóa: đau bụng (< 10%), viêm miệng (≤ 9%), sụt cân (≤ 6%), viêm thực quản (≤ 3%), táo bón (1 - 3%), viêm niêm mạc (≤ 2%), khó nuốt (≤ 1%).
Sinh dục, tiết niệu: bí tiểu (3 - 4%), khó tiểu (≤ 3%).
Máu: xuất huyết (≤ 1%), hội chứng loạn sản tủy/bệnh bạch cầu cấp dòng tủy (thường liên quan đến các thuốc chống ung thư đã hoặc đang sử dụng).
Gan/mật: sỏi mật (53%), rối loạn chức năng gan (1 - 3%), suy gan (51%). Thần kinh cơ và xương: đau lưng (59%), loãng xương (≤ 2%), đau khớp (≤ 1%), bệnh thần kinh ngoại vi.
Tai: mất thính giác (2 - 6%).
Mắt: rối loạn thị giác.
Thận: tiểu ra máu (2 - 3%), suy thận (≤ 1%), rối loạn chức năng thận (≤ 1%), protein niệu (51%).
Hô hấp: viêm phế quản (≤ 9%), viêm hầu họng (59%), viêm phổi dị ứng (1 - 6%), ho ra máu ( 1 - 6%), viêm xoang (≤5%), chảy máu cam (≤ 1%), thiếu oxy (< 1%).
Khác: hội chứng giả cúm (5 - 8%), nhiễm Herpes simplex (58%), quá mẫn (≤ 1%), hội chứng phân giải khối u (1%).
Ít gặp: (Chỉ giới hạn những ADR nguy hiểm đến tính mạng): Miễn dịch: thiếu máu tan huyết mất bù, hội chứng Evans, xuất huyết giảm tiểu cầu, Hemophilia, Pemphigus.
Dinh dưỡng, chuyển hóa: hội chứng ly giải u (suy thận, toan máu, tăng Kali huyết, hạ calci huyết, tăng acid uric huyết). Hô hấp: xơ phổi, viêm phổi, khó thở.
Hiếm gặp
Thần kinh: hôn mê, sảng, kích động. Mắt: nhìn mờ, viêm thần kinh thị giác.
Tim mạch: suy tim, rối loạn nhịp tim.
Da: ung thư da, hội chứng lyell, hội chứng Stevens-Johnsons.
Hướng dẫn cách xử trí ADR
Khi xảy ra thiếu máu tan huyết tự miễn, cần phải giám sát tinh trạng tan máu, ngừng dùng thuốc khi xảy ra tan máu.
Khi xảy ra xuất huyết giảm tiểu cầu giảm tiểu cầu tự miễn, hội chứng Evans và ưa chảy máu mắc phải, giám sát tình trạng tan máu (tĩnh mạch), ngừng thuốc khi xảy ra tan máu.
Ngừng dùng thuốc hoặc tạm ngừng điều trị khi xảy ra nhiễm độc thần kinh, mức độ nghiêm trọng phụ thuộc vào liều.
Khi xảy ra suy tủy xương (giảm hồng cầu, bạch cầu, tiểu cầu nghiêm trọng) nguyên phát hoặc trầm trọng tình trạng trước đó. giám sát số lượng tế bào máu trước và trong khi điều trị.
Khi nhiễm khuẩn (tình trạng nguy kịch), giám sát triệu chứng và dấu hiệu nhiễm khuẩn.
Nếu xảy ra mô ghép chồng chủ trong trường hợp truyền máu không chiếu xạ, khuyến cáo sử dụng máu chiếu xạ để truyền.
10 Liều lượng và cách dùng
10.1 Cách dùng
Thuốc tiêm: Thuốc có thể được tiêm tĩnh mạch nhanh hoặc truyền tĩnh mạch liên tục (ví dụ trong hơn 48 giờ), tuy nhiên nhà sản xuất khuyến cáo fludarabin phosphat nên được truyền tĩnh mạch trong 30 phút.
Cách pha: Hòa tan bột pha tiêm fludarabin phosphat bằng cách thêm 2 ml nước pha tiêm vào lọ chứa 50 mg thuốc, được dung dịch thuốc tiêm 25 mg/ml. Thuốc được hòa tan hoàn toàn trong thời gian không quá 15 giây khi lắc. Ngoài ra, cũng có thể sử dụng dung dịch tiêm 25 mg/ml có sẵn trên thị trường. Sau đó, rút một lượng thuốc vừa đủ từ lọ và thêm vào dung dịch tiêm truyền tĩnh mạch phù hợp; trong các nghiên cứu lâm sàng, thuốc được pha trong 100 ml hoặc 125 ml dung dịch dextrose 5% hoặc dung dịch tiêm Natri clorid 0,9%.
Dung dịch fludarabin phosphat không chứa chất bảo quản và nên được sử dụng trong vòng 8 giờ sau khi pha loãng. Khi pha dung dịch phải đảm bảo độ vô khuẩn của dung dịch. Các dung dịch có sẵn trên thị trường, dung dịch 25 mg/ml pha được và dung dịch pha loãng của fludarabin phosphat cần phải được kiểm tra bằng mắt thưởng về tiểu phân lạ và độ trong trước khi sử dụng.
Do nguy cơ gây ung thư của fludarabin, cần phải thực hành các cảnh báo thận trọng trong bảo quản và pha chế của các thuốc gây độc tế bào. Phải sử dụng găng tay Cao Su và kính bảo vệ mắt để tránh tiếp xúc với thuốc trong trường hợp bao bì thuốc bị vỡ hoặc vô tỉnh bị đổ, cần phải tránh tiếp xúc với thuốc qua đường hô hấp hoặc tiếp xúc trực tiếp với da hoặc niêm mạc. Nếu bột thuốc pha tiêm hoặc dung dịch fludarabin phosphat tiếp xúc với da hoặc niêm mạc, cần phải rửa kỹ vùng tiếp xúc ngay lập tức bằng xà phòng và nước. Nếu thuốc tiếp xúc với mắt, nên rửa kỹ bằng nước hoặc nước muối sinh lý.
Viên nén: Fludarabin phosphat có thể được uống khi dạ dày rỗng hoặc uống cùng với thức ăn. Thuốc viên phải nuốt với nước, không được nhai hoặc làm vỡ.
10.2 Liều dùng
Thuốc tiêm:
Người lớn: Ở người trưởng thành, liều khởi đầu là 25 mg/m3, 1 lần/ ngày, trong 5 ngày liên tục. Mỗi đợt điều trị nên cách nhau khoảng 28 ngày.
Người suy thận: Nhà sản xuất khuyến cáo giảm 20% liều fludarabin và giám sát chặt chẽ ở người suy thận mức độ trung bình (C1, 30 - 70 ml/phút). Không dùng khi suy thận nặng (C1, < 30 ml/phút ). Thuốc uống:
Người lớn: Liều khuyến cáo hàng ngày là 40 mg fludarabin phosphat/m2 trong 5 ngày liên tiếp mỗi 28 ngày (1 chu kỳ). Fludarabin phosphat đường uống nên dùng đến khi đạt được đáp ứng tốt nhất (hoàn toàn hoặc một phần, thường là 6 chu kỳ) và sau đó ngừng dùng thuốc. Liều thuốc này tương ứng gấp 1,6 lần so với liều tiêm tĩnh mạch của fludarabin phosphat (25 mg/m3/ngày). Thời gian điều trị phụ thuộc vào hiệu quả điều trị và khả năng dung nạp của thuốc.
Không nên điều chỉnh liều lượng cho chu kỳ điều trị đầu tiên ngoại trừ những bệnh nhân suy giảm chức năng thận.
Liều riêng biệt cần được điều chỉnh cẩn thận theo mức độ độc tính huyết học quan sát được.
Nếu ở thời điểm bắt đầu chu kỳ tiếp theo, số tế bảo quá thấp để dùng liều khuyến cáo và có bằng chứng về điều trị liên quan đến suy giảm chức năng tủy thì nên hoãn kế hoạch điều trị cho đến khi hàm lượng bạch cầu hạt trên 1,0 × 10lit và số lượng tiểu cầu trên 100 × 10lít. Điều trị chỉ nên được hoãn lại tối đa là hai tuần. Nếu số lượng bạch cầu và tiểu cầu đã không hồi phục sau hai tuần trì hoãn, nên giảm liều theo sự điều chỉnh liều gợi ý trong bảng dưới đây,
Bạch cầu hạt và/hoặc tiểu cầu | Liều fludarabin phosphat | |
0,5-1,0 | 50-100 | 30 mg/m2/ngày. |
<0,5 | <50 | 20 mg/m2/ ngày |
Không nên giảm liễu khi giảm tiểu cầu có liên quan đến bệnh lý. Nếu bệnh nhân không đáp ứng với điều trị sau hai chu kỳ và không có hoặc có rất ít độc tính huyết học thi có thể xem xét điều chỉnh tăng liều fludarabin phosphat trong các chu kỳ điều trị tiếp theo. Người suy thận: Cần điều chỉnh liều cho bệnh nhân suy thận. Nếu C1, từ 30 - 70 ml phút, nên giảm 50% liều và cần phải theo dõi chặt chế huyết học để đánh giá độc tính.
Chống chỉ định dùng fludarabin phosphat nếu C1, <30 ml/phút.
Trẻ em: Sự an toàn và hiệu quả của uống fludarabin phosphat ở trẻ em dưới 18 tuổi chưa được thiết lập. Do đó, fludarabin phosphat được khuyến cáo không dùng cho trẻ em.
Người suy gan: Không có dữ liệu liên quan đến việc sử dụng fludarabin phosphat ở những bệnh nhân bị suy gan. Trong nhóm bệnh nhân này, fludarabin phosphat nên được sử dụng cẩn thận. Người cao tuổi. Có ít dữ liệu cho việc sử dụng fludarabin phosphat ở người cao tuổi (> 75 tuổi), nên thận trọng khi dùng fludarabin phosphat ở những bệnh nhân này.
Ở bệnh nhân trên 65 tuổi, cần đo độ thanh thải creatinin trước khi . sử dung fludarabin phosphat
11 Tương tác thuốc
Sử dụng đồng thời fludarabin (10 mg/m2/ngày mỗi đợt 4 ngày. khoảng cách giữa các đợt là 28 ngày) và pentostatin (4 mg/m3i ngày, 2 tuần/1 lần) có thể dẫn đến nhiễm độc tại phổi nghiêm trọng. có thể tử vong.
Cytarabin làm giảm đáng kể quá trình chuyển hóa của fludarabin sang dạng FATP có hoạt tỉnh ở cả in vitro và in vivo. Mặt khác, việc sử dụng cytarabin trước khi sử dụng fludarabin có thể ức chế tác dụng chống ung thư của fludarabin tại một số bệnh nhân mắc bệnh . bạch cầu. Cytarabin cạnh tranh với enzym deoxycytidin kinase làm giảm tốc độ chuyển hóa của fludarabin. Ngược lại, việc sử dụng fludarabin trước cytarabin có thể không ảnh hưởng đến quá trình chuyển hóa của cytarabin mà thậm chí còn kích thích quá trình chuyển hóa này.
Tránh sử dụng đồng thời fludarabin với một trong các thành phần. sau: BCG, clozapin, natalizumab, pentostatin. pimecrolimus, Tacrolimus (bôi ngoài da), vắc xin (sống).
Fludarabin có thể làm tăng hoạt tính hoặc tác dụng của: Clozapin, leflunomid, natalizumab, pentostatin, vắc xin sống.
Tác dụng của fludarabin có thể tăng lên bởi: denosumab,pentostatin, pimecrolimus, roflumilast, tacrolimus (bôi ngoài da), Trastuzumab. Fludarabin có thể giảm hoạt tính hoặc tác dụng của: BCG, dung dịch kiểm tra da coccidioidin, sipuleucel-T, vắc xin bất hoạt. Tác dụng của fludarabin có thể bị giảm bởi: cây cúc tím châu Âu (Echinacea purpurea), imatinib.
12 Tương kỵ
Fludarabin phosphat được ghi nhận cỏ tương kỵ vật lý với một số được chất khác, bao gồm Acyclovir natri, amphotericin B, Clorpromazin hydroclorid, daunorubicin hydroclorid, Ganciclovir natri, hydroxyzin hydroclorid, miconazol, proclorperazin edisylat. Tuy nhiên, khả năng tương kỵ và không tưởng kỵ còn phụ thuộc vào một số yếu tố như nồng độ thuốc, dung môi dùng, pH sau khi pha, nhiệt độ.
13 Quá liều và xử trí
Triệu chứng: Hiện vẫn chưa xác định được đầy đủ mức liều an toàn tối đa của fludarabin phosphat trong điều trị bệnh bạch cầu mạn dòng lympho hoặc các bệnh lý khối u khác ở người trưởng thành. Trong khi đó, các độc tỉnh nghiêm trọng và không thể đảo ngược hoặc độc tính gây tử vong (ví dụ, độc tính thần kinh) đã được quan sát thấy ở mức liều 96 mg/m hoặc hơn, dùng mỗi ngày trong 5 - 7 ngày, các mức liều tương đối cao như vậy hiện nay không được khuyến cáo. Các dữ liệu còn hạn chế cho thấy rằng liều tối đa lên đến 40 mg/m mỗi ngày, trong 5 ngày có thể được dung nạp tốt ở người trưởng thành, nhưng mối tương quan lợi ích và nguy cơ của các mức liều cao hơn các mức liều được khuyến cáo hiện nay vẫn đang được xác định, và các mức liều này hiện không được khuyến cáo trừ điều kiện thử nghiệm lâm sàng (ví dụ, trong các để cương nghiên cứu).
Xử trí: Không có thuốc giải độc đặc hiệu cho các trường hợp quả thuốc, điều trị hỗ trợ và điều trị triệu chứng. Truyền máu và các liễu fudarabin. Các biện pháp kiểm soát bao gồm ngừng dùng thành phần huyết học có thể cần thiết trong các trường hợp khi bị suy tủy.

Cập nhật lần cuối: 2018.

