Phương pháp xét nghiệm miễn dịch là gì? Có những loại xét nghiệm miễn dịch nào?
Trường Đại Học Y Hà Nội - Bộ môn Khoa học xét nghiệm
Chủ biên PGS.TS.BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ
Các tác giả tham gia biên soạn
PGS. TS. BS Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ, TS. BS. Nguyễn Thúy Hương, TS. BS. Nguyễn Thị Thanh Hải
ThS. Đặng Quang Huy, Ths. BSNT. Nguyễn Quỳnh Giao, Ths. BSNT. Vũ Đức Anh, ThS. Trịnh Thị Phương Dung
Ths. BSNT. Lê Văn Toàn, Ths. BSNT. Ngô Diệu Hoa, BSNT. Phạm Thị Hương Trang, Ths. BSNT. Nguyễn Thị Thu Thảo
Ths. BS. Nguyễn Thị Hảo, CKI. Đỗ Thị Hường, CKI. Nguyễn Thúy Hà, ThS. Vũ Thị Bích Hồng
CN. Lê Thanh Thảo, CN. Nguyễn Hữu Hùng
Xét nghiệm miễn dịch là các xét nghiệm dựa vào tình trạng miễn dịch của cơ thể để tìm ra các căn nguyên như nhiễm khuẩn (vi khuẩn, virus), hormone, sắc tố hemoglobin trong máu,... từ đó giúp chẩn đoán được các bệnh khác nhau dựa vào kết quả của phản ứng giữa kháng nguyên và kháng thể tổng hợp. Trong bài viết này, Trung Tâm Thuốc Central Pharmacy (trungtamthuoc.com) xin gửi đến bạn đọc thông tin về các phương pháp xét nghiệm miễn dịch.
1 Tổng quan
Xét nghiệm miễn dịch, dựa trên liên kết ái lực giữa kháng thế và kháng nguyên tương ứng, là công nghệ phân tích phát triển nhanh nhất để phát hiện và định lượng các phân tử sinh học trong chần đoán lâm sàng. Bản chất liên kết chọn lọc của kháng thể cho phép phát hiện cụ thể các phân tử mục tiêu ngay cà với nồng độ rất thấp và chất nền sinh học phức tạp, chẳng hạn như trong mẫu máu toàn phần, huyết thanh và các dịch sinh học khác. Ngoài ra, một loạt các kháng thể có thể được tạo ra trong tự nhiên và sự sẵn có của nhiều nhãn gắn có thế phát hiện cho phép xét nghiệm miễn dịch phát hiện nhiều loại chất phân tích với giới hạn phát hiện thấp (LOD-Limit of detection). Cảm biến miễn dịch là sự kết hợp của xét nghiệm miễn dịch và đầu dò tín hiệu liên kết trực tiếp. Kết hợp độ đặc hiệu cao của phản ứng miễn dịch với độ nhạy và lợi thế của các kỹ thuật phát hiện, cảm biến miễn dịch hiện được coi là một bước phát triển lớn trong lĩnh vực hóa miễn dịch. So với các phương pháp xét nghiệm miễn dịch truyền thống, cảm biến miễn dịch đơn giản và thuận tiện, có thể thực hiện phát hiện tại chỗ, thời gian thực và tự động. Hơn nữa, với sự xuất hiện của công nghệ nano, nhũng chân trời mới cho sự phát triển của các cảm biến miễn dịch siêu nhạy và siêu trưởng thành đang xuất hiện. Những đặc điểm này có thể đáp ứng các yêu cầu của xét nghiệm tại điếm chăm sóc và mang lại các xét nghiệm chẩn đoán phân tử cho các hệ thống chăm sóc sức khỏe cộng đông và các quàn thể chưa được phục vụ. Trong chương này, chúng tôi giới thiệu ngắn gọn nguyên tắc chính của xét nghiệm miễn dịch trong chẩn đoán tiêu chuẩn. Giới thiệu về một số kĩ thuật xét nghiệm miễn dịch thường được sử dụng trên lâm sàng, để cung cẩp những kiến thức cơ bản và phần nào đó ứng dụng trực tiếp vào những công việc về sau.
2 Kháng nguyên, kháng thể và nguyên lý phản ứng miễn dịch
Xét nghiệm miễn dịch sử dụng kháng thế (kháng nguyên) hoặc thuốc thừ liên quan đến kháng thê’ để xác định chất phân tích mẫu bằng các phản ứng miễn dịch cụ thể giữa kháng thể và kháng nguyên. Kháng thể thường được tạo ra trong cơ thế nhờ khả năng tạo ra hiệu ứng sinh học của sinh vật, gọi là phàn ứng miền dịch. Khi một chất lạ xâm nhập vào cơ thê’ của một động vật cao cấp, phản ứng miễn dịch dẫn đến việc tổng hợp một loại protein nhất định đê’ xác định tác nhân xâm nhập và ngăn chặn tác hại của nó. Protein này được định nghĩa là kháng thể đối với chất lạ. Kháng thê’ cho thấy độ đặc hiệu rất cao và hằng số liên kết đối với kháng nguyên tương ứng của nó. Kháng nguyên đã được định nghĩa là "bất kỳ tác nhân nào làm phát sinh sự hình thành kháng thê đặc hiệu cho tác nhân này khi được chuyến vào hệ thống tế bào sống có chứa các tế bào thuộc loại có thẩm quyền về mặt miễn dịch." Các kháng nguyên tự nhiên có thê’ là các chất đại phân tử như proteỉn và acid nucleic. Các haptens được định nghĩa là một số chất có trọng lượng phân từ thẩp thường nhỏ hơn 1000 Da, chứa các vị trí hoặc chức năng cụ thế mà các kháng thể hướng đến. Trái ngược với kháng nguyên, haptens không thế trực tiếp kích hoạt hệ thống miễn dịch của động vật đế tạo ra kháng thế trừ khi chúng kết hợp với chất mang protein như Albumin huyết thanh bò và ovalbumin. Các kháng thế được tống hợp bởi các tế bào huyết tương (ví dụ, tế bào lympho B trưởng thành) ở động vật đế phản ứng với sự hiện diện của một chất lạ. Có năm loại globulin miễn dịch khác nhau (G, A, M, D và E), khác nhau ở các vùng không đổi của chuỗi nặng cung cấp cho chúng các chức năng tác động khác nhau. IgM và IgG là các kháng thể đàu tiên và thứ hai được tạo ra để phản ưng với một chất không phải là chính mình xâm nhập. IgA bảo vệ màng nhầy và IgE bảo vệ chống lại ký sinh trùng. Tuy nhiên, chức năng chính của IgD vẫn chưa được biết rõ. Trong số năm loại kháng thể, IgG là loại được sử dụng thường xuyên nhất để xét nghiệm miễn dịch vì nó tôn tại ở mức cao nhất và luôn sẵn có.
.jpg)
Nói chung, cấu trúc của IgG được biểu diễn bằng hình chữ Y bao gồm hai chuỗi nặng và hai chuỗi nhẹ, mổi chuỗi chứa một số miền, được giữ với nhau bằng liên kết disulfide. Hai đoạn kết thúc kép của Y được ký hiệu là đoạn Fab và là vị trí tại đó kháng thể liên kết với kháng nguyên. Các vùng thay đổi và siêu biến của Fab tạo ra một phần hoạt động nhận biết một vùng cụ thể của kháng nguyên. Đoạn số ít ở đầu kia của hình dạng Y được gọi là đoạn Fc, không thể liên kết với kháng nguyên nhưng có khả năng bám vào bề mặt tế bào và đi qua nhau thai. Nguyên tắc của sự tương tác giữa kháng nguyên với kháng thể nằm trong sự kết hợp cụ thể của yếu tố quyết định kháng nguyên với đoạn Fab của kháng thể. Liên kết đặc hiệu giữa kháng
nguyên và kháng thể là tập hợp các lực không hóa trị bao gồm lực tĩnh điện, lực hút nước, liên kễt hydro và tương tác Van der Waals. Tương tác giữa kháng nguyên và kháng thê khá mạnh, được chỉ ra bời hằng số liên kết lớn 105 - 1012 M. Do đó, phức hợp của kháng nguyên kháng thể không phân ly dễ dàng trừ khi một số dung dịch khắc nghiệt như dung dịch đệm ở pH cao hơn 10 hoặc thấp hơn 3, dung môi hữu cơ và dung dịch muối ở nồng độ cao được sử dụng để tạo ra quá trình phân ly.
3 Phân loại xét nghiệm miễn dịch
Kê từ khi công cụ xét nghiệm miễn dịch được đề xuất vào năm 1959, khi Berson và Yalow lần đầu tiên mô tả phương pháp xét nghiệm miễn dịch phóng xạ (RIA-Radioimmunology) trong phân tích nồng độ Insulin, xét nghiệm miễn dịch đã được điều chỉnh theo nhiều định dạng phù hợp với các ứng dụng và quy trình thử nghiệm cụ thể. Trong một số định dạng, được định nghĩa là xét nghiệm miễn dịch đồng nhất, các chiến lược xét nghiệm không yêu cầu tách các đơn vị miễn dịch khỏi thuốc thử miễn dịch không liên kết. Cách tiếp cận này bao gồm ngưng kết, điện di mao quản, phân cực huỳnh quang, và các xét nghiệm miễn dịch dựa trên truyền năng lượng cộng hưởng huỳnh quang. Các định dạng khác được mô tả là xét nghiệm miễn dịch không đồng nhất yêu cầu sự tách biệt ban đầu của các đơn vị miễn dịch khỏi các thuốc thử miễn dịch không liên kết. Trong các xét nghiệm miễn dịch không đông nhất, các đơn chất miễn dịch được liên kết với một chất nền rắn, cho phép giữ lại các phân tử quan tâm, trong khi các phân tử không liên kết bị rửa trôi ra khỏi hệ thống. Mặc dù các xét nghiệm không đồng nhất đòi hỏi thời gian chạy lâu hơn và các thao tác phức tạp hơn, nhưng chúng linh hoạt, nhạy và đặc hiệu hơn các xét nghiệm đông nhất. Hầu hết các công việc hiện tại liên quan đến xét nghiệm miễn dịch được thực hiện ở định dạng không đồng nhất.
3.1 Phương pháp miễn dịch phóng xạ (Radioimmunoassay)
RIA sử dụng thuốc thử kết hợp đồng vị phóng xạ làm chất đánh dấu để theo dõi sự phân bố của kháng nguyên tự do và liên kết trong RIA hoặc kháng thể tự do và liên kết trong các xét nghiệm đo miễn dịch, về khả năng, RIA có thể áp dụng để đo hầu hết mọi chất có trong môi trường sinh học, trong phạm vi từ 10‘6 đến 10'14 mol/1. Độ chính xác cao được tìm thấy trong xét nghiệm miễn dịch gắn nhãn phóng xạ có liên quan đến nền phóng xạ không đáng kể trong các mẫu sinh học. Ngoài ra, quá trình phân rã của đồng vị phóng xạ không bị ảnh hưởng bởi các yếu tố môi trường sinh học, chẳng hạn như độ pH, cường độ ion và chất ức chế có thể ảnh hưởng đến việc phát hiện trong các phương pháp đó phụ thuộc vào phép đo quang học hoặc hoạt động của enzym. Mặc dù RIA là đáng tin cậy và chính xác, nhưng nó có nguy cơ gây hại cho sức khỏe và thời gian bán hủy ngắn liên quan đến đồng vị phóng xạ, điều này hạn chế việc sử dụng công nghệ này.
3.2 Phương pháp miễn dịch huỳnh quang (Fluoroimmunoassay)
Phương pháp xét nghiệm miễn dịch huỳnh quang (FIA) sử dụng nhãn huỳnh quang đế phát hiện chất phân tích. Giới hạn phát hiện đối với phương pháp này có xu hướng cao do các vấn đề về huỳnh quang nền và dập tat. Các vấn đề này hạn chế
độ nhạy của phương pháp sử dụng đầu dò huỳnh quang thông thường, đã được khắc phục bằng cách sử dụng huỳnh quang phân giải theo thời gian (Time-resolved fluoroimmunoassay-TRFIA) đã cho phép phát triển các xét nghiệm với giới hạn phát hiện thấp hơn nhiều. Nguyên tắc huynh quang phân giải theo thời gian tận dụng sự phân rã nhanh hơn cua huỳnh quang nen sau khi được kích thích, và do đó phép đo được thực hiện sau khi huynh quang nền đã phân rã đến mức không đáng kể, trong khi huỳnh quang của đầu dò vẫn cao đáng kể.
3.3 Phương pháp hấp thụ miễn dịch liên kết enzyme (Enzyme-Linked Immunosorbent Assay)
Xét nghiệm hấp thụ miễn dịch liên kết với enzym (ELISA) là một trong những loại xét nghiệm miễn dịch được sử dụng rộng rãi nhất và an toàn hơn và dễ dàng hơn so với RIA. ELISA liên quan đến viẹc sử dụng hoạt tính của enzym như một phương tiện phát hiện sự gắn kết của liên hợp kháng thể-enzym. Các enzym đặc hiệu trong cả phản ứng mà chúng xúc tác và cơ chất mà chúng nhận ra và chịu sự điều chỉnh hoạt động bởi các phân tử khác. Do đó, việc sử dụng enzym có thể có lợi do tính đặc hiệu của enzym và các hiện tượng khuếch đại do xúc tác enzym. ELISA khác nhau ở hình thức phát hiện, thường là đo quang phổ khi nhãn enzyme tạo ra sản phẩm có màu, hoặc điện hóa khi enzyme xúc tác phản ứng hóa học oxy hóa khử. Nhược điểm chính của ELISA là sự phụ thuộc của hoạt tính enzyme vào môi trường vật lý và hóa học.
3.4 Phương pháp miễn dịch hóa phát quang (Chemiluminescent immunoassay)
Hóa phát quang (CL) mô tả sự phát ra ánh sáng xảy ra do một số phản ứng hóa học nhất định tạo ra một lượng lớn năng lượng bị mất dưới dạng photon khi các phân tử sản phẩm bị kích thích điện tử giãn ra về trạng thái cơ bản ổn định của chúng. Bởi vì CL không liên quan đến sự hấp thụ ban đầu của ánh sáng, các phép đo phát xạ CL được thực hiện trên nền thấp hơn, do đó cho phép phát hiện độ nhạy cao hơn. Do ưu điểm không có chất thải phóng xạ, yêu càu thiết bị tương đối đơn giản, giới hạn phát hiện rất thấp và dải động rộng, phương pháp phát quang hóa học đã được áp dụng rộng rãi trong phân tích lâm sàng. Nhìn chung, hai kỹ thuật phân tích phát quang hóa học chính được sử dụng trong lâm sàng phân tích: (i) nhãn luminol hoặc acridinium ester, v.v. được sử dụng trong xét nghiệm miễn dịch phát quang hóa học (CLIA); (2) kỹ thuật phát hiện hóa chất phát quang bằng cách sử dụng horseradish Peroxidase (HRP) hoặc phosphatase kiềm (ALP) làm nhãn cho xét nghiệm miễn dịch enzym. Kỹ thuật đầu tiên phát hiện trực tiếp tia sáng của thuốc thử phát quang để xác định chất phân tích. Trong phương pháp thứ hai, cơ chất phát quang hóa học trải qua quá trình oxy hóa xúc tác peroxidase với sự có mặt của chất oxy hóa thích hợp, và giới hạn phát hiện đối với nhãn enzyme có thể giảm xuống phạm vi yếu tố bằng cách phát hiện hóa chất phát quang.
3.5 Phương pháp miễn dịch điện hóa phát quang (Electrochemiluminescence Immunoassay)
Xét nghiệm miễn dịch điện hóa phát quang (ECLIA) là một phương pháp định lượng để đo kháng nguyên hoặc kháng thê dựa trên sự thay đổi tín hiệu điện hóa phát quang (ECL) trước và sau phản ứng miễn dịch. ECL là quá trình theo đó các sản phẩm được tạo ra tại điện cực trải qua phản ứng chuyển điện tử năng lượng cao đê’ tạo thành các trạng thái kích thích phát ra ánh sáng. Tương tự như CL, ECL không yêu cầu sử dụng nguồn sáng bên ngoài. Mặc dù ECL là một dạng CL, nhưng nó có một số ưu điểm hơn CL. Đầu tiên, trong ECL, phản ứng điện hóa cho phép kiếm soát thời gian và vị trí của phản ứng phát sáng. Bằng cách kiểm soát thời gian, sự phát xạ ánh sáng có thể bị trì hoãn cho đến khỉ xảy ra các sự kiện như phản ứng miễn dịch hoặc phản ứng xúc tác bởi enzyme. Kiểm soát vị trí có thể được sử dụng để giới hạn phát xạ ánh sáng đến một khu vực được định vị chính xác đối với máy dò, cải thiện độ nhạy bằng cách tăng tỷ lệ tín hiệu trên nhiễu. Ngoài ra, điều khiển vị trí phát xạ có thể được sử dụng để xác định kết quả của nhiều hơn một phản ứng phân tích trong cùng một mẫu bằng cách thẩm vấn từng điện cực trong một mảng, theo trình tự hoặc đồng thời bằng cách sử dụng máy dò vị trí nhạy cảm, Thứ hai, ECL có thể chọn lọc hơn CL vì việc tạo ra các trạng thái kích thích trong ECL có thể được kiểm soát một cách chọn lọc bằng cách thay đổi các thế điện cực. Thứ ba, ECL có thể nhạy hơn CL vì một số chất phản ứng có thể được tái tạo điện hóa ở điện cực và dẫn đến quá trình khuếch đại chu kỳ oxy hóa khử. Thứ tư, tín hiệu dòng điện và tín hiệu ánh sáng được thu đồng thời, tạo điều kiện thuận lợi cho việc khảo sát cơ chế phát xạ ánh sáng bằng phương pháp điện hóa, khảo sát phản ứng điện hóa bằng ECL, cũng như phát hiện đồng thời ECL và điện hóa.Tuy nhiên, yêu cầu đối với các kỹ thuật điện hóa trong ECL, chẳng hạn như thiết lập điện hóa và làm mới bề mặt điện cực, dẫn đến một số hạn chế cho các ứng dụng phân tích.
A. Phương pháp Elisa
4 Tổng quan về phương pháp Elisa
4.1 Định nghĩa về phương pháp
Enzyme-linked immunosorbent assay (ELISA), còn được gọi là enzyme immunoassay (EIA), là một kỹ thuật sinh hóa sử dụng để phát hiện sự hiện diện
của một kháng thể hoặc kháng nguyên trong một mẫu. Theo thuật ngữ đơn giản, trong kỹ thuật ELISA, một lượng của kháng nguyên được gắn với một bề mặt, và sau đó là một kháng thể đặc hiệu được cho vào để nó có thế liên kết với các kháng nguyên. Kháng thể này sẽ liên kết với enzyme, và cuối cùng thêm cơ chất để enzyme phân giải cơ chất và phát ra những tín hiệu, phổ biến nhất là sự đổi màu một chất hóa học...
4.2 Lịch sử phát triển phương pháp
Tiền thân của ELISA là kỹ thuật miễn dịch học phóng xạ (Radioimmunoassay - RIA), được phát triển bời Rosalyn Sussman Yalow và Solomon Aaron Berson (xuất bản lần đầu tiên năm 1960; Nobel y học cho Rosalyn s. Yalow năm 1977). Mặc dù phương pháp này có độ nhạy và độ đặc hiệu rất cao, tuy nhiên việc sử dụng phóng xạ cho việc phát hiện yêu cầu kỹ thuật cao, phức tạp, tốn kém, đặc biệt việc sử dụng phải vô cùng cẩn thận vì khả năng gây nguy hiểm của phóng xạ đã dẫn đến việc đặt ra yêu càu tìm kiếm các phương pháp cải tiến thay thế. Để thay cho việc sử dụng chất đánh dấu phóng xạ, người ta đã sử dụng kỹ thuật liên kết kháng nguyên hoặc kháng thê với một enzyme (enzyme-linked) có khả năng thực hiện một phản ứng nhận biết (ví dụ như gây đổi màu một chất).
Trong suốt quá trình phát triển của xét nghiệm miễn dịch, ý tưởng sử dụng enzyme gắn nhãn đã vấp phải nhiều sự hoài nghi. Người ta cho rằng các enzym quá lớn để các phân tử sinh học được sử dụng làm nhãn và sự hiện diện của chúng rất có thể sẽ gây ra cản trở không gian phản ứng. Những lo ngại như vậy đã được giải quyết bằng cách lập kế hoạch và thực hiện các thí nghiệm cẩn thận, chứng tỏ tính khả thi của các enzym gắn nhãn. Sự thành công của các xét nghiệm miễn dịch liên kết với enzym trong giai đoạn đầu đã chứng minh những người hoài nghi đã sai và mở đường cho sự tiến bộ hơn nữa của các xét nghiệm miễn dịch.
Giữa năm 1966 và 1969, Avrameas và cộng sự, đã báo cáo sự kết hợp kháng nguyên-kháng thể thành công bằng cách sử dụng các enzym như phosphatase kiềm, và Glucose oxidase trong số các enzym khác. Avrameas và các đồng nghiệp đã tối ưu hóa quy trình gắn nhãn và quá trình ghép nối tiếp theo thông qua phân tử glutaraldehyde. Các phân tử sinh học được đánh dấu bằng enzym (kháng nguyên hoặc kháng thể) được sử dụng để phát hiện phân tử sinh học thông qua miễn dịch huỳnh quang. Xét nghiệm miễn dịch Enzyme (EIA) được phát triển tại Phòng thí nghiệm Nghiên cứu Organon ở Hà Lan bởi Anton Schuurs và Bauke van Weemen.
Thử nghiệm hấp thụ miễn dịch liên kết với enzyme (ELISA) được lên ý tưởng tại Đại học Stockholm, Thụy Điển, bởi Peter Perlmann và Eva Engvall vào năm 1971. Thử nghiệm ELISA đầu tiên đã chứng minh phép đo định lượng kháng thể thỏ với enzyme gắn nhãn phosphatase kiềm. ELISA đã trở nên thành công hơn EIA ở khía cạnh thương mại hóa.
Tác động của EIA và ELISA đối với xét nghiệm miễn dịch chẩn đoán và hệ thống chăm SOC sức khỏe hầu như không vượt trội. Số lượng các cuộc điều tra phân tích và lâm sàng được thực hiện trên toàn thế giới dựa trên kiến thức về EIA và
ELISA là thiên văn và số lượng các phép đo sử dụng các xét nghiệm miễn dịch này để chăm sóc bệnh nhân thông thường là cực kỳ lớn. Trên thế giới hầu như không có phòng xét nghiệm chẩn đoán nào không gặp đĩa đệm EL1SA.
1976 - Phương pháp ELISA cạnh tranh , trong đó cơ chất liên hợp cạnh tranh với protein quan tâm, được phát triển và sử dụng đề phát hiện hormone choriogonadotropỉn của người
1978 - ELISA gián tiếp, trong đỏ một kháng thề thử cắp được thêm vào cho mục đích phát hiện, được phát triền và sử dụng để phát hiện albumin huyết thanh người
.jpg)
4.3 Nguyên lý phương pháp
Phương pháp ELISA dựa trên cơ sở phản ứng miễn dịch đặc hiệu kháng nguyên-kháng thể tương tự như phản ứng miễn dịch xảy ra trong cơ thế-phản ứng đóng vai trò quan trọng trong việc bảo vệ cơ thể khỏi các tác nhân như mầm bênh hay độc tố. Bằng cách khai thác phản ứng này, ELISA cho phép phân tích định lượng/định tính có độ nhạy cao và chọn lọc với các kháng nguyên bao gồm protein, peptid, acid nucleic, hormone, các chất chuyển hóa... Để phát hiện được các phân tử này, một kháng nguyên hoặc kháng thề được đánh dấu bằng cách sử dụng
enzyme, trong đó phosphatase kiềm (ALP), horseradish peroxidase (HRP), p. galactosidase thường được sử dụng. Kháng nguyên trong pha lỏng được cố định trên pha rắn bằng phương pháp hóa lý hoặc phản ứng kết hợp kháng nguyên- kháng thể, sau đó kháng nguyên được phản ứng với kháng thế cụ thế và được phát hiện bằng kháng thể thứ cấp được đánh dấu bằng enzyme - enzyme này xúc tác cho phản ứng sinh màu hoặc huỳnh quang sau khi được bổ sung cơ chất thích hợp được pháp hiện bằng việc sử dụng phương pháp quang phổ.
4.4 Các biến thể của ELISA
Mặc dù nguyên tắc của ELISA khá đơn giản, nhưng qua quá trình thực nghiệm sử dụng đã gặp các vấn đề tồn tại: từ các vấn đề về độ nhạy, độ đặc hiệu, giới hạn phát hiện cho đến những vấn đề về tính hiệu quả của phương pháp như thời gian thực hiện, độ phức tạp, chi phí cũng như khả năng hệ thống hóa thành bộ dụng cụ (KIT) đê sản xuất công nghiệp. Chính vì vậy, người ta đã không ngừng cải tiến phương pháp này, đưa ra nhiều phương pháp mới phù hợp với từng điều kiện, từng đối tượng khác nhau. Cho đến nay, đã có rất nhiều biến thể đa dạng của ELISA. Tuy nhiên nhìn chung, tất cả các biến thê này có thê được phân loại như sau:
- ELISA dị pha (Heterogeneous ELISA), hay còn gọi là ELISA pha rắn (solid phase), gồm các phương pháp:
+ ELISA trực tiếp (direct ELISA).
+ ELISA gián tiếp (indirect ELISA).
+ ELISA sandwich.
+ ELISA cạnh tranh (competitive ELISA).
- ELISA đồng pha (Homogeneous ELISA), gồm các phương pháp ELISA dồng pha cạnh tranh (competitive) và không cạnh tranh (non-competitive).
4.4.1 ELISA dị pha
Trong ELISA dị pha, các yếu tố cần chẩn đoán được tách ra khỏi hỗn hợp dung dịch mẫu bằng cách cố định lên một bề mặt rắn (có thể là nhựa, thủy tinh, giấy, màng nitrocellulose, agarose, polyacrylamide gel hay thậm chí vi khuẩn được cố định) tạo thành hai pha cố định và tự do, theo sau là môt bước loại bỏ pha tự do. Yếu tố phát hiện được thêm vào sau đó để phát hiện sự hiện diện của yếu tố cần chẩn đoán còn lại trên pha cố định thông qua hoạt tính của enzyme.
4.4.1.1 ELISA trực tiếp
Phương pháp này ít được sử dụng trong ELISA định lượng mà thường được sử dụng cho ELISA định tính. Yếu tố càn chẩn đoán (ví dụ như kháng nguyên) được cố định trực tiếp lên một bề mặt rắn và sau đó được xác định sự hiện diện bằng yếu tố phát hiện (kháng thể đánh dấu).
.jpg)
Phương pháp này có ưu điểm là chỉ cần một lần ủ do đó tiết kiệm thời gian và tối thiểu được việc kiểm soát các điều kiện trong quá trình thực hiện (thay đổi nhiệt độ và buffer cho mỗi lần ủ, tính thời gian...). Tuy nhiên, nhược điếm của nó là nhuộm màu nền (background staining) cao do sự liên kết không đặc hiệu của kháng thê với bề mặt rắn và các protein cố định trên bề mặt rắn. Việc đánh dáu từng loại kháng thế sử dụng cho mỗi kháng nguyên cũng khá tốn kém, nhất là khi phải chẩn đoán một số lượng lớn các loại kháng nguyên khác nhau. Ngoài ra, phương pháp này cũng có giới hạn phát hiện cao, và cần một lượng lớn các yếu tổ cần chẩn đoán do sự liên kết kém hiệu quả của yếu tố này lên bề mặt rắn cũng như sự cạnh tranh của các protein khác trong quá trình phản ứng miễn dịch.
Các bước thực hiện ELISA trực tiếp
1. Cho kháng nguyên mẫu cần phân tích vào đĩa ELISA ủ để cổ định kháng nguyên vào đĩa, sau đó rửa loại bỏ thành phần không liên kết
2. Dung dịch Blocking buffer thêm vào ủ và rửa bằng dung dịch rửa.
3. Thêm kháng thể gắn enzyme ủ và rửa.
4. Thêm cơ chất ủ và rửa.
5. Phân tích kết quả.
4.4.1.2 ELISA gián tíếp
Phương pháp ELISA gián tiếp tương tự như ELISA trực tiếp, nhưng sử dụng hai lớp yếu tố phát hiện, và chỉ có lớp yếu tố phát hiện cuối cùng mới mang enzyme. Ưu điểm của phương pháp này là chỉ cần tạo một loại kháng kháng thế mang enzyme đế nhận biết cho nhiều kháng nguyên khác nhau. Kháng thể sơ cấp cũng là những protein, và cũng mang những epitope của riêng nó. Nếu nhiều loại kháng thể khác nhau được sản xuất từ cùng một loài sinh vật, tất cả các loại kháng thể này đều mang những epitope chung đặc trưng cho loài đó. Việc sản xuất một kháng kháng thể có khả năng liên kết với epitope đó là hoàn toàn có thể, thông qua việc tiêm các kháng thể trên vào một loài sinh vật khác. Phương pháp này cũng cho giới hạn phát hiện thấp hơn khoảng 10 lần so với ELISA trực tiếp, do khả năng liên kết nhiều kháng kháng thể lên một phân tủ’ kháng thế sơ cấp, làm tăng số lượng enzyme được cố định.
.jpg)
Tuy nhiên, nhược điểm của nó là tăng số bước thực hiện do đó làm tăng việc kiểm soát các điều kiện quá trình và kéo dài thời gian chẩn đoán. Nhằm tăng khả năng phát hiện, người ta có thể sử dụng kỹ thuật bắc cầu (brigde) bổ trợ cho ELISA gián tiếp. Về nguyên tắc, kỹ thuật bắc cầu cũng tương tự như ELISA gián tiếp, nhưng ở đây sử dụng nhiều lớp yếu tố phát hiện hơn (trên hai lóp). Qua mỗi lớp yếu tố phát hiện, tín hiệu lại được khuếch đại lên vài lằn. Tuy nhiên cần lưu ý là càng nhiều lớp yếu tố phát hiện, số bước thực hiện càng nhiều và sẽ kéo dài thời gian, tăng thêm việc kiểm soát điều kiện cho từng quá trình, cũng như tãng khả năng liên kết chéo giữa các yếu tố phát hiện với nhau.
Các bước thực hiện ELISA gián tiếp tương tự trực tiếp tuy nhiên thêm 1 bước gắn và ủ rửa kháng thể sơ cấp.
4.4.1.3 ELISA sandwich
Tương tự như ELISA trực tiếp và gián tiếp, trong phương pháp này yếu tố cằn chẩn đoán cũng được cố định lên bề mặt rắn. Tuy nhiên việc cố định này không được thực hiện trực tiếp mà thông qua liên kết miễn dịch với một yếu tố phát hiện (thường là kháng thể) đã được gắn cố định sẵn trên bề mặt rắn.
Sau khi bắt giữ yếu tố càn chẩn đoán, lúc này phương pháp quay lại tương tự như ELISA trực tiếp hoặc gián tiếp sau khi đã cố định yếu tố cần chẩn đoán. Người ta có thể sử dụng một kháng thể liên kết enzyme để xác định trực tiếp yếu tố trên (như ELISA trực tiếp), hoặc cũng có thể dùng một trong số các phương pháp brigde của ELISA gián tiếp. Bên cạnh kháng thể người ta cũng có thể cố định một số yếu tố khác lên mặt rắn như Clq, receptor, lectin...
Phương pháp này có khá nhiều ưu điểm vượt trội, thứ nhất là giảm được hiện tương nhuôm màu nền và các phản ứng không đặc hiệu do đã loại bỏ được hầu hết
các thành phần tạp, phản ứng được thực hiện dế dàng hơn, kháng thế sơ cấp có thế được gắn sẵn trên bề mặt rắn tạo thành các bộ KÍT và có thế thực hiện các chẩn đoán mà trong đó kháng nguyên không thể gắn được lên mặt rắn. Bên cạnh đó nó cũng có những nhược điểm riêng, quan trọng nhất là làm tăng phản ứng chéo do liên kết không đặc hiệu giữa các lớp yếu tố phát hiện thứ cấp với kháng thế sơ cấp. Nhược điếm này đã được nghiên cứu khắc phục bằng cách chỉ cố định phãn đoạn nhánh (Fab) của kháng thể.
.jpg)
Các bước của ELISA sandwich tương tự ELISA trực tiếp trực tiếp/gián tiếp tuy nhiên trong ELISA sandwich yến tố bắt giữ kháng nguyên là kháng thế nên bước đầu tiên của phương pháp là gắn kháng thể lên đĩa ELISA. Các bước tiếp theo tương tự ELISA gián tiếp và trực tiếp.
4.4.1.4 ELISA cạnh tranh
.jpg)
ELISA cạnh tranh là phương pháp ELISA rất hiệu quả cho định lượng các yếu tố hiện diện trong mẫu với lượng nhỏ. EL1SA cạnh tranh sử dụng một lượng kháng nguyên cùng loại với kháng nguyên muốn định lượng trong mẫu (kháng nguyên cạnh tranh) cho phản ứng miễn dịch với cùng một loại kháng thế đặc hiệu cố định trên mặt rắn, sau đó đo lượng kháng nguyên cạnh tranh này thông qua hoạt tính enzyme được liên kết với nó. Kháng nguyên cạnh tranh càng hiện diện nhiều cho biết loại kháng nguyên đó trong mẫu càng ít và ngược lại. Có ba biến thể chính của phương pháp này:
- Phương pháp bão hòa cân bằng tương đối (quasi-equilibrium saturation)-. Trong phương pháp này kháng nguyên mẫu (Ag - Antigen) và kháng nguyên cạnh tranh (Age - Antigen competitive) được cho phản ứng cùng lúc với một kháng thể được cố định. Hai loại kháng nguyên sẽ phản ứng miễn dịch với kháng thể (Ab - anti body) theo một tỉ lệ tương ứng với tỉ lệ nồng độ giữa hai loại kháng nguyên, từ đó có thể xác định được nồng độ Ag khi đo tỉ lệ Agc còn lại sau phản ứng với lượng Agc sử dụng ban đằu. Cần lưu ý là lượng kháng nguyên cạnh tranh phải được biết trước và phải dư để có thể bão hòa hết lượng kháng thể.
- Phương pháp bão hòa thứ tự (sequential saturation):
Phương pháp này thường được sử dụng hơn bão hòa cân bằng tương đối. Khác với phương pháp trên, với bão hòa thứ tự kháng nguyên mẫu được cho phản ứng trước. Sau đó, một lượng dư kháng nguyên cạnh tranh được thêm vào để bão hòa lượng kháng thể còn trống. Hoạt tính enzyme đo được sẽ cho biết lượng Agc phản ứng với kháng thể còn trống, từ đó tính được lượng Ag đã chiếm chỗ kháng thể. Trong phương pháp này, lượng Age ban đầu không cần phải biết trước, tuy nhiên vẫn cần phải dư để bão hòa lượng kháng thể còn lại.
- Phương pháp ức chế kháng thể (antibodies inhibition):
Thay vì cố định kháng thể lên mặt rắn, người ta cũng có thể cố định kháng nguyên cạnh tranh. Đầu tiên, người ta sẽ cho kháng nguyên mẫu phản ứng với một lượng kháng thể biết trước. Sau đó, lượng kháng thể còn lại chưa phản ứng sẽ được phản ứng với kháng nguyên cạnh tranh, và được cố định lại. Sau bước rửa lượng kháng thể còn cố định lại được đo và suy ra lượng kháng thể đã phản ứng với kháng nguyên mẫu. Bên cạnh việc định lượng kháng nguyên, phương pháp này còn có thể sử dụng để so sánh các kháng nguyên với nhau.
4.4.2 ELISA đồng pha
Phương pháp này thường được sử dụng để định lượng các phân tử nhỏ. Khác với RIA và ELISA dị pha, phương pháp này không cần bước tách biệt các yếu tố gắn kết và tự do, vì nó dựa trên sự thay đổi hoạt tính của enzyme thông qua phản ứng liên kết miễn dịch. Ưu điểm lớn của phương pháp này là giảm được mức độ phức tạp của phản ứng trong việc cố định các yếu tố lên bề mặt rắn, thời gian thực hiện rất nhanh cũng như giảm được lượng kháng thể cần dùng vì không phải tráng một bề mặt rắn lớn. Tuy nhiên nó có nhược điểm là hầu hết các phương pháp làm thay đổi hoạt tính enzyme cho đến nay đều dựa trên sự thay đổi về cấu trúc không gian của các yếu tố gắn kết với enzyme. Hướng đi này cần có những thiết kế chính xác về cấu trúc không gian của các thành phần, một yêu cầu khá phức tạp, tốn kém, hầu hết chỉ có thế áp dụng được với các kháng nguyên nhỏ và gây rất nhiều h?nvché trong việc sản xuất các thành phần của một phản ứng ELISA. Đây cũng là yếu tố chính đa giới hạn rất lớn kỷ thuật ELISA đồng pha. Ngoài ra, kết quả có thế bị ảnh hưởng bơi một số yếu tố khác trong mẫu có khả năng làm biến đối hoạt tính enzyme.
5 Ứng dụng của phương pháp Elisa
Phương pháp ELISA được ứng dụng trong nhiều xét nghiệm chân đoan. Mọt sổ xét nghiệm có thể kể đến như:
5.1 Phát hiện và đo lường sự hiện diện của kháng thê trong máu
- Các tự kháng thể (anti-dsDNA, anti-dsgl, ANA,...).
- Các kháng thể chống lại bệnh truyền nhiễm (vi khuẩn, virus, nấm).
5.2 Phát hiện và ước tính các dấu ấn ung thư
- Kháng nguyên đặc hiệu của tuyến tiền liệt (PSA).
- Carcinoembryonic Antigen (CEA).
5.3 Phát hiện và định lượng nồng độ hormone trong máu
- LH (Luteinizing hormone).
- FSH (Follicular stimulating hormone).
- Prolactin.
- Testosterone.
- hCG (Human Chorionic gonadotropin).
5.4 Phát hiện sự hiện diện của virus trong mẫu bệnh phẩm
- Cholera.
- HIV.
- Influenza.
5.5 Phát hiện lạm dụng ma túy
- Amphetamine.
- Methamphetamine.
- 3,4-methylenedioxymethamphetamine.
- Cocaine.
- Benzoylecgonine.
6 Cấu trúc cơ bản của hệ thống máy
Hệ thống máy ELISA hiện nay được phân chia ra làm 2 nhóm:
- Hệ thống bao gồm các máy đơn lẻ hoạt động theo từng bước từng giai đoạn của quá trình thực hiện phản ứng EL1SA: máy ủ, máy rửa, máy đọc.
- Hệ thống tích gộp các modun trong cùng một máy.
6.1 Hệ thống máy đơn lẻ
Cấu trúc cơ bản của hệ thống này bao gồm các thành phần: đĩa EL1SA pha rắn, hóa chất, máy ủ, máy rửa, máy đọc.
6.1.1 Đĩa ELISA pha rắn
6.1.2
.jpg)
Đĩa ELISA 96 giếng được sử dụng nhiều nhất trong ELISA thường là polystyrene hoặc các dẫn xuất của polystyrene thu được bằng cách biến đổi hóa học hoặc chiếu xạ bề mặt. Phổ biến nhất là đĩa 96 giếng được cấu trúc gôm 8 hàng và 12 cột. Mỗi giếng có thể tích khoảng 350 pl với một khu vực bên trong có diện tích khoảng 2,5 cm2. Gần đây hơn, đĩa 384 giếng và 1536 giếng đã được phát triển với kích thước tổng thể giống như truyền thống 96 giếng. Chúng được sử dụng trong việc thực hiện phân tích với số lượng mẫu lớn. Ngoài ra, cũng có đĩa 96 giếng với giếng bằng một nửa thể tích giếng truyền thống. Phân tích được thực hiện trong các giếng với thể tích bằng một nửa giống hệt về hiệu suất với đĩa kích thước truyền thống, nhưng tiết kiệm đáng kể về thành phần phản ứng. Phần đáy của giếng được thiết kế đáy hình lòng chảo giúp cho việc vệ sinh giếng dễ dàng hơn.
Một số vấn đề liên quan đến đĩa EL1SA pha rắn có thể ảnh hưởng đến kết quả phân tích ELISA.
- Vấn đề về chất lượng đĩa ELISA: đĩa ELISA là nơi mà thành phần cần phân tích sẽ bám dính (pha rắn) để các phản ứng tiếp theo có thể xảy ra. Bám dính có thể là trực tiếp hoặc gián tiếp thông qua kháng thể bắt. Dù là bám dính bằng cách nào thì đĩa ELISA cũng là nơi giúp cố định phân tử cần phân tích. Khi có vấn đề với đĩa ELISA: đĩa sử dụng nhiều làn, đĩa hết hạn sử dụng sẽ ảnh hưởng đẽn quá trình gắn làm cho các phân tử phân tích không gắn/giảm gắn sẽ dẫn tới sai số trong kết quả phân tích (giảm nồng độ thực tế), hoặc đĩa bị xước/bề mặt trong trơn nhẵn sẽ dẫn
tới sự bám quá mức của các phân tử sẽ làm tăng tín hiệu đầu ra làm kết quả phân tích cao hơn thực tẽ.
- Một vẩn đè nữa với quy trình thực hiện của hệ thống các modun rời, quá trình phân tích kết quả sẽ được thực hiện thông qua phương pháp đo quang trên chính đĩa ELISA nên nếu đĩa ELISA quá hạn sử dụng bị mờ đục, bám bẩn giảm chất lượng sẽ ảnh hưởng đến cường độ chùm tia ló dẫn đến làm sai lệch kết quả đo.
Một số lưu ý khi sử dụng đĩa ELISA nhằm hạn chế sai kết quả:
- Đưa đĩa ELISA về nhiệt độ phòng trước khi mở.
- Lượng chất lỏng trong giếng nên đồng đều trong cả đĩa, vì một giếng tách ra độc lập sẽ gây khó khăn cho việc đổ bỏ đĩa và dẫn đến rửa kém hơn.
- Đặt đĩa trong bóng tối ngay sau khi thêm cơ chất, vì cơ chất rất nhạy cảm với ánh sáng.
- Giữ chặt đĩa khi xả để tránh đĩa trượt khỏi bệ giữ (holder).
- Xoay đĩa 180° và gắn lại vào bệ/cần sử dụng đúng bệ giữ nếu không phù hợp với đĩa.
- Đóng kín các giếng chưa dùng đến với các chất làm khô.
- Ghi lại ngày lần đầu tiên mở túi chứa đĩa.
- Rửa mật đáy của đĩa với dung dịch đệm rửa để loại bỏ dấu vân tay.
- Chắc chắn rằng các giếng đang ở đúng giai đoạn trong quá trình rửa, bổ sung thuốc thử và đọc đĩa.
- Lau phía dưới các đĩa với vải/khăn trước khi đọc.
- Không được để khô giếng một khi đã bắt đàu thí nghiệm.
6.1.3 Pipet
Có 2 loại pipet thường được sử dụng là pipet đa kênh và pipet đơn kênh. Pipet đơn kênh chia làm 2 dạng: cố định thế tích và điều chỉnh thể tích (1- 20 ml, 10-100 ml, 20- 200 ml...), còn pipet đa kênh thường được dùng là loại 8 đầu tip và 12 đàu tip đế phù hợp với số lượng hàng và cột của đĩa EL1SA. về thao tác có thế chia thành pipet phân phối bán tự động và pipet phân phối hoàn toàn tự động. Đối với hệ thống máy ELISA rời từng modun (ủ, rửa, đọc) các thao tác pha loãng mẫu, thêm hóa chất sẽ được thực hiện bằng các pipet bán tự động. Trên hệ thống tích hợp nhiều modun các quá trình này sẽ được thực hiện tự động hoàn toàn.
.jpg)
Một số vấn đề với pipet có thể ảnh hưởng đến kết quả phân tích ELISA:
- Đối với trường hợp của hệ thống các máy rời sử dụng pipet bán tự động những vấn đề liên quan đến pipet chủ yếu là do người sử dụng. Có thê kể ra một số nguyên nhân như: cài đặt thể tích hút mẫu không đúng, thao tác với pipet chưa thành thạo không đúng kĩ thuật dẫn đến lượng mẫu hút nhiều/ít hơn so với thể tích càn lấy. Pipet không được hiệu chuẩn định kỳ dẫn đến những sai sót trong thể tích hút mẫu.
Phương pháp hạn chế sai số:
- Pipet phải được hiệu chuẩn thường xuyên theo đúng hướng dẫn của nhà sản xuất.
- Tránh chạm đầu tip vào thành giếng.
- Tránh văng vào mẫu và thuốc thử.
- Sử dụng một đầu tip mới khi thêm mẫu/đối chứng/thuốc thử.
- Các đầu tip phải đủ độ dài để cung cấp khoảng không khí giữa đầu tip và pipet
- Đảm bảo đầu tip pipet được gắn chặt vào pipet để tránh làm rơi đầu tip.
6.1.4 Hóa chất ELISA
6.1.4.1 Dung dịch đệm
a. Coating buffer
Coating là bước đầu tiên trong bất kỳ phương pháp EL1SA nào và là quá trình mà một kháng nguyên pha loãng thích hợp hoặc một kháng thể được ủ cho đến khi được hấp thụ vào bề mặt của giếng. Sự hấp phụ xảy ra thụ động như là kết quả của sự tương tác hydro giữa các chuỗi Amino acid trên bề mặt kháng nguyên hoặc kháng thể được sử dụng để phủ và bề mặt Nhựa của giếng. Khả năng gắn phụ thuộc vào thời gian, nhiệt độ, và pH của coating buffer cũng như nông độ của lớp phủ. Các điều kiện ủ điển hình là việc thêm 50-100^1 chất đệm phủ vào kháng nguyên hoặc
kháng thê’ ờ nồng độ 1-10 ng/ml, và ủ qua đêm ở nhiệt độ 4° c hoặc trong 1-3 giờ ờ 37° c (điêu kiện thường được sử dụng trong thực tế) trong quá trình phủ bề mặt độ ẩm cũng là một điều kiện hết sức quan trọng để giảm thiểu sự bốc hơi. Chất liệu được sử dụng có thể đảm bảo rằng tấm có thế được sử dụng lại nhiều lần. Hai dung dịch đệm phủ thường được sử dụng trong thực tế là đệm bicarbonate pH 9,6 và dung dịch PBS (dung dịch muối đệm phosphate).
b. Blocking buffers
Blocking là một bước hết sức quan trọng và cần thiết để ngăn chặn sự gắn không đặc hiệu của các thành phần kháng thể phát hiện (detection antibodies) với bề mặt giếng sau khi bao phủ kháng nguyên kháng thế. Có hai type dung dịch blocking chính là protein và chất tẩy rửa. Protein được coi là chất blocking lâu dài nó được thêm vào sau khi kháng nguyên/kháng thể đã được gắn vào đĩa. Còn các chất tẩy rửa chỉ có tác dụng blocking tạm thời chức năng blocking của nó sẽ biến mất trong các bước rửa sau đó.
Chất blocking lý tưởng là sự phối hợp thỏa mãn hai điều kiện đảm bảo độ nhạy của phản ứng ELISA và chất lượng màu nền tối ưu. Lựa chọn protein không liên quan hoặc một protein không có phản ứng với các thành phần kháng thế tham gia phản ứng ELISA là điểm đầu tiên được đề nghị để tìm chất blocking phù họp. Khi một giếng được blocking hoàn toàn độ nhạy của phàn ứng sẽ được tăng lên do giảm sự gắn không đặc hiệu của các thành phần khác. Blocking buffer cơ bản nhất bao gôm BSA 1% (Albumin huyết tương bò) hoặc là protein sữa hòa tan trong dung dich PBS. Thông thường 150 pl blocking buffer được thêm vào giếng và ủ ở nhiệt độ 370C.
c. Đệm rửa (Washing buffer)
ELISA sử dụng bề mặt liên kết để tách và bước rửa được lặp lại giữa mỗi bước để loại bỏ các thành phần không liên kết. Bước rửa là một phần quan trọng của quy trình và đòi hỏi các giếng phải được đổ đầy dung dịch rửa thường là dung dịch PBS cùng với một nồng độ nhỏ các chất tẩy rửa không ion như Twin-20 (Polysorbate 20- C58H144O26). Bước rửa thường được thực hiên 3-5 lần giữa mỗi bước để loại bỏ triệt để các thành phần không tham gia liên kết. Dung dịch rửa thường được giữ lại một thời gian ngắn trên tấm. Thành phần dung dịch dư thừa phải loại bỏ ờ bước rửa cuối cùng để tránh sự pha loãng dung dịch được thêm vào ở giai đoạn tiếp theo. Điều này có thể thực hiện đơn giản bằng cách úp nhẹ tấm lên bề mặt giấy thấm.
d. Kháng thế
Kháng thê’ sử dụng trong phản ứng ELISA có thê’ đơn dòng hoặc đa dòng hoặc phối hợp cả hai loại. Sự kết hợp kháng nguyên kháng thế được mô tả theo 3 đặc tính: tính đặc hiệu, ái tính, háo tính. Tính đặc hiệu dựa trên phản ứng kết hợp đặc hiệu của paratop và epitop. Ái tính mô tả mức độ, khả năng gắn kết của kháng nguyên kháng thế. Kháng thế ái lực cao là sự lựa chọn tốt nhất cho các loại xét nghiệm miễn dịch trong đó có ELISA vì chúng nhanh chóng tạo ra một lượng lớn phức họp miễn dịch ổn định và do đó cung cấp một độ nhạy cao hơn cho xét nghiệm.
Kháng thê đơn dòng có thê được sử dụng trong tất cả các bước của phương pháp EL1SA. Kháng thể đa dòng thường được kết hợp sử dụng như là một phân tử được dùng để bắt kháng nguyên đê tăng cường tín hiệu, làm tăng khả năng bắt giữ kháng nguyên từ một dung dịch mẫu.
Kháng thê gắn thường được gắn với enzyme HRP {Horseradish peroxidase). Với việc sử dụng cơ chất là TMB (3,3', 5,5'-tetramethylbenzidine). Phản ứng tạo ra phức chất có màu xanh đo ở bước sóng 655nm, phản ứng có thể dùng lại với acid sunfuric tạo ra hổn dịch màu vàng đo ở bước sóng 450nm.
Các vấn đề với hóa chất
- Như đã trình bày khả năng gắn phụ thuộc vào pH của coating buffer khi dung dịch này không được bảo quản đúng hoặc hết hạn sử dụng sẽ làm ảnh hưởng tới bước phủ kháng nguyên lên bề mặt cụ thể là giảm gắn sẽ dẫn đến kết quả phân tích thấp hơn thực tế.
- Với hóa chất Blocking khi xảy ra vấn đề với nó sẽ làm cho các phân tử khác không phải kháng nguyên có thể gắn lên bề mặt phân tích dẫn tới nhieu màu nền làm sai số kết quả đo.
- Dung dịch rửa bị biến tính hay bị nhiễm sẽ làm tăng tín hiệu nền.
- Các kháng thể bản chất là protein nên rất dễ biến tính nếu bảo quản không đúng nhiệt độ, pH phù hợp.
- Các cơ chất dễ biến tính khi tiếp xúc với ánh sáng.
Để khắc phục vấn đề với hóa chất nên kiểm tra kĩ hạn sử dụng trước khi sử dụng. Bảo quản đúng các yêu cầu về nhiệt độ ánh sáng theo khuyến cáo của nhà sản xuất. Ghi ngày mở lên chai hóa chất.
Máy ủ ELISA
.jpg)
Máy ủ ELISA cho phép người sử dụng cài đặt thời gian ủ và nhiệt độ ủ thích hợp tùy theo từng giai đoạn của phản ứng ELISA. Ngoài ra một số hệ thống máy còn kết hợp với xoay trộn đều mẫu trong quá trình ủ để tăng hiệu quả của phản
ứng kết hơp. Để đảm bảo quá trình phản ứng là tối ưu nhất ngoài các thông số về nhiẹt độ và thời gian yếu tố độ ẩm duy trì bên trong buông ủ cũng là một điều kiện quan trọng. Nó ảnh hường đến khả năng hóa chất bị bay hơi.
Một số vấn đề với máy ảnh hưởng đên kết quả đo:
- Nhiệt độ ủ quá thấp/quá cao: nếu nhiệt độ ủ quá thấp sẽ dẫn tới phản ứng kết hợp kháng nguyên kháng thể, kháng nguyên với đĩa ELISA bị giảm sẽ dẫn đến tín hiệu đo được giảm so với thực tế. Nếu ở nhiệt độ cao ở mức vừa phải chưa đủ làm biến tính protein thì tín hiệu thu được sẽ cao hơn so với thực tế, tuy nhiên nếu nhiệt độ quá cao làm biến tính kháng thể thì kết quả phân tích sẽ thay đổi theo chiều ngược lại.
- Thời gian ủ: không đủ thời gian ủ phản ứng xảy ra chưa đạt trạng thái cân bằng khi phân tích kết quả sẽ giảm so với thực tế.
- Độ ẩm thường yêu càu độ ẩm > 85% nhằm mục đích hạn chế sự bay hơi của hóa chất phản ứng.
Để hạn chế sai sót có thể xảy ra cần: cài đặt thời gian, nhiệt độ phù họp với từng giai đoạn của phản ứng.
6.1.5 Hệ thống máy rửa
.jpg)
Mục đích của việc rửa là để tách các thành phần chất phản ứng/huyết thanh gắn với các thành phần không gắn. Điều này liên quan đến việc đổ bỏ các giếng và sau đó là việc bổ sung các chất lỏng vào giếng. Quá trình này được thực hiện ít nhất 3-6 lạn cho mỗi giếng. Chất lỏng dùng đê rửa giếng thường là đệm (PBS) để duy trì tính đẳng trương, vì hàu hết các phản ứng khang nguyên - kháng thể (Ag - Ab) là tối ưu trong điều kiện đó. Nước máy không được khuyến khích sử dụng, vì nước máy khác nhau rất nhiều trong thành phần (pH, nồng độ mol, V.V.). Nhìn chung, các tác động cơ học với chất lỏng trong giếng là đủ để rửa các thuốc thử khỏi giếng. Một số kỹ thuật viên đổ bỏ dịch rửa sau một thời giun ngắn (thời gian ngâm) sau mỗi làn thêm (1 - 5 phút). Đôi khi chất tẩy rửa, đặc biệt là Tween - 20 (0,05%) được thêm vào điều này có thể gây ra sự tạo ra bọt quá mức dẫn đến điều kiện rửa kém, vì không khí bị mắc kẹt và ngăn ngừa dung dịch rửa tiếp xúc với be mặt. Đối với hầu hết các trường hợp, việc bổ sung này không đóng góp đáng kể vào quá trình rửa. Khi sử dụng chất tẩy rửa, phải thực hiện sao cho không ảnh hưởng xấu đến chất phản ứng (biến tính kháng nguyên), và hơn nữa là cần ngăn ngừa bọt trong giếng.
- Rửa bình thường: Trong đĩa rửa thủ công (bằng tay), yếu tố quan trọng nhất là mỗi giếng đều được rửa, do đó, không để bong bóng không khí bị mắc kẹt trong giếng hoặc không được chạm ngón tay lên cạnh của giếng.
- Strip/Máy rửa: Lập trình chu kỳ rửa khác nhau cho từng mẫu, bảo dưỡng cẩn thận là càn thiết, vì chúng dễ bị lỗi máy, chẳng hạn như có một vòi phun đặc biệt bị chặn.
Hệ thống máy rửa ELISA có thể chia thành các loại như sau: có thể rửa một hàng hoặc cột tại một thời điểm, có thể rửa một lúc cả đĩa hoặc rửa một lần nhiều đĩa. Là một hệ thống vi xử lý thực hiện các thao tác rửa được cài đặt chương trình theo yêu cầu của người sử dụng, nó được thiết kế để rửa tất cả các giếng trong một hàng hoặc cột trong cùng lúc. Các giao thức được lập trình để các giếng được rửa theo cách tương tự nhau. Các chu kì rửa khác nhau của các hàng hoặc các cột có thể được áp dụng theo yêu cầu của người sử dụng, tính năng cơ bản của máy rửa EL1SA:
- Màn hình lớn hiển thị giao diện người dùng.
- Nó chấp nhận rửa các microplate có cấu trúc khác nhau.
- Người sử dụng có thể cài đặt thời gian rửa thời gian ngâm, lượng chất rửa sử dụng trong mỗi lần rửa theo yêu cầu của mình. Có thể cài đặt rửa theo hàng, theo cột có the bỏ qua một số hàng/cột nếu người dùng cài đặt yêu cầu.
- Thao tác rửa hoàn toàn tự động, tự động định vị vị trí rửa.
- Hệ thống chất thải tự động cảm ứng và báo người dùng khi đầy.
.jpg)
Cấu trúc cơ bản của máy rửa ELISA bao gồm các thành phần cơ bản:
- Dung dịch rửa.
- Bộ phận bơm tạo áp lực.
- Van điều hòa kiểm soát áp lực.
- Hệ thống kim rửa.
- Giá đỡ đĩa ELISA.
- Kênh thoát nước rửa.
Các vấn đề về máy rửa ảnh hưởng tới kết quả đo:
- Ống hút hóa chất rửa bám dính dẫn tới bán tắc làm lượng hóa chất rửa được hút không đủ.
- Bơm rửa với áp lực quá cao làm ảnh hưởng đến sự gắn kết của các thành phần kháng nguyên kháng thể.
- Hệ thống kim rủa bị tắc hoặc bán tắc: nếu tình trạng này xảy ra với kim phân phối hóa chất/kim hút rửa/cả hai kim các thành phần không phản ứng sẽ không được loại bỏ sẽ làm sai kết quả đo.
- Hệ thống thoát chất thải rửa bị tắc sẽ dẫn đến sự nhiễm nước xả thải vào mẫu.
Khắc phục vấn đề bằng bảo dưỡng hằng ngày sau khi làm việc: rửa sạch kim rửa, làm thông thoáng hệ thống ống phân phối hóa chất rửa hệ thống xả thải. Đố nước thải sau cuối ngày làm việc/khi thiết bị báo đầy.
Bảo quản thiết bị
Thiết bị nên để trên ghế cao cách mặt đất ít nhất lm, nhiệt độ phòng 18- 35°c, độ ẩm dưới 85%, tránh tiếp xúc trực tiếp với ánh sáng mặt trời.
Ngoài hệ thống máy rửa hoàn toàn tự động còn có hệ thống rửa bán tự động, và rửa thủ công hoàn toàn. Đối với hai phương pháp này rất đễ gặp sai sót phụ thuộc rất nhiều vào kinh nghiệm của người thực hiện.

Hình 13. Thiết bị rửa thủ công
6.1.6 Máy đọc kết quả Elisa
.jpg)
6.1.6.1 Thành phấn cấu trúc cơ bản:
- Màn hình giao diện.
- Giá đặt Plate Elisa.
- Hệ thống quang học.
- Bộ phận nhận cảm, khuếch đại tín hiệu.
- Bộ phận phân tích kết quả.
- In kết quả.
Tương tự máy rửa ELISA, máy đọc ELISA cũng chia thành 3 nhóm: có thể đọc một hàng hoặc cột trong một lần, có thể đọc kết quả của cả đĩa cùng một lần hoặc đọc kết quả nhiều đĩa cùng một lúc.
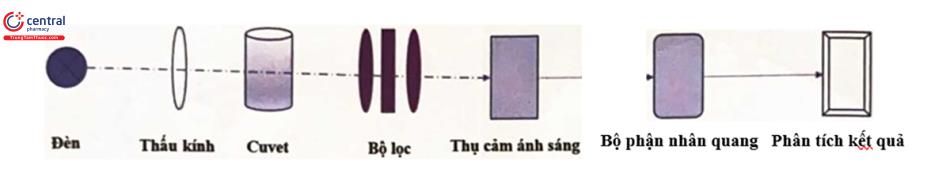
6.1.6.2 Nguyên lý hoạt động của máy
Dựa trên nguyên lý phương pháp quang phổ (như đã được trình bày ở nội dung bài Phương pháp quang phổ và hệ thống hóa sinh tự động).
Cấu trúc cơ bản của máy gồm có 2 bộ phận chính: hệ thống phân tích và máy in. Trong đó hệ thống phân tích cấu tạo bao gồm hệ thống quang học (bộ lọc với các bước sóng khác nhau), hệ thống phát hiện đa kênh, hệ thống điều khiển đĩa phản ứng và chip đơn. Hệ thống có thể phát hiện đĩa 48 hoặc 96 giếng.
Một số yếu tổ ảnh hưởng đến kết quả đọc:
- Cường độ ánh sáng của đều quá yếu hoặc quá mạnh.
- Hệ thống kính lọc không đảm bảo, không cho ra được chùm sáng đơn sắc.
- Hệ thống thấu kính bị giảm chất lượng, bị đục, xước sẽ ảnh hường tới cường độ chùm tia tới.
- Các vấn đề với đĩa EL1SA đã trình bày ở trên.
- Tế bào quang điện kém nhạy cảm.
6.1.7 Một số biện pháp giúp hạn chế sai số
Bảo trì
- Giữ cho môi trường lưu trữ khô ráo và sạch sẽ để tránh ẩm, ăn mòn, tránh xa nguồn gây nhiễu điện từ mạnh.
- Dụng cụ đã được hiệu chuẩn trước khi rời nhà máy. Người dùng không được phép tháo gỡ và điều chỉnh. Bất kỳ khiếm khuyết nào, vui lòng liên hệ với nhà sản xuất.
- Trong sử dụng bình thường, không cần phải thay thế các bộ phận chức năng thông thường, trong khi một số bộ phận đặc biệt cần phải được thay thế nếu cẵn thiết
- Chuấn bị và kiểm tra trước khi sử dụng.
Khi cấm điện và khởi động máy, máy sẽ tự động kiểm tra. Nếu có lỗi xảy ra đối với thiết bị hệ thống sẽ thông báo lỗi ở màn hình hiển thị. Kỹ thuật viên sử dụng cân lưu ý và khắc phục lỗi xảy ra được cảnh báo trước khi sử dụng. Trước khi sử dụng nên đế máy làm ấm trước khi cho mẫu vào phân tích kết quả.
- Chạy mẫu chuẩn kiếm tra đầu ngày.
- Bảo trì máy:
Máy yêu cầu vệ sinh hằng ngày sau quá trình sử dụng. Nhưng một số thành phần của máy được yêu cầu kiếm tra thay thế đế đảm bảo sự chính xác về kết quả phân tích.
- Bộ lọc: Sau một thời gian sử dụng tốc độ truyền của bộ lọc sẽ bị giảm khi đỏ máy sẽ báo gợi ý cho người sử dụng đế kiểm tra hệ thõng lọc. Kỹ thuật viên nên
liên hệ nhà sản xuất đế được hỗ trợ thay thế. Để đảm bảo sự chính xác trong quá trình xét nghiệm, bộ lọc nên được thay thế bởi chuyên gia của hang khi gặp vấn đề.
- Đèn: Thay thế nguồn ánh sáng. Kiểm tra bất thường nguồn sáng trong bằng các lệnh kiềm tra tự động của hệ thống để kiểm tra các bất thường cường độ nguôn sáng theo các tiêu chuẩn của nhà sản xuất. Nếu có bất thường thiết bị sẽ cảnh báo yêu cầu người sử dụng thay thế. Liên hệ với nhà sản xuất để biết nguồn sáng mới khi chu kỳ sống của nguồn ánh sáng kết thúc sau khi sử dụng lâu dài. Đê thay thế định kì.
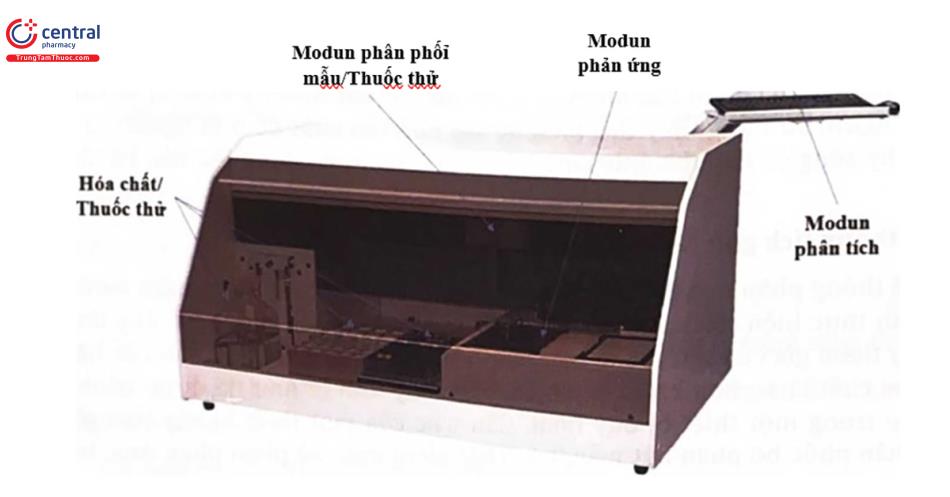
6.2 Hệ thống tích gộp các modun
Hệ thống phân tích ELISA tự động là một hệ thống kết hợp nhiều modun của quá trình thực hiện phản ứng ELISA khác nhau vào trong một hệ thống duy nhất với ít sự tham gia của các yếu tố con người trong đó. cấu trúc cơ bản của hệ thống này thực chất là sự tích hợp vai trò của các máy đơn lẻ như đã được trình bày ở trên vào trong một thiết bị duy nhất, cấu trúc của một thiết bị này bao gôm: Bộ phận phân phối, bộ phận hút mẫu/hóa chất phản ứng, bộ phận phản ứng, bộ phận phân tích.
- Bộ phận phân phối mẫu trong hệ thống máy ELISA tự động chịu trách nhiệm trong việc mã hóa, lưu dữ liệu và phân phối mẫu dưới sự kiểm soát của hệ thống điện tử.
- Bộ phận hút mẫu/hóa chất đóng vai trò trong hút mẫu bệnh phẩm, hóa chất cho việc thực hiện phản ứng ELISA. Thể tích hút mẫu (yêu cầu thể tích mẫu bệnh phẩm cho phản ứng) và thể tích hóa chất thay đổi tùy theo hệ thống máy và loại xét nghiệm thực hiện. Các kim hút sau khi thực hiện hút và phân phối các kim hút được rửa và làm sạch tại các trạm rửa để thực hiện các phản ứng tiếp theo.
- Bộ phận phản ứng là nơi xảy ra các phản ứng kết hợp kháng nguyên kháng thể, các quá trình rửa loại bỏ các thành phần không phản ứng.
- Buồng ủ duy trì điều kiện phản ứng ở một nhiệt độ ổn định tối ưu cho quá trình phản ứng.
- Bộ phận đo quang: Đo các giá trị OD của các giếng phản ứng và dựa vào đường chuẩn đã được xây dựng để tính toán ra giá trị nồng độ của chất cần phân tích nhờ các chuyển đổi tín hiệu quang học thành tín hiệu điện ờ hệ thống phân tích kết quả.
LÀM SẠCH
- Dụng cụ: Thường xuyên vệ sinh bên ngoài thiết bị bằng vải mềm làm ẩm bằng nước và một chất tẩy rửa nhẹ hoặc nếu cần một chất khử trùng.
- Khay chứa mẫu có thể được làm sạch bằng chất tẩy rửa gia dụng thông thường hoặc xà phòng và nước (lau khó bằng vải trước khi sử dụng).
- Không nhúng thiết bị hoặc bất kỳ đầu vào nào vào bất kỳ chất lỏng hoặc chất tẩy rửa nào.
- Không đổ bất kỳ chất lỏng hoặc chất tẩy rửa nào vào bất kỳ thiết bị nào đang mờ.
- Không sử dụng dung môi mạnh để vệ sinh thiết bị.
- Không vệ sinh bất kỳ cổng đầu vào hoặc cổng giao tiếp nào với bất kỳ chất lỏng hoặc làm sạch nào chất tẩy rửa trừ khi đại diện hoặc nhân viên được ủy quyền có đã phê duyệt quy trình đó.
XỬ LÝ CHẤT THẢI
- Giấy máy in không thể tái chế được và nên xử lý như chất thải còn lại.
- Hệ thống đệm chất lỏng và chất tẩy rửa pha loãng có thế được tháo ra.
- Chất thải F cần được coi là có khả năng lây nhiễm và phải được thải bỏ theo quy trình phòng thí nghiệm địa phương cho vật liệu biohazard.
- Test strip sẽ được thải bỏ theo quy trình phòng thí nghiệm tại cơ sờ thực hành cho vật liệu nguy hại. Khử trùng cho vật liệu sinh học có khả năng lây nhiễm (mầu bệnh phẩm) hoặc chất thải có thê' bị ô nhiễm có khả năng lây nhiễm vật liệu sinh học.
Báo trì hàng ngày
ít nhất mỗi ngày một lần khởi động lại thiết bị đế rửa hệ thống kim hút bằng System Fluid để tránh tắc nghẽn.
Các kim của các trạm rửa được rửa sạch bằng đệm rửa và được giữ trong Wash Buffer trong 30 giấy. Các trạm bơm kim tiêm được xả bằng System Fluid va giữ trong 3 giây.
Bảo trì hàng tuấn
Mỗi tuần một lần làm sạch hoàn toàn tất cả các thùng chứa thuốc thử (System Fluid, Wash Buffer, waste) bằng cách sử dụng bàn chải và chất tẩy rửa trong phòng thí nghiệm có sẵn trên thị trường. Sau làm sạch hộp chứa thuốc thử rửa kỹ bằng nước ion khử.
Bảo trì hàng tháng
Thực hiện định kỳ xả rửa hàng tháng để làm sạch hệ thống ống bên trong của thiết bị.
Phàn mềm hệ thống được cập nhật kiểm tra định kì 12 ± 2 tháng/lần.
| Vấn đề | Giải pháp khắc phục |
| Hóa chất phản ứng | Kiểm tra HSD trước khi sử dụng để phân tích, bảo quản hóa chất đúng điều kiện hướng dẫn của nhà cung cấp. |
| Kim hút, kim rửa mẫu bị tắc hoặc bán tắc | Thiết bị báo lỗi trên màn hình chính, tiến hành lau kim khi có lỗi, bảo dưỡng lau kim cuối ngày bằng nước cất và gạc sạch hoặc dung dịch TWIN. |
| Hóa chất rửa bị nhiễm hoặc hết hạn sử dụng. | Kiểm tra và thay thế dung dịch mới, kiểm tra hạn sử dụng trước khi thay. |
| Vấn đề với hệ thống đo quang | Tương tự máy đọc trong hệ thống modun rời. |
| Nhiệt độ buồng ủ không đảm bảo | Kiểm tra đầu ngày trên hệ thống. Nhiệt độ gia động cho phép là 26 ± 2°C |
B. Phương pháp miễn dịch phát quang và hệ thống xét nghiệm miễn dịch
7 Tổng quan
Trong suốt thập kỷ qua, xét nghiệm miễn dịch hóa phát quang (CLIA- Chemiluminescent Immunoassay) và miễn dịch điện hóa phát quang (Electrochemiluminescence Immunoassay ECLIA) ngày càng thu hút nhiều sự chú ý trong nhiều lĩnh vực khác nhau như khoa học đời sống, an toàn thực phẩm, phân tích dược phẩm và xét nghiệm lâm sàng vì độ nhạy cao, độ đặc hiệu tốt và phạm vi ứng dụng rộng rãi.
Những định nghĩa sơ khai nhất về phát quang đã được đề cập đến từ hàng trăm năm trước khi các nhà khoa học nghiên cứu và phát hiện các hiện tượng phát quang trong tự nhiên. Phân tích sâu hơn về bản chất của sự phát quang. Sự phát quang được định nghĩa là sự bức xạ được phát ra bởi một phân tử hoặc nguyên tử khi chúng trở về trạng thái cơ bản từ trạng thái kích thích. Theo nguồn tác nhân kích thích, hiện tượng phát quang có thể được phân loại là quang phát quang (huỳnh quang, lân quang) khi nguồn năng lượng kích thích là năng lượng từ ánh sáng hấp thụ, hoặc phát quang hóa học với nguồn kích thích từ các phản ứng hóa học hay phát quang sinh học khi tác nhân là các phản ứng sinh học trong cơ thể.
Mặc dù hiện tượng phát quang có niên đại từ những năm 300 trước công nguyên, nhưng sự phát triển của các ứng dụng phân tích dựa trên CL chỉ thực sự được phát triển trong khoảng 30 năm gần đây. Các thiết bị đo đơn giản và tính linh hoạt cao để xác định nhiều loại hợp chất đã cho phép các kỹ thuật dựa trên CL phát triển thành một kỹ thuật phân tích có độ nhạy cao và hữu ích nhất, ứng dụng đầu tiên của CL như một công cụ phân tích được thực hiện vào đầu những năm 1950 sử dụng một số chất như luminol, lophine và lucigenin làm chất chỉ thị để phân tích. Các nghiên cứu về tiềm năng của CL đối với các phân tích thông thường bắt đầu vào những năm 1970 cho các phản ứng pha khí và từ những năm 1980 cho các phản ứng pha lỏng. Cùng với các phản ứng CL cổ điển, các chiến lược mới đã được đề xuất, xem xét không chỉ ảnh hưởng của các ion vô cơ như chất oxy hóa, chất khử, chất xúc tác hoặc chất ức chế mà còn sử dụng các phản ứng gắn kết, kỹ thuật phân tích theo thời gian, phân tích bề mặt rắn.
Trong vài năm qua, các ứng dụng CL đã tăng lên, chủ yếu trong lĩnh vực y sinh, do sự phát triển hơn nữa của công nghệ gen và việc sử dụng các phương pháp mới khác nhau đế nghiên cứu CL ở cấp độ phân tử. Ví dụ, tiền chất CL đã được sử dụng từ những năm 1970 đến nay làm nhãn thay thế nhạy cảm cho ghi nhãn đông vị, thay thế đòng vị phóng xạ và cung cấp một chiến lược mới, tốt hơn đáng kế về độ nhạy và an toàn, trong xét nghiệm miễn dịch. Theo nghĩa này, sự quan tâm ngày càng tăng đã được tập trung vao các sản phẩm CL cho nghiên cứu khoa học đời sống. Ví dụ, các dẫn xuất isoluminol và acridinium ester đã được chứng minh là thành công trong việc phát triển các bộ dụng cụ thương mại trong chẩn đoán lâm sàng. Vào những năm 1980, việc phát hiện ra khả năng tăng cường năng suất ánh sáng khi luciferase của đom đóm tình cờ được thêm vào hỗn hợp peroxidase, luminol và Hydrogen peroxide đã đánh dấu sự khởi đău của kỷ nguyên phân tích rất thành công đối với xét nghiệm miễn dịch và các ứng dụng phân tích đa dạng (protein, DNA, và RNA). Gàn đây hơn, một công nghệ mới sử dụng các este acridan mới làm thuốc thử tín hiệu hóa học đã chứng minh tính phù hợp của nó trong xét nghiệm miễn dịch.
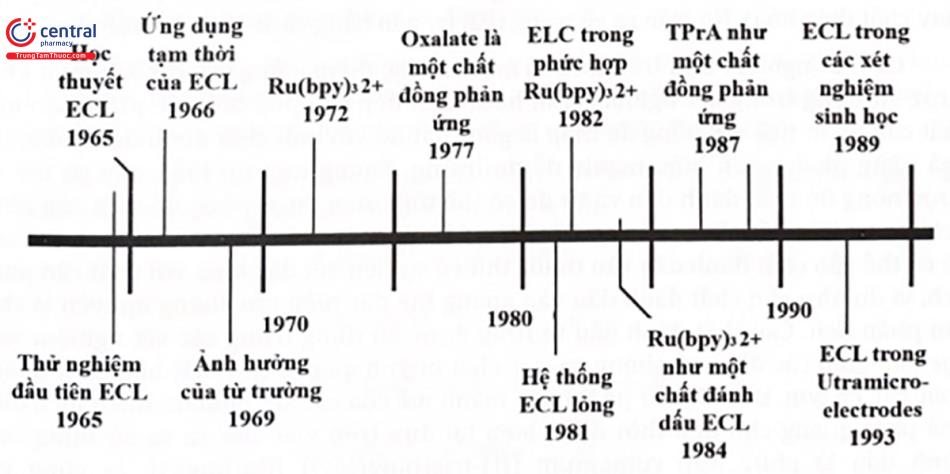
Trong khi đó, phương pháp ECL đầu tiên được mô tả bởi Hercules và Bard vào khoảng năm 1965, mặc dù các báo cáo liên quan đến sự phát xạ ánh sáng xảy ra trong quá trình điện phân bắt đầu từ những năm 1920 bởi Harvey. Sau khoảng 40 năm nghiên cứu, ECL đã trở thành một kỹ thuật phân tích rất mạnh mẽ và được sử dụng rộng rãi trong nhiều lĩnh vực như xét nghiệm miễn dịch, kiểm tra thực phẩm và nguồn nước, phát hiện các tác nhân vũ khí sinh học. ECL cũng đã được ứng dụng thành công trong các kỹ thuật phân tích dòng chảy (Flow Injection Analysis - FIA), sắc ký lỏng cao áp (High-performance liquid chromatography - HPLC), điện di mao dẫn. Hình dưới minh họa dòng thời gian của các sự kiện trong sự phát triển của ECL:
8 Nguyên lý phương pháp
8.1 Hóa phát quang
Miễn dịch hóa phát quang dựa trên nguyên lý miễn dịch kháng nguyên kết hợp với kháng nguyên kháng thể có gắn với chất phát quang. Sự phát quang bản chất là các bức xạ có thể nhìn thấy được hoặc gần nhìn thấy được được tạo ra khi một điện tử chuyển từ trạng thái kích thích sang trạng thái cơ bản. Thế năng được sinh ra trong nguyên tử được giải phóng dưới dạng ánh sáng. Phát quang hóa học được áp dụng cho các kỹ thuật xét nghiệm xét nghiệm miễn dịch thường xác định các phản ứng hóa học là nguồn năng lượng thích hợp nhất để tạo ra trạng thái kích thích điện tử.
Phương pháp dị thể là phương pháp xét nghiệm phát quang hóa học được sử dụng rộng rãi hơn cả. Các phương pháp phát quang hóa học sử dụng có thể là trực tiếp - sử dụng các chất phát quang hoạc gián tiếp - sử dụng các dấu hiệu enzyme. Trong phương pháp phát quang hóa học trực tiếp, chất đánh dấu luminophore được sử dụng là các este acridinium và ruthenium, trong khi các chất đánh dấu enzyme được sử dụng trong phương pháp gián tiếp là các phosphatase kiềm với chất nền adamantly 1,2-dioxetane aryl phosphate (AMPPD) và horseradish peroxidase với luminol hoặc dẫn xuất của nó làm chất nền.
8.2 Điện hóa phát quang
Điện hóa phát quang (ECL), là sự tạo ra ánh sáng bởi một loại chất phát quang bị kích thích (một nguyên tử, một thực thê’ phân tử hoặc một hạt nano) được tạo ra trong một phản ứng điện hóa. Điều này có nghĩa là ECL luôn bắt đầu bằng phản ứng chuyển điện tử ở bê mặt điện cực. Bước điện hóa ban đầu này kích hoạt một chuỗi các phản ứng hóa học của các chất trung gian phản ứng trải qua các phản ứng chuyển điện tử đồng nhất để tạo ra trạng thái kích thích điện tử của chất quang điện (hay chất điện hóa). Nó giãn ra về trạng thái cơ bản bằng cách phát ra một photon.
Các xét nghiệm dựa trên ECL có một vài đặc điểm giống với các kỹ thuật khác được sử dụng trong xét nghiệm sinh học. Cách tiếp cận phổ biến để phát hiện một chất cần phân tích với nồng độ thấp là gắn chất đó với một chất đánh dấu (label) có khả năng phát ra tín hiệu mạnh, dễ đo lường. Thông qua tín hiệu này có thể đo được nông độ chất đánh dấu và từ đó có thê’ tính toán được nồng độ chất cần phân tích mà nó liên kết. Đê’ tạo ra sự đặc hiệu đối với một chất cần phân tích cụ thể nào đó có thế gắn chất đánh dấu vào thuốc thử có sự liên kết đặc hiệu với chất cần phân tích, ví dụ như gắn chất đánh dấu vào kháng thê’ đặc hiệu với kháng nguyên là chất cần phân tích. Các chất đánh dấu thường được sử dụng trong các xét nghiệm sinh học bao gồm các đồng vị phóng xạ, các chất huỳnh quang, các chất hóa phát quang hoặc các enzym. Đặc biệt sự phát triển mạnh mẽ của các xét nghiệm miễn dịch điện hoá phát quang cho đến thời điểm hiện tại dựa trên việc tìm ra và sử dụng chất đánh dấu là phức hợp ruthenium (Il)-tris(bipyrỉdyl) [Ru(bpy)3] 2+ cùng với tripropylamine (TPA).
8.3 Phức hợp Ruthenium
Ruthenium (Ru) là một kim loại hiếm chuyên tiếp thuộc nhóm bạch kim của bảng tuần hoàn cac nguyên tố hoá học. Như các kim loại khác thuộc nhóm này, Ru trơ đối với hầu hết các hoá chất khác. Nhưng ờ dạng phức hợp chelate ruthenium(II)-tris(bipyridyl) ([Ru(bpy) 3]2+) nó có thể được biến đổi dễ dàng đế kết hợp với nhiều nhóm phản ứng khác nhau. Điều này cho phép công nghệ ECL có thể áp dụng cho nhiều loại chất phân tích.
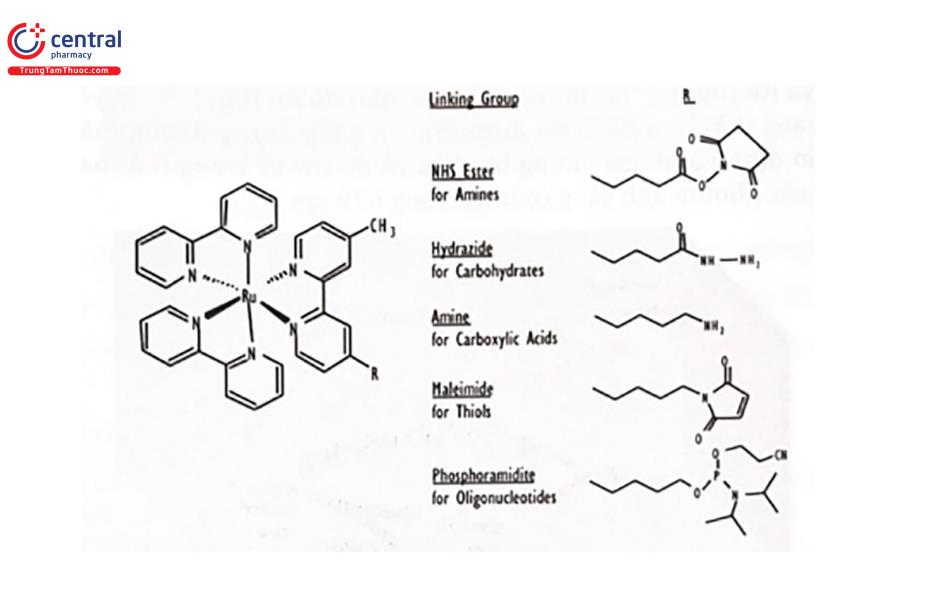
Đối với các xét nghiệm miễn dịch, este N-hydroxysuccinimide (NHS) của phức hợp Ru(bpy)3 được sử dụng nhiều nhất vì nó có thể dễ dàng kết hợp với các nhóm amino của protein, haptens và các acid nucleỉc trong chất phân tích.
8.4 Các phản ứng xảy ra ở bề mặt điện cực
Ở bề mặt điện cực, hai hoạt chất là phức hợp ruthenium và tripropylamine (TPA) được tham gia vào các phản ứng dẫn đến sự phát xạ ánh sáng. Cả hai chất đều giữ nguyên ở trạng thái ổn định khi chưa có điện áp tác động.
Phản ứng ECL của ruthenium-tris (bipyridyl)32+ và tripropylamine xảy ra tại bề mặt của điện cực platinum theo 4 phương trình

Khi điện áp được đặt vào hệ thổng tạo ra một điện trường, TPA bị oxy hóa tại điện cực, giải phóng một electron và tạo thành một gốc tự do TPA trung gian, rồi sau đó nhanh chóng tiếp tục phản ứng giải phóng ra một proton (H +) để tạo thành một gổcTPrA*.
Trong khi đó, phức hợp ruthenium cũng bị oxy hoá giải phóng một electron ở bề mặt của điện cực để tạo thành cation Ru (bpy)33+. Cation ruthenium này là thành phằn phản ứng thứ hai cho phản ứng ECL xảy ra sau đó với gốc TPA.
TPrA* và Ru (bpy)33+ tác dụng với nhau, nhờ đó Ru (bpy)33+ chuyển thành Ru (bpy)32+ ở trạng thái kích thích do được truyền năng lượng. Trạng thái kích thích này không ôn định và nhanh chóng bị phân rã đê trờ về trạng thái ban đầu bằng cách phát ra các photon ánh sáng có bước sóng 620 nm.
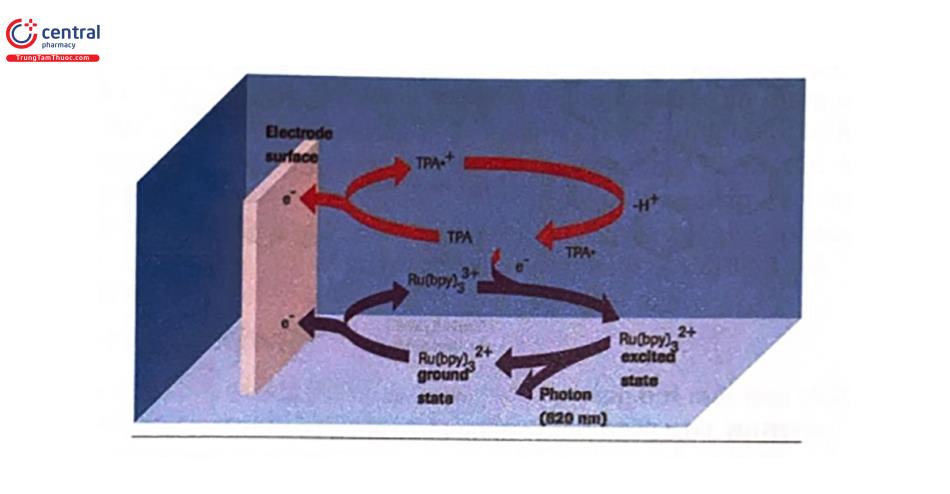
Chu trình phản ứng sau đó lại được bắt đầu. Các sản phẩm phụ từ gốc tripropylamine tạo ra ở phản ứng 3 không ảnh hưởng đến quá trình quang hoá này. Do TPA được sử dụng tối đa nên cần có số lượng lớn. Phản ứng được điều khiển theo sự khuếch tán của TPA và lượng phức hợp ruthenium. Trong điện trường, TPA bị giảm đi nên cường độ tín hiệu (ánh sáng) sẽ giảm dần sau khi đạt tới giá trị cực đại.
Mặc dù TPA bị cạn kiệt trong quá trình phản ứng, phức hợp ruthenium lại được tái tạo liên tục. Điều này có nghĩa là phức hợp ruthenỉum có thể thực hiện nhiều chu trình phát quang trong suốt quá trình đo, dẫn đến độ nhạy của ECL cao hơn so với các hệ thống hoá phát quang khác. Nhiều photon có thể được tạo ra từ một phức hợp kháng nguyên kháng thể.
8.5 Tạo tín hiệu ECL
Hình vẽ dưới đây minh hoạ cho quá trình tạo tín hiệu ECL. Theo quan điếm điện tử, phản ứng được giải thích như sau: khi một điện áp cấp vào điện cực của buồng đo sẽ xuất hiện một ánh sáng được coi như một tín hiệu ECL.
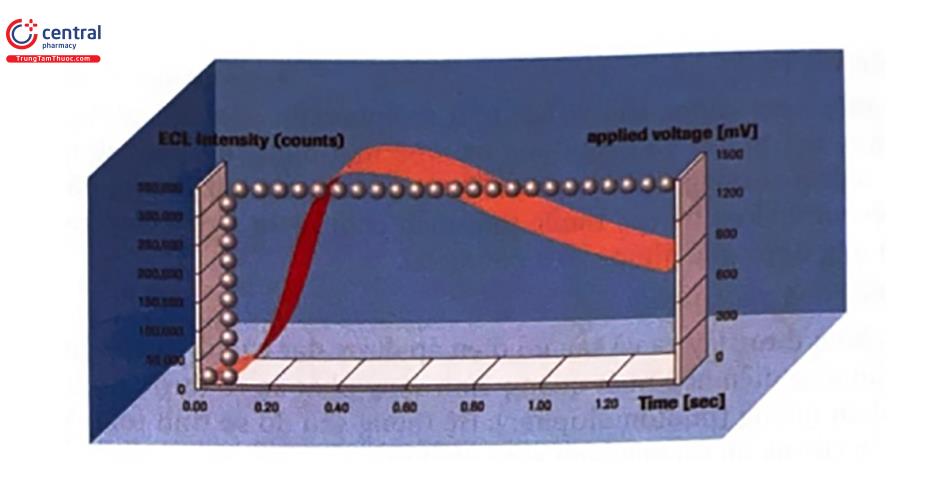
Vùng nằm dưới đường cong đo được trong khoảng giới hạn cường độ tối đa.
Đường chấm cho biết điện áp đặt vào điện cực để tạo ra tín hiệu ECL.
Đường nét liền cho biết ánh sáng thực ở đấu ra được đo bằng cảm biến nhân quang.
8.6 Quá trình đo ECL
Trung tâm của hệ thống xét nghiệm miễn dịch điện hóa phát quang là buông đo, được thiết kế giống như một thiết bị đo lưu lượng dòng chảy, về cơ bản, có 3 quá trình kế tiếp nhau xảy ra trong buồng đo:
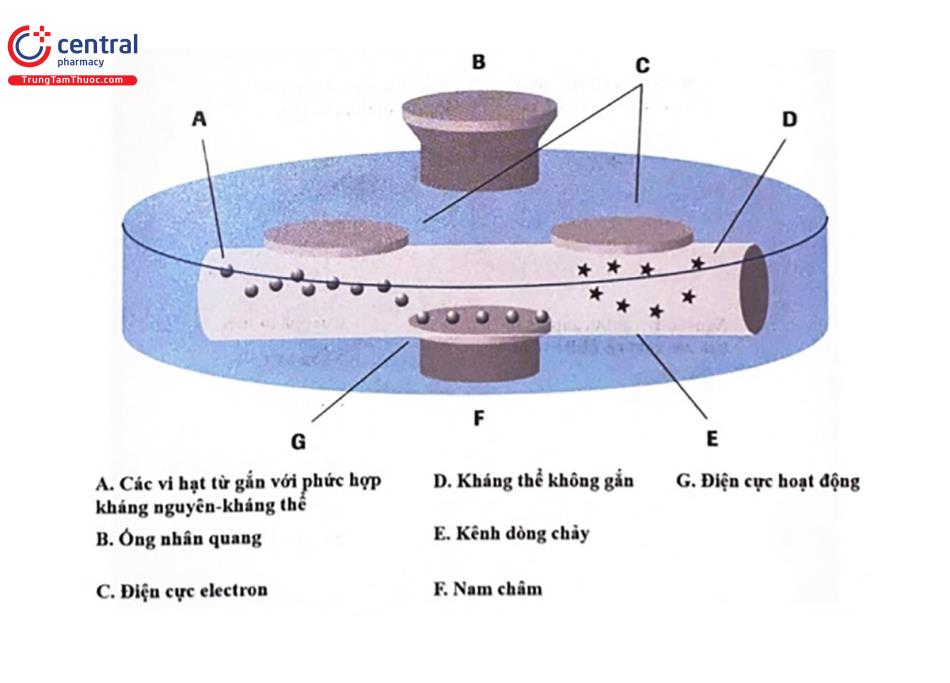
Tách hạt gắn kết / tự do
Bằng một nam châm, các vi hạt phủ streptavidin gắn vớỉ phức hợp kháng nguyên kháng thê bị hút và lắng đọng trên bề mặt điện cực hoạt động (working electrode). Một loại dung dịch được sừ dụng để rửa các hạt không gắn trên điện cực làm việc và đế loại bỏ các thuốc thử, mau chất phân tỉch dư thưa và các sần phẩm phản ứng được giải phóng có ở buồng đo.
Phán ứng điện hoá phát quang
Nam châm được lấy ra và sau đó điện áp được đặt vào điện cực hoạt động để bắt đầu phản ứng điện hoá phát quang. Ấnh sáng phát xạ ra được đo bằng một bộ cam biên nhan quang (photomultiplier). Hệ thống sau đó sẽ tính toán kết quả phù hợp dựa tren cương độ tín hiệu ánh sáng phát ra.
Giải phóng vi hạt và làm sạch buồng đo
Khi việc đo lường kết quả được hoàn thành, các vi hạt từ tính sẽ được rửa sạch khỏi bề mặt điện cực bằng dung dịch làm sạch đặc biệt. Bề mặt của buồng đo được khôi phục lại bằng cách thay đổi điện thế trên điện cưc và sẵn sàng cho một quá trình mới.
8.7 Các nguyên lý miễn dịch của xét nghiệm
Các xét nghiệm miễn dịch ECL sử dụng 1 trong 3 nguyên lý: cạnh tranh, sandwich và bắc cầu.

8.7.1 Nguyên lý cạnh tranh
Nguyên lý cạnh tranh áp dụng cho việc phân tích các phân tử có khối lượng thấp và kích thước vô cùng nhỏ như: T3, T4, FT3, FT4, cortisol, Testosterone, Estradiol...
Quá trình bao gồm các bước (VD với T3):
- Đầu tiên, mẫu xét nghiệm và kháng thể đặc hiệu kháng T3 được đanh dau bằng phức hợp ruthenium được cho vào cốc xét nghiệm (Assay cup).
- Sau bước ủ lần đầu, hỗn hợp T3 đã bị Biotin hóa và cac vi hạt từ tính phủ streptavidin được thêm vào. Khi đó các vị trí chưa gắn kết trên kháng thể ấy bị chiếm giữ hình thành phức hợp kháng thể-hapten. Toàn bộ phức hợp này trở nên gắn kết với pha rắn thông qua sự tương tác giữa biotin va streptavidin.
- Sau bước ủ lần 2, hỗn hợp phản ứng được đưa vào trong buông đo. Các VI hạt đối từ bị bắt giữ vào điện cực hoạt động do tác động của từ trường. Những thành phần không gắn kết bị thải ra ngoài bởi dung dịch ProCell.
- Cho điện áp vào điện cực, phản ứng ECL xảy ra, lượng ánh sáng được tạo ra tỉ lệ nghịch với lượng kháng nguyên có trong mẫu bệnh phẩm va được đo bằng bộ khuếch đại quang tử.
Nồng độ của kháng nguyên được ước lượng và tính toán thông qua đường cong chuẩn được thiết lập trên cơ sở nồng độ kháng nguyên chuẩn đã biết.

8.7.2 Nguyên lý sandwich
Nguyên lý sandwich sử dụng cho phân tích những chất có kích thước lớn hơn như TSH, FSH,LH,HbsAg ..
Quá trình bao gồm các bước; (VD TSH)
- Thời kỳ ủ đàu tiên, mẫu xét nghiệm được kết hợp với thuốc thử có chứa kháng thể kháng TSH đánh dấu biotin và kháng thể kháng TSH đánh dấu ruthenium trong cùng 1 cốc xét nghiệm. Trong quá trình ủ 9 phút này, 2 loại kháng thể sẽ bắt cặp với TSH có trong mẫu bệnh phẩm để tạo thành phức hợp miễn dịch bắt cặp.
- Thời kỳ ủ thứ 2, các vi hạt phủ streptavidin được thêm vào. Trong 9 phút ủ, phức hợp miễn dịch trên trở nên gắn kết với pha rắn thông qua sự tưomg tác giữa biotin và streptavidin.
- Sau bước ủ thứ 2, hỗn hợp phản ứng được chuyển tới buồng đo. Các vi hạt đối từ bị bắt giữ vào điện cực hoạt động do tác động của từ trường. Những thành phần không gắn kết bị thải ra ngoài bởi dung dịch ProCell.
- Cho điện áp vào điện cực, phản ứng ECL xảy ra, lượng ánh sáng được tạo ra tỉ lệ thuận với lượng TSH có trong mẫu bệnh phẩm và được đo bằng bộ khuếch đại quang tử.
Nồng độ của kháng nguyên được ước lượng và tính toán thông qua đường cong chuẩn được thiết lập trên cơ sở nồng độ kháng nguyên chuẩn đã biết
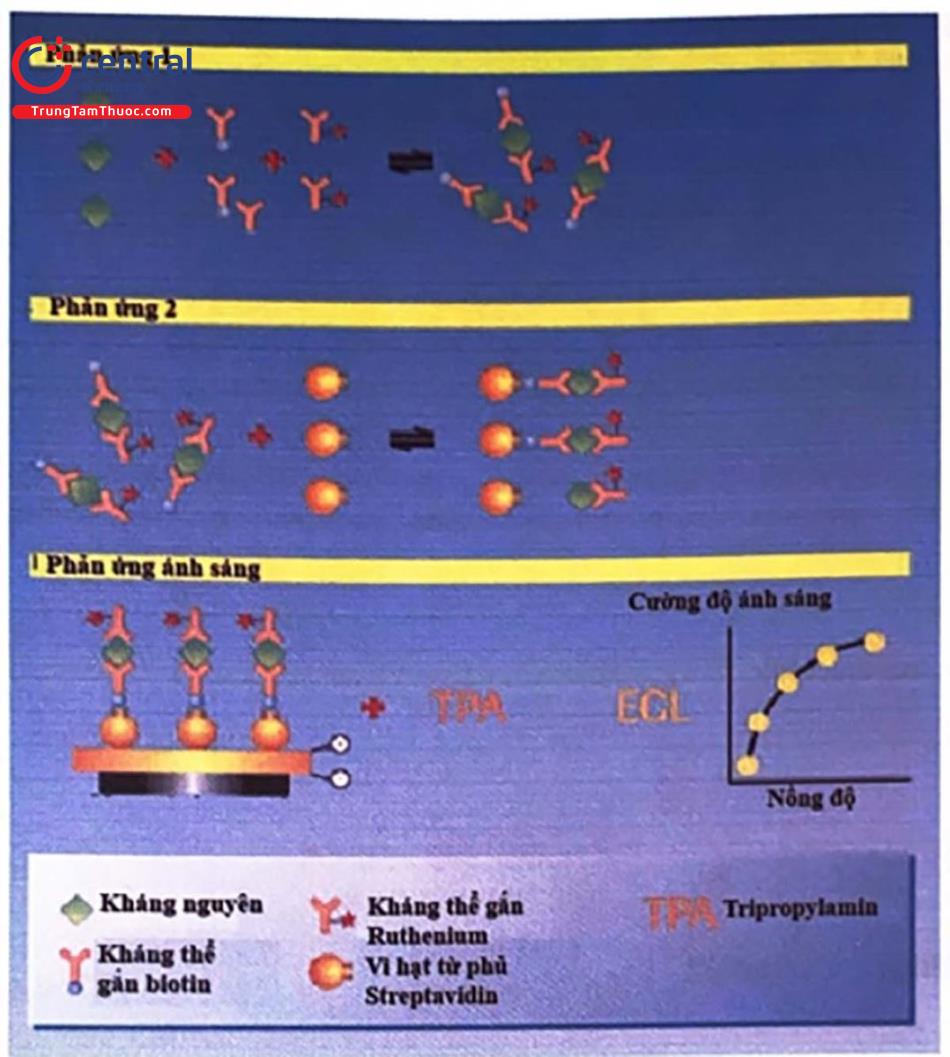
8.7.3 Nguyên lý bắc cầu
Nguyên lý này tương tự như nguyên lý sandwich, ngoại trừ việc chỉ áp dụng cho phát hiện các loại kháng thể (IgG, IgM, IgA).
Quá trình gồm các bước:
- Thời kỳ ủ đầu tiên, các kháng thê có trong huyết thanh của mẫu xét nghiệm sẽ được cho kết hợp với thuốc thử có chứa kháng nguyên được đánh dấu biotin và kháng nguyên đánh dấu ruthenium đê’ tạo phức hợp miễn dịch.
- Phức hợp miễn dịch sau đó sẽ gắn với các vi hạt phủ streptavidin thông qua sự tương tác giữa biotin và streptavidin ở trong thời kỳ ủ thứ 2.
- Sau bước ủ thứ 2, hỗn hợp phản ứng được chuyển tới buồng đo. Các vi hạt đối từ bị bắt giữ vào điện cực hoạt động do tác động của từ trường. Những thành phần không gắn kết bị thải ra ngoài bời dung dịch ProCell.
- Cho điện áp vào điện cực, phản ứng ECL xảy ra, lượng ánh sáng được tạo ra tỉ lệ thuận với lượng kháng thể có trong mẫu bệnh phẩm và được đo bằng bộ khuếch đại quang tử. Nồng độ của kháng thể được ước lượng và tính toán thông qua đường cong chuẩn được thiết lập trên cơ sở nồng độ kháng thể chuẩn đã biết.

9 Cấu trúc và nguyên lý của hệ thống xét nghiệm miễn dịch tự động
Trải qua một quá trình phát triển và cải tiến qua nhiều thế hệ, đã có nhièu thay đôi trong tính năng và năng lực thực hiện xét nghiệm. Tuy nhiên, nhìn chung ve cơ bản cấu trúc của một thiết bị phân tính xét nghiệm ứng dụng công nghệ xét nghiệm điện hóa phát quang về cơ bản bao gồm các thành phần cơ bản: bộ phận điêu khiên, bộ phận vận chuyến và phân phổi mẫu, bộ phận thực hiện xét nghiệm.
9.1 Phân hệ điều khiển
Đây là phân hệ chịu trách nhiệm điều khiên, phân phối và kiêm soát sự vận hành của toàn bộ hệ thống. Phân hệ điều khiến lựa chọn các xét nghiệm được thực hiện cho từng mẫu từ hệ thống thông tin xét nghiệm tự động L1S. Kỹ thuật viên cũng có thế can thiệp dữ liệu lựa chọn xét nghiệm. Phân hệ điều khiển quan lý các phân hê khác bằng việc gửi các lệnh và thông tin điều khiển thông qua các bus điều khiển.
Phân hệ điều khiển của máy xét nghiệm miễn dịch tự động hoạt động theo cách trực tiếp. Phân hệ bao gồm bộ xử lý có nhiệm vụ điều khiển và giám sát quá trình thực hiện xét nghiệm mẫu trong máy. Dữ liệu xét nghiệm như loại xét nghiệm, quy trình xét nghiệm, thông số hoạt động của máy và các thông tin liên quan khác. Ngoài ra, khối điêu khiển sẽ hiển thị các kết quả xét nghiệm và thông tin trạng thái trên thiết bị đầu ra. Các thành phần xét nghiệm như mẫu xét nghiệm, hoá chất,... được đưa vào hệ thống và được quản lý bởi phân hệ điều khiến thông qua giao diện người sử dụng.
Bên cạnh đó, phân hệ điều khiển còn đóng vai trò quan trọng trong việc chi phối cho các khối chức năng khác như rửa, ủ, cảm biến... trong trường hợp xét nghiệm ưu tiên. Xét nghiệm ưu tiên cao hơn sẽ được thực hiện tại bất kỳ thời điểm nào. Trong khi đó các xét nghiệm đang, sắp được tiến hành đều bị tạm dừng chờ tới khi xét nghiệm ưu tiên được thực hiện. Chương trình điều khiển đảm bảo cho các xét nghiệm ưu tiên được tiến hành song không làm phá vỡ hay tổn hao các mẫu đang được xử lý.
9.2 Phân hệ vận chuyển và phân phối mẫu
Hoạt động của hệ thống này chịu sự chi phối của hệ thống điều khiển, tùy theo mong muốn và yêu cầu của người vận hành thông qua hệ thống điều khiển thực hiện việc phân phối mẫu đến các vị trí phản ứng để thực hiện xét nghiệm. Sự cải tiến và phát triển của khoa học kỹ thuật và công nghệ dẫn đến sự ra đời của ngày càng nhiều các máy xét nghiệm hiện đại với nhiều modun tích hợp và hệ thống vận chuyển và phân phối tiên tiến, cho phép thực hiện đồng thời nhiều xét nghiệm, loại xét nghiệm cùng lúc nâng cao hiệu suất và chất lượng của phòng xét nghiệm.
9.3 Phân hệ thực hiện xét nghiệm
9.3.1 Phân hệ ủ
Ống xét nghiệm được đưa vào hệ thống ủ tại khu vực chuyển giao, ống xét nghiệm có thể chứa thuốc thử pha rắn hoặc để trống di chuyển tới bộ phận vận chuyển là đai ủ. Ở đai ủ, các ống xét nghiệm được định vị tại tâm của mỗi mắt đai để loại trừ sự thay đổi tốc độ dịch chuyển của ống tại các góc vòng của đai.
Ống xét nghiệm sau đó được đưa tới trạm pipet để bổ sung chất lỏng. Chất lỏng này có thể là các mẫu bệnh phẩm như máu, nước tiểu hoặc là mẫu bệnh phẩm đã pha loãng hay thuốc thử dạng lỏng. Loại và lượng chất lỏng bổ sung tuỳ thuộc vào loại xét nghiệm được thực hiện, ống xét nghiệm sẽ dịch chuyển vòng quanh đai ủ theo một khoảng thời gian riêng cho từng xét nghiệm.
Vì ống xét nghiệm dịch chuyển dọc theo đai ủ nên ống được khuấy trộn bơi một hoặc nhiều đầu khuấy trộn. Buồng ủ được bao phủ trong một lớp vỏ dày đế duy trì nhiệt độ bên trong ở 37°c ± o,l°c. Ong xét nghiệm liên tục dịch chuyển theo đai ủ cho tơi khi được đưa vào trạm rửa hoặc trạm chuyển tiếp.
Mỗi đai ủ sẽ kẽt hợp với ít nhất một trạm rửa và một trạm chuyển tiếp tuỳ thuộc vào cấu trúc tổng thế của buồng ủ. Trạm rửa có nhiệm vụ loại bỏ đi những chất nổi trên bề mặt của dung dịch phản ứng nhưng giữ lại các thành phần phản ứng pha rắn, bổ sung dung dịch rửa (như nươc), loại bo dung dịch rửa... lặp lại với quá trình rửa pha rắn và sau đó đưa ống xét nghiệm quay trở lại đai ủ về vị trí cũ. Nhiệm vụ của trạm chuyển tiếp là dịch chuyển ống xét nghiệm từ một đai ủ tới một khu vực chức năng khác như một đai ủ khác (trong hệ thống có nhiều đai ủ) hay tới buông đo quang. Đôi khi, trạm rửa và trạm chuyến tiếp được kết hợp với nhau, ví dụ như một ống xét nghiệm được đưa vào trạm rửa đế rửa đi các thành phần phản ứng pha rắn, sau đó ống lại được dịch chuyên ra ngoài trạm rửa để đưa tới khu vực khác ngoài đai ủ đó. Như vậy, ống xét nghiệm được rửa và chuyển tiếp từ một trạm kết hợp.
9.3.2 Phân hệ đo quang
Phân hệ đo quang thực hiện đo lường cường độ sáng được phát ra và sự thay đối màu sắc đê định lượng thành phần trong ống xét nghiệm.
Phân hệ chuyển tiếp truyền các ống xét nghiệm tới phân hệ đo quang sau khi đã được rửa một hoặc nhiều lần. Phân hệ chuyển tiếp nạp các ống xét nghiệm vào các đai đo quang. Đai này quay theo chiều kim đồng hô hoặc ngược lại theo lệnh của phân hệ điều khiển. Cơ chất và/hoặc hoá chất thử được cho vào ống và dịch chuyển dọc theo đai đo quang và được lắc bởi bộ phận khuấy trộn. Khi có lệnh từ phân hệ điều khiển, ống được chuyển tới vị trí đọc. Tại đây, ống được đọc bời cơ cấu cảm biến và sau đó được đưa tới máng đổ.
Để tránh ánh sáng bên ngoài, cơ cấu cảm biến được kết nối với khu đọc thông qua một ống đã được bịt kín. ống này cho phép đĩa suy giảm dịch chuyển tới trạm đọc trong khi ngăn chặn ánh sáng bên ngoài xâm nhập vào cơ cấu cảm biến.
Trạm đọc và đai đo quang được tách rời với nhau cho phép mỗi làn nạp sẽ có thêm nhiều ống được đưa vào phân hệ đo quang và đợi trên đai trong các khoảng thời gian khác nhau. Như vậy, các ống không cần phải nạp theo cách nối tiếp nhau vào trạm đọc. Nhờ cấu trúc tách biệt quá trình dịch chuyển ống và đọc ống, các ống xét nghiệm có thể được khuấy trộn trong khi một ống khác đang được đọc. Ngoài ra, do xét nghiệm được thực hiện trên từng ống nên các ống có thể duy trì trên đai trong các khoảng thời gian ngắn hơn hoặc lâu hơn. Một số xét nghiệm có thể yêu cầu kéo dài thời gian giữa thời điểm hoá chất thử bám vào chất gắn trên hạt đế tạo ra sự quang hoá và thời điểm cơ cấu cảm biến phát hiện ra sự quang hoá. Ngoài ra, một số xét nghiệm có thê’ được ưu tiên và sẽ được xử lý nhanh hơn tại thời điếm đo quang tới cơ cấu cảm biến. Vì vậy, phân hệ điều khiển được lập trình để điều khiến thứ tự khi một ống xét nghiệm được chuyển tiếp giữa đai đo quang và trạm đọc; nó có thể thực hiện điều khiển này bằng cách dò vị trí của ống trên đai đo quang. Như vậy, mỗi ống xét nghiệm có khoảng nghỉ cần thiết riêng trên đai đo quang và khoảng thời gian này có thê’ được điều khiển dựa trên loại xét nghiệm đang tiến hành cũng như quyền ưu tiên tuỳ theo lệnh từ phân hệ điều khiển.
Trạm đọc chất phân tích hoạt động theo kiểu ngẫu nhiên. Phương pháp này cho phép thay đổi khoảng thời gian từ khi đưa hoá chất vào mẫu xét nghiệm để có phản ứng tạo màu hoặc phát quang tới khi từng mẫu được đặt đưới cơ cấu cảm biến. Như vậy, khoảng thời gian cần thiết cho từng xét nghiệm khác nhau sẽ được tối ưu hoá.
Ống xét nghiệm được đưa vào trạm đọc từ đai đo quang ở vị trí cửa vào. ống thường được quay ngược chiều kim đồng hồ để tới vị tri đọc. Tại đây, ống được đọc bởi cơ câu cảm biến. Cơ cấu cảm biến được bảo vệ bằng ống ngăn sáng. Trạm đọc được che chắn bằng các lớp vỏ che chắn bên trên, dưới đáy và xung quanh. Lớp chắn xung quanh chỉ mở ra tại vị trí lối vào, lối ra và vị trí đọc. Lớp chắn này ngăn chặn rò rỉ ánh sáng ra ngoài trạm đọc. ống xét nghiệm tại vị trí đọc được đặt nghiêng hướng ra vành ngoài của trạm đọc.
Do đó, mỗi ống xét nghiệm sẽ được đặt cách cơ cấu cảm biến một khoảng cố định. Đĩa suy giảm đặt giữa trạm đọc và cơ cấu cảm biến có dạng hình thang xoay quanh một trục có nhiệm vụ ngăn chặn ánh sáng. Khi đứng trước vị trí đọc, cơ cấu cảm biến không nhận được ánh sáng từ ống xét nghiệm. Tín hiệu điện được tạo ra lúc này sẽ là tín hiệu nền và được trừ đi khi đo sáng. Nhờ vậy, kết quả thu được có độ chính xác cao hơn.
10 Các quy trình xét nghiệm trong máy xét nghiệm tự động

Như trong hình trên, quá trình xét nghiệm bắt đầu từ bước nạp ống xét nghiệm vào máy. Phân hệ điều khiển thực hiện nhận dạng các thành phần khác nhau của mẫu (thể tích mẫu, nhận biết thuốc thử, lựa chọn hạt...). Mầu sau đó sè được pha loãng (nếu cần) và cho thuốc thử vào ống xét nghiệm.
Tuỳ vào từng loại xét nghiệm cụ thể, thời gian ủ kéo dài khác nhau từ vài phút tới vài chục phút. Sản phẩm sau ủ khuấy trộn có thể tiếp tục được bổ sung thuốc thử để lại được khuấy trộn lần nữa hoạc đưa tới bước rửa và loại bỏ đi mẫu và thuốc thử không cần thiết. Sau bước rửa, sản phẩm có thể lại được bổ sung thuốc thử và ủ lần nữa hoặc đưa tới bước đo lường. Phép đo được tiến hành và cuối cùng là hiển thị kết quả.
11 Một số yếu tố ảnh hưởng đến kết quả xét nghiệm
11.1 Kết quả xét nghiệm sai
Nguyên nhân có thể có:
+ Có bọt trong dung dịch nước rửa, thuốc thử hay mẫu bệnh phẩm.
+ Mẫu bệnh phẩm bị đông.
+ Hoá chất lỏng.
+ Phần cứng:
+ Mixer trục trặc (hỏng, sai vị trí, không đủ tốc độ).
+ Kim hút sipper bị tắc, đường ống hút của sipper bị bán tắc.
+ Điện cực Reference bị hỏng.
+ Hỏng dây pinch valve.
11.2 Kết quả control và bệnh phẩm không ổn định
Nguyên nhân có thể có:
- Dung dịch nước rửa dùng quá lâu, bị bay hơi.
- Điều kiện bảo quản thuốc thử không phù hợp.
- Nhiệt độ thuốc thử không phù hợp.
- Không chạy chuẩn máy/kiểm tra chất lượng theo định kỳ.
- Phần cứng: Hỏng điện cực đo (12 tháng sử dụng hoặc đo được 50000 mẫu tuỳ điều kiện nào trước).
+ Nhiệt độ điện cực đo, ống nhân quang, khay ủ, hoá chất hệ thống không nằm trong dải yêu cầu.
+ Ống nhân quang hỏng.
11.3 Không thề thực hiện chạy chuẩn hoá chất được
Nguyên nhân có thể có:
- Thuốc thử và chất chuẩn không có trên máy.
- Chất chuẩn hết hạn.
- Mã vạch của thuốc thử/chất chuẩn hỏng.
- Lot của Thuốc thử và chất chuẩn không phù hợp.
- Chất chuẩn 1 và 2 không đặt liền nhau.
- Phần cứng: Đàu đọc mã vạch chưa được chỉnh chính xác.
11.4 Máy báo nhiệt độ khay thuốc thử ngoài dải
Nguyên nhân có thể có:
- Thermistor hỏng.
- Peltier hỏng.
11.5 Gripper không gắp được cup/tip trong quá trình đo mẫu
Nguyên nhân:
- Chỉnh gripper chưa chính xác.
- Sai, hỏng sensor xác định vị trí trên khối gripper.
- Đứt cầu chì 5v Dc.
11.6 Kim sipper nhỏ giọt
Nguyên nhân:
- Bán tắc hệ thống dung dịch thải.
- Dây pinch valve không tốt.
11.7 Màn hình cảm ứng sai vị trí con trỏ
Nguyên nhân:
- Màn hình bị bẩn ko không vệ sinh.
- Chuẩn màn hình không chính xác.
11.8 Kim hút không hút được bệnh phẩm, thuốc thử
Nguyên nhân:
- Chỉnh điện áp LLD (liquid level detection) chưa chính xác.
- S/R probe bần gây nhiễu điện.
- Có bọt khí trên cup bệnh phẩm, thuốc thử.
11.9 Phần nhiều lỗi trên đây xuất phát từ phía kỹ thuật viên
- Thực hiện các thao tác pha hỗn hợp thuốc thử không đúng kỹ thuật làm cho kết quả xét nghiệm không chính xác.
- Lớp mã vạch trên các bình thuốc thử bị bụi phủ nên máy không nhận dạng được thuốc thử tới đưa tới các cảnh báo.
- Không thay rotor thuốc thử định kỳ nên các bộ phận truyền động làm việc không chính xác.
- Không sử dụng thuốc thử phù hợp với xét nghiệm càn tiến hành.
- Không thay màng lọc định kỳ.
- Không tiến hành kiểm tra chất lượng xét nghiệm định kỳ.
- Không nghiên cứu kỹ tài liệu hướng dẫn sử dụng dẫn tới việc sắp xếp trật tự các xét nghiệm không phù hợp gây ra tình trạng xung đột thời gian làm cho máy bị treo tạm thời.
- Nguồn nước cấp cho máy không đuọc xử lý kỹ làm cho hệ thống ống dẫn bị lắng cặn.
- Các bình thuốc thử không được lưu trữ trong môi trường thích hợp.
- Không vệ sinh máy định kỳ.
Một số lỗi do máy:
- Máy bi treo do xung đột dữ liệu. Khi kỹ thuật viên tiến hành đồng thời nhiều loại xét nghiệm với thời gian khác nhau, chương trình đièu khiển của máy bị xung đột dữ liệu dẫn tới quá trình vận hành máy bị tạm ngừng. Vì vậy, các nhà sản xuất phải liên tục nâng cấp chương trình phần mềm điều khiển. Đây cũng là một trong những điểm khác biệt của các hệ thống xét nghiệm miễn dịch giữa các hãng.
- Máy xét nghiệm có rất nhiều hệ thống truyền động nên cũng hay xảy ra các sự cố với các động cơ bước.
- Hệ thống trộn vi hạt hoạt động không đúng như thống số máy.
11.9.1 Bảo trì, bảo dưỡng máy
| Thời gian | Công việc |
| Hàng ngày | Làm sạch kim hút mẫu/thuốc thử và kim sipper |
| Hàng tuần | - Làm sạch kim nhỏ khoang chứa bình và thay bình nhỏ ProCell/CleanCell - Làm sạch bộ trộn PreClean và trạm rửa riêng - Làm sạch buồng ủ - Làm sạch bộ trộn vi hạt. - Làm sạch trạm rửa |
| Mỗi 2 tuần | Làm sạch điện cực |
| Mỗi quý | Thay thế kẹp van ống |
| Mỗi 6 tháng | Làm sạch miếng lọc nước đầu vào |
| Khi cần | - Làm sạch ống hút và lọc hóa chất rửa - Làm sạch giá chứa bình hóa chất rửa - Làm sạch khay thuốc thử và ngăn - Làm sạch ngăn chứa chất thải rắn - Làm sạch bề mặt máy |
Bên cạnh đó, một vấn đề thường gặp tại các phòng xét nghiệm của các bệnh viện là các kỹ thuật viên thường bỏ qua khâu chuẩn máy và kiểm tra chất lượng máy. Vì vậy, việc nâng cao ý thức sử dụng máy một cách khoa học và có trách nhiệm với kết quả vận hành là việc rất cần thiết. Xét nghiệm miễn dịch đặc biệt quan trọng vì kết quả xét nghiệm có liên quan trực tiếp tới quá trình điều trị của bệnh nhân. Nó liên quan tới vấn đề sức khoẻ, tính mạng của người bệnh nên cần tuyệt đối tránh những sai sót do chủ quan. Ngoài ra, hệ thống nước sạch cung cấp cho các bệnh viện cũng cần được nâng cao chất lượng. Tại nhiều bệnh viện, máy xét nghiệm thường xuyên bị lỗi một phần nguyên nhân thường gặp là do hiện tượng nước chưa được xử lý tốt làm ảnh hưởng tới hệ thống ống dẫn của máy, gây tắc nghẽn làm máy vận hành không chính xác hoặc thậm chí không hoạt động.
12 Tài liệu tham khảo
1. Bishop, M. L, Fody, E. p., & Schoeff, L E. (2018). Clinical chemistry: principles, techniques, and correlations. Eighth edition. Philadelphia: Wolters Kluwer.
2. Carl A. Burtis & David E.Bruns. (2015). Clinical chemistry and molecular diagnostics, pp 236-253
3. PGS. TS. BS. Đặng Thị Ngọc Dung, TS. Nguyễn Trọng Tuệ (2023). “Phương pháp xét nghiệm miễn dịch”. Kỹ thuật và thiết bị xét nghiệm y học. Nhà xuất bản y học, trang 156-216. Tải bản pdf tại đây.

